Этиологическая диагностика аллергических заболеваний на примере клинического случая
- Аннотация
- Статья
- Ссылки
- English
В статье на клиническом примере продемонстрировано значение компонентной диагностики для выявления спектра сенсибилизации и назначения обоснованного этиологического лечения.
В статье на клиническом примере продемонстрировано значение компонентной диагностики для выявления спектра сенсибилизации и назначения обоснованного этиологического лечения.



Введение
Для выбора тактики терапии аллергических заболеваний необходимо не только поставить нозологический диагноз, но и провести специфическую этиологическую диагностику. Этот этап включает сбор аллергологического анамнеза и тестирование in vivo и in vitro для установления причинно-значимых аллергенов.
Молекулярная компонентная диагностика позволяет идентифицировать сенсибилизацию к конкретным аллергенам и персонализировать элиминационные мероприятия, а также аллерген-специфическую иммунотерапию.
Клинический случай
Пациентку К. пяти лет беспокоили высыпания на коже, выраженный зуд (семь-восемь баллов по визуальной аналоговой шкале), ночные пробуждения из-за зуда три-четыре раза в неделю. Дебют заболевания отмечен в четыре месяца, когда была введена стандартная молочная формула. Конкретные провоцирующие факторы родителями определены не были. При контакте с кошкой появлялись чихание и зуд в носу, при употреблении рыбы (лосось) – анафилаксия в виде одышки, крапивницы, потери сознания. Сезонных симптомов ринита не отмечено. Отец девочки в детстве страдал диатезом. Ребенок периодически получал антигистаминные препараты второго поколения, топические глюкокортикостероиды, эмоленты с незначительным улучшением.
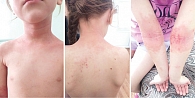
Объективно обнаружены выраженная сухость кожи, шелушение, участки эритемы и папулезных высыпаний, а также следы от расчесов и корочки (рис. 1). Преимущественная локализация высыпаний – грудь, спина, разгибательные поверхности рук и ног.
Степень тяжести дерматита определена по индексу SCORAD (рис. 2) [1–3]. Его рассчитывали по формуле: SCORAD = A : 5 + 7B : 2 + C. В данном случае он составил 78 баллов (90 : 5 + 7 × 14 : 2 + 11). Показатель более 50 баллов соответствует тяжелой степени атопического дерматита.
На основании жалоб, данных анамнеза и объективных данных установлен предварительный диагноз [1, 4]:
- атопический дерматит, эритемато-сквамозная форма с инфильтрацией, распространенный процесс, тяжелое течение, период обострения;
- аллергический ринит, круглогодичное эпизодическое течение легкой степени тяжести;
- клинически аллергия к рыбе (анафилаксия в анамнезе), шерсти кошки (ринит).
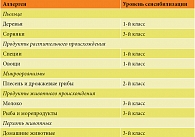
Распространенные кожные высыпания, постоянный прием антигистаминных препаратов, а также ограничение спектра аллергенов для кожного тестирования обусловили необходимость назначения аллергодиагностики in vitro [5]. Был проведен тест Allergy Explorer 2, позволяющий оценить сенсибилизацию к большой группе высокоприоритетных компонентных аллергенов. Краткие результаты представлены в табл. 1. Необходимо отметить, что отрицательному уровню соответствует концентрация иммуноглобулина E (IgE) менее 0,3 kUA/L, первому классу (низкому уровню) – концентрация от 0,3 до 1,0 kUA/L, второму классу (умеренному уровню) – концентрация от 1,0 до 5,0 kUA/L, третьему классу (высокому уровню) – концентрация от 5,0 до 15,0 kUA/L, четвертому классу (очень высокому уровню) – концентрация более 15,0 kUA/L.
Согласно результатам краткого отчета, у пациентки К. имела место сенсибилизация к пыльце деревьев, сорных трав, специям, овощам, плесневым грибам, молоку, рыбе, перхоти домашних животных. Совпадение данных анамнеза с результатами аллергологического обследования явно прослеживалось только для аллергенов рыбы и перхоти домашних животных. В данном случае этиология считается доказанной [5]. Роль сенсибилизации к другим аллергенам была неясной и требовала дальнейшей диагностики.
Уровень общего IgE соответствовал верхней границе нормы – 100 МЕ/мл, несмотря на достаточно высокие уровни специфических IgE (третий класс) к пыльце сорных трав, молоку, рыбе и перхоти домашних животных. Известно, что низкие или нормальные значения общего IgE не исключают наличия IgE-опосредованных заболеваний [5–8].
Результаты анализа экстрактов и молекул аллергенов по этиологическим группам оказались положительными.
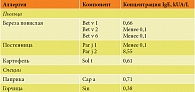
Пыльца и растительные продукты (табл. 2). Выявлен высокий уровень сенсибилизации к Par j 2 постенницы и низкий уровень сенсибилизации к Bet v 1 березы, Sol t картофеля, Cap a паприки и Sin горчицы.
Par j 2 – мажорный аллерген постенницы, белок-переносчик липидов (аналог Mal d 3 яблока) [9]. Несмотря на высокий уровень сенсибилизации, аллергия к Par j 2 не была клинически значимой, поскольку постенница практически не произрастает в регионе проживания ребенка и ее пыльца не имеет значения при формировании пыльцевой аллергии.
Bet v 1 – мажорный аллерген березы, который относится к PR-10-белкам, часто вызывающим перекрестные реакции с другими гомологами Bet v 1, но при этом ассоциированным с невысоким риском анафилаксии [9]. Аллергия к данному компоненту является показанием для назначения аллерген-специфической иммунотерапии. Поскольку у пациентки К. в анамнезе отсутствовали клинические симптомы в период палинации березы, данную сенсибилизацию расценивали как латентную и рекомендовали дополнительное наблюдение за состоянием в апреле и мае.
Sol t (пататин) – основной аллерген картофеля, проявляющий перекрестную реактивность с основным латексным аллергеном Hevea brasiliensis Hev b 7, что объясняет участие картофеля в синдроме «латекс – фрукты» [9]. Для уточнения у данного ребенка роли картофеля в течении атопического дерматита требуется проведение элиминационно-провокационных тестов [10].
Выявлены также низкие уровни сенсибилизации к аллергенам паприки Cap a и горчицы Sin, не имеющим клинического подтверждения у пациентки К.
Таким образом, у ребенка были выявлены разные группы растительных аллергенов с недоказанным вкладом в течение заболевания.
Плесень и дрожжевые грибы (табл. 3). У девочки выявлена сенсибилизация к циклофилину дрожжевых грибов рода Malassezia (Mala s 6), что коррелирует с клинической картиной дерматита (см. рис. 1), а именно с синдромом «голова – шея» [11]. Липофильные грибы рода Malassezia spp. предпочитают участки кожи, богатые сальными железами, а именно кожу головы, шеи, груди, что и отмечается у данного ребенка. Выявление специфических IgE к Malassezia в сочетании с клинической картиной требует включения в комплексную терапию атопического дерматита антимикотических препаратов.
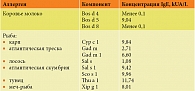
Продукты животного происхождения (табл. 4). Выявлен третий класс сенсибилизации к β-лактоглобулину (Bos d 5) – основному сывороточному белку коровьего молока, ответственному за перекрестные реакции на молочные белки других видов млекопитающих [9]. Это один из частых этиологических факторов развития атопического дерматита [1, 10], особенно в младенчестве (высыпания у ребенка появились после введения молочной смеси), поэтому в данном случае показана элиминация молочных продуктов всех видов животных (коров, коз и др.).
Анафилаксия при употреблении рыбы, высокий уровень специфических IgE (третий класс) к парвальбумину различных видов рыб требуют исключения из рациона всех видов рыб, как морских, так и речных.
Перхоть животных (табл. 5). У пациентки К. выявлена сенсибилизация к перхоти кошки и собаки, при этом молекулярные компоненты различались. Липокалины Can f 1, Can f 2 и Can f 4 составляют подавляющее большинство аллергенов перхоти млекопитающих. Необходимо отметить, что β-лактоглобулин также относится к группе липокалинов, однако перекрестной активности между липокалинами перхоти животных и β-лактоглобулином не описано. Известно, что Can f 1 перекрестно реагирует с липокалином слезы человека Lcn-1, но клиническое значение данной перекрестной реакции пока недостаточно изучено [12].
У пациентки К. обнаружен крайне высокий уровень IgE к утероглобину кошки (Fel d 1), что объясняет клинические симптомы при контакте с животным (чихание и зуд в носу) и является показанием для элиминации аллергена из окружения ребенка. Утероглобины не имеют перекрестных реакций с липокалинами, то есть источники сенсибилизации к кошке и собаке разные.
Проведенное исследование позволило сформулировать клинический диагноз:
- атопический дерматит, эритемато-сквамозная форма, распространенный процесс, тяжелое течение, период обострения;
- аллергия к молоку (β-лактоглобулин), рыбе (парвальбумин), вероятная аллергия к картофелю (Sol t);
- аллергический ринит, средняя степень тяжести, круглогодичное персистирующее течение;
- аллергия к кошке (Fel d 1) и собаке (липокалин);
- анафилаксия на рыбу;
- вероятна латентная сенсибилизация к пыльце березы.
Рекомендованы элиминация молока и молочных продуктов, включая молоко коровы, козы и других видов животных (из-за высокой гомологии β-лактоглобулина), любой рыбы, как морской, так и речной, максимальное ограничение контакта с домашними животными (кошками и собаками).
С учетом сенсибилизации к Malassezia помимо базисных препаратов для лечения атопического дерматита необходимы антимикотические препараты.
Заключение
Обнаружение специфических IgE позволяет уточнить этиологию заболевания, но ограничение исследования кратким отчетом или скрининговыми панелями может привести к диагностическим ошибкам и ухудшению качества жизни пациентов из-за необоснованных элиминационных мероприятий. Применение компонентной диагностики способствует уточнению спектра сенсибилизации и, как следствие, назначению этиологической терапии. Однако молекулярное тестирование, как и любой метод диагностики, не является абсолютным и требует корреляции с клинической картиной.
S.N. Buynova, PhD, V.M. Shinkareva
Irkutsk State Medical Academy of Postgraduate Education – branch of Russian Medical Academy of Continuous Professional Education
Irkutsk State Regional Children's Clinical Hospital
Contact person: Svetlana N. Buynova, 33s1@rambler.ru
Specific etiological testing is an integral part of the diagnosis of allergic diseases. Molecular component diagnostics makes it possible to identify sensitization to specific allergen molecules, what it possible to carry out personalized elimination measures and allergen-specific immunotherapy.
The article demonstrates the importance of component diagnostics for detecting the spectrum of sensitization and prescribing reasonable etiological treatment using a clinical example.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.