Клинико-иммунологические показатели у пациентов с новой коронавирусной инфекцией и сопутствующими аллергическими заболеваниями
- Аннотация
- Статья
- Ссылки
- English
Выявлены статистически значимые различия между клиническими проявлениями, показателями функциональной диагностики и назначением иммунобиологических препаратов у больных COVID-19 без и с аллергическими реакциями и заболеваниями (аллергическим ринитом, бронхиальной астмой). Так, в зависимости от наличия или отсутствия АЗ потеря обоняния наблюдалась в 14 (8,0%) и 31 (17,7%) случае соответственно, одышка – в 63 (36,0%) и 82 (46,9%) случаях, боль в грудной клетке – в 24 (13,7%) и 38 (21,7%). Жалобы на повышенную потливость чаще предъявляли при АЗ – 37 (21,1%) против 16 (9,1%) пациентов. Повышение температуры тела до субфебрильной также чаще фиксировалось у лиц с АЗ – 29 (16,6%) против 17 (9,7%). Показатели функциональной диагностики были более выраженными в отсутствие АЗ. При оценке степени поражения легких КТ-3 выявлена у 36 (20,6%) пациентов без АЗ и 25 (14,3%) – с АЗ, КТ-4 – у 13 (7,4%) и 6 (3,4%) соответственно. Иммунобиологические препараты (олокизумаб в дозе 128 мг и левилимаб в дозе 324 мг) получали 47 (26,9%) лиц с АЗ и 96 (54,9%) – без АЗ. Не нуждались в такой терапии 99 (56,6%) и 50 (28,6%) больных соответственно (р < 0,05).
Выявлены статистически значимые различия между клиническими проявлениями, показателями функциональной диагностики и назначением иммунобиологических препаратов у больных COVID-19 без и с аллергическими реакциями и заболеваниями (аллергическим ринитом, бронхиальной астмой). Так, в зависимости от наличия или отсутствия АЗ потеря обоняния наблюдалась в 14 (8,0%) и 31 (17,7%) случае соответственно, одышка – в 63 (36,0%) и 82 (46,9%) случаях, боль в грудной клетке – в 24 (13,7%) и 38 (21,7%). Жалобы на повышенную потливость чаще предъявляли при АЗ – 37 (21,1%) против 16 (9,1%) пациентов. Повышение температуры тела до субфебрильной также чаще фиксировалось у лиц с АЗ – 29 (16,6%) против 17 (9,7%). Показатели функциональной диагностики были более выраженными в отсутствие АЗ. При оценке степени поражения легких КТ-3 выявлена у 36 (20,6%) пациентов без АЗ и 25 (14,3%) – с АЗ, КТ-4 – у 13 (7,4%) и 6 (3,4%) соответственно. Иммунобиологические препараты (олокизумаб в дозе 128 мг и левилимаб в дозе 324 мг) получали 47 (26,9%) лиц с АЗ и 96 (54,9%) – без АЗ. Не нуждались в такой терапии 99 (56,6%) и 50 (28,6%) больных соответственно (р < 0,05).

Введение
В настоящее время выявлены факторы, влияющие на восприимчивость, тяжесть течения и смертность от новой коронавирусной инфекции, вызванной SARS-CoV-2 (COVID-19). К таковым относятся демографические характеристики, наличие сопутствующих заболеваний и определенные лабораторные показатели [1, 2].
Факторами тяжелого течения и риска неблагоприятного исхода COVID-19 признаны пожилой возраст, ожирение, онкологические, сердечно-сосудистые заболевания и сахарный диабет. До сих пор неясно, следует ли относить хронические респираторные заболевания, в частности астму или другие аллергические заболевания (АЗ), к таковым. В ряде исследований получены противоречивые результаты. Кроме того, указано, что многие факторы способны играть значимую роль в восприимчивости и тяжести течения COVID-19 у пациентов с астмой [1–5].
Подавляющее большинство исследователей отмечают, что астма и отягощенный аллергологический анамнез не повышают восприимчивость к COVID-19 и не влияют на тяжесть течения инфекции. Поэтому особый интерес могут представлять механизмы взаимодействия между аллергическим фоном, коронавирусной инфекцией и тяжелым респираторным синдромом.
У пациентов с бронхиальной астмой (БА), атопическим дерматитом, аллергическим ринитом (АР), хроническим риносинуситом, пищевой и лекарственной аллергией нередко наблюдается избыточная активация иммунных и воспалительных механизмов с участием эпителиальных клеток, врожденных лимфоидных клеток, дендритных клеток, Т-клеток, эозинофилов, тучных клеток, базофилов и цитокинов Th2, в частности интерлейкинов (ИЛ) 4, 5, 9, 13 и 31 [6].
Описаны три периода воздействия SARS-CoV-2 на организм, границы между которыми остаются неопределенными. Течение COVID-19 варьируется от бессимптомного до очень тяжелого, вплоть до летального исхода [5]. Однако объяснений этому пока нет.
В одних исследованиях продемонстрировано, что COVID-19 редко развивается при БА. Согласно данным других исследований, БА относительно часто встречается у пациентов с COVID-19. Нередко БА упоминается как сопутствующая патология [6–9]. Среди частых сопутствующих заболеваний при COVID-19 указываются сердечно-сосудистые [10, 11].
Согласно данным центров по контролю и профилактике заболеваний, в Китае только у 2,4% из 44 672 обследованных с COVID-19 имели место хронические респираторные заболевания, включая БА [3]. В другом исследовании, в ходе которого в Китае были обследованы 1590 пациентов, сообщалось об отсутствии сопутствующей БА [4].
Исследование, проведенное в Ломбардии (Италия), также показало относительно низкую распространенность обструктивных заболеваний легких среди больных COVID-19. Так, из 1591 пациентов обструктивные заболевания легких были отмечены только у 42 (4%). В Нью-Йорке (США) частота БА составила 9% от 5700 обследованных с COVID-19 [5].
Ни в одном из исследований не были описаны клинические фенотипы и особенности терапии БА у пациентов с COVID-19.
Цель исследования
Целью настоящего исследования стала оценка клинических, лабораторных и функциональных особенностей, влияющих на тяжесть течения, риск развития осложнений и летального исхода у пациентов с COVID-19, аллергическими заболеваниями или реакциями.
Задачи исследования
Перед исследователями стояли следующие задачи.
- Оценить и сравнить клинические показатели тяжести течения инфекции, вызванной SARS-CoV-2, а именно: повышение температуры тела, слабость, потливость, кашель с мокротой и без отхождения мокроты, одышка, боль в грудной клетке, боль в горле, у пациентов с аллергическими заболеваниями или аллергическими реакциями и без таковых.
- Оценить и сравнить лабораторные показатели, такие как уровень лейкоцитов, эозинофилов, лимфоцитов, нейтрофилов, С-реактивного белка, интерлейкина 6, международного нормализованного отношения (МНО), фибриногена, скорость оседания эритроцитов.
- Оценить и сравнить функциональные показатели лучевой диагностики (компьютерная томография органов грудной клетки (КТ ОГК)) по степени изменения паренхимы легких, наличие уплотнения по типу матового стекла на момент поступления в стационар и при выписке.
4. Cравнить тяжесть течения COVID-19 у пациентов с аллергическими заболеваниями или аллергическими реакциями и без таковых.
Материал и методы
Проанализированы данные электронных медицинских карт из базы Федерального научно-клинического центра специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства (ФНКЦ ФМБА).
Изучены истории болезней 2437 пациентов с COVID-19, проходивших лечение в 2020 и 2021 гг. в ФНКЦ ФМБА.
Все протоколы исследования были одобрены этическим комитетом ФНКЦ ФМБА.
Исследование проведено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации 2013 г. и действующим в Российской Федерации приказом Минздрава России от 19.06.2003 № 266.
Критерии включения в исследование:
- возраст от 18 лет;
- пациенты с новой коронавирусной инфекцией;
- наличие АР и/или атопической БА, пищевой или лекарственной непереносимости или отсутствие аллергических заболеваний.
Критерии исключения из исследования:
- наличие первичных иммунодефицитов;
- наличие тяжелых соматических заболеваний в стадии суб- и декомпенсации (геморрагический синдром, диабет, заболевания печени, эндокринной системы, почек и других внутренних органов, аутоиммунные заболевания, активная и латентная форма туберкулеза);
- наличие тяжелых аллергических заболеваний (тяжелая персистирующая БА, атопический дерматит тяжелого течения, АР тяжелой степени, полипоз носа второй – четвертой степени);
- прием иммунотропных препаратов в течение шести предыдущих месяцев.
Отобрано 350 пациентов с COVID-19. Возраст участников исследования составлял от 18 до 87 лет. Из 350 пациентов было 234 женщины и 116 мужчин. До госпитализации все больные обследовались и наблюдались по месту жительства.
В основную группу вошли 175 пациентов с COVID-19, аллергическими заболеваниями (БА, АР) или реакциями (пищевая и лекарственная непереносимость). Группа лиц с пищевой и лекарственной непереносимостью отдельно не выделялась, так как при госпитализации имели место жалобы на аллергические реакции (уртикарные высыпания, зуд).
Группу сравнения составили 175 больных COVID-19 без аллергических заболеваний и реакций.
Группы были сопоставимы по полу, возрасту, тяжести течения COVID-19 и сопутствующим заболеваниям.
У 38 пациентов (20 женщин и 18 мужчин) диагностирован АР: у 20 – интермиттирующий легкой степени, у 18 – персистирующий средней степени тяжести. У 46 больных выявлена атопическая БА: у 15 – интермиттирующая легкой степени тяжести, у 31 – персистирующая средней степени тяжести. Сочетание с БА имело место у 22 пациентов с интермиттирующим АР легкой степени и 24 пациентов с персистирующим АР средней степени тяжести.
По поводу БА больные получали ингаляционные глюкокортикостероиды (Симбикорт Турбухалер в дозе 80 мкг/4,5 мкг или 160 мкг/4,5 мкг), монтелукаст в дозе 10 мг курсами для достижения контроля [12]. При АР пациентам были рекомендован туалет носа (водно-солевые промывания), по показаниям гексэтидин в виде полосканий или орошения ротоглотки два раза в день, левоцетиризин (первая ступень) в дозе 5 мг/сут, монтелукаст в дозе 10 мг. При АР средней степени тяжести добавляли назальные глюкокортикостероиды (мометазон) под контролем симптомов [13]. У 50 пациентов была диагностирована пищевая непереносимость. Так, у них отмечались уртикарные высыпания при погрешности питания (морепродукты, цитрусовые, мед, шоколад). Им были рекомендованы гипоаллергенная диета и ведение пищевого дневника. У 41 пациента обнаружена непереносимость препаратов (уртикарные высыпания, зуд) для лечения сопутствующих заболеваний. Симптомы купировались после замены лекарственных средств. По показаниям больные получали цетиризин, эмоленты и смягчающие средства (декспантенол), местные глюкокортикостероиды (гидрокортизона бутират в виде 0,1%-ного крема). Крем с глюкокортикостероидами наносили тонким слоем на пораженные участки кожи один-два раза в день.
Диагнозы были поставлены по месту жительства и подтверждены после выздоровления.
При АР и БА наблюдали повышение уровня общего и специфических иммуноглобулинов E, чего не было обнаружено при пищевой и лекарственной непереносимости.
В период госпитализации сопутствующие заболевания и COVID-19 лечили согласно действующим стандартам.
Иммунобиологические препараты назначали с учетом тяжести COVID-19 и под контролем уровня ИЛ-6: олокизумаб (Артлегиа) (Bristol Myers Squibb, США) в дозе 64 мг (0,4 мл) (суммарная курсовая доза – 128 мг), левилимаб (Илсира) («Биокад», Россия) в дозе 162 мг (0,9 мл) (суммарная курсовая доза – 324 мг).
В основной группе и группе сравнения суммарные дозы и количество пациентов, получавших препараты разных фирм, были аналогичными.
Диагноз COVID-19 подтверждали выявлением РНК коронавирусов SARS-CoV-2 методом полимеразной цепной реакции на амплификаторе детектирующем ДТпрайм методом обратной транскрипции в режиме реального времени с использованием тест-системы ДНК-технология («ДНК-Технология», Россия). Лечение проводилось в соответствии с Временными методическими рекомендациями (версия 17 от 14.12.2022) [14].
Пациенты, инфицированные SARS-CoV-2, получали поддерживающую патогенетическую и симптоматическую терапию.
Лабораторные показатели определяли стандартными методами в первые-вторые сутки при поступлении, в стационаре – по показаниям и при выписке. Клинический анализ крови выполняли на анализаторе SYSMEX NX-1000 (Sysmex, Япония).
С-реактивный белок исследовали в сыворотке крови количественным иммунотурбидиметрическим методом на анализаторе ABBOTT ARCHITECT 800 (Abbott Laboratories, США) с помощью тест-системы Architect (Sentinel, Италия).
Уровень ИЛ-6 в сыворотке крови определяли иммунохимическим методом на анализаторе Cobas e 41 (Roche, США) с применением соответствующей тест-системы (Roche, США).
Оценивали риск тромбообразования. Коагулограмму (активированное частичное тромбопластиновое время, МНО, фибриноген, тромбиновое время, аденозиндифосфат) выполняли на автоматическом анализаторе (коагулометре) ACL TOP 550 (CTS, США), количественное определение фибриногена по Клаусу в человеческой цитратной плазме – на коагулометрических системах IL, протромбиновое время – на коагулометрах IL в цитратной человеческой плазме с реактивами РекомбиПласТин 2ж, Hemosil. МНО (международный индекс чувствительности к дефициту протромбинового комплекса) рассчитывали по следующей формуле: протромбиновое время исследуемой плазмы : среднее значение протромбинового времени нормального диапазона.
Всем пациентам в момент поступления проводилась мультиспиральная КТ ОГК. В период нахождения в стационаре ее проводили повторно в отсутствие динамики и/или при ухудшении самочувствия. Оценивались такие показатели, как объем нефункциональной легочной ткани в совокупности с другими признаками и результатами мультиспиральной КТ с использованием шкалы визуальной оценки легких, разработанной во время пандемии новой коронавирусной инфекции. При определении степени тяжести поражения легких также учитывали наличие изменений по типу матового стекла. Матовые стекла – светлые участки легких на томограммах, которые свидетельствуют об очагах инфильтрации. Их распространенность и консолидация соответствуют более тяжелой степени поражения легких – КТ-3 и КТ-4 [14].
У всех участников исследования были проанализированы клинико-лабораторные и иммунологические показатели, данные функциональной диагностики (мультиспиральной КТ ОГК), назначенные в период нахождения в стационаре иммунобиологические препараты, необходимость подключения к искусственной вентиляции легких и летальность.
Статистическая обработка результатов выполнена с помощью программы Standart с использованием пакета программ Statistica 6.0. Применены вариационный, одно- и многофакторный корреляционный виды статистического анализа с определением критериев достоверности по Стьюденту, интервальной оценкой квадратичного отклонения и дисперсии нормального распределения по критерию χ2, U-критерию Манна – Уитни, среднего геометрического титра антител.
Результаты и их обсуждение
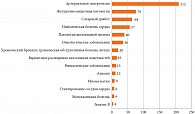
Спектр сопутствующих заболеваний в исследуемой популяции представлен на рис. 1. У 212 пациентов отмечалась артериальная гипертензия, у 76 – желудочно-кишечная патология, у 64 – сахарный диабет, у 57 – ишемическая болезнь сердца, у 40 – патология щитовидной железы. Онкологические заболевания диагностированы у 36 больных. Важно отметить, что чаще всего наблюдалось несколько сопутствующих состояний. Распределение сочетанной патологии в основной группе и группе сравнения было схожим.
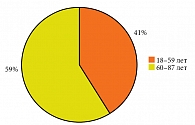
Среди госпитализированных преобладали лица от 60 до 87 лет. Таковых насчитывалось 59%. В основной группе и группе сравнения в возрасте от 60 до 87 лет было 106 и 100 пациентов соответственно. Остальные 41% приходились на популяцию от 18 до 59 лет. Распределение пациентов данной возрастной категории было следующим: 71 – в основной группе, 73 – в группе сравнения (рис. 2).
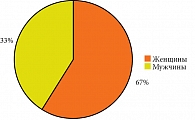
Женщины заболевали чаще, чем мужчины, – 67 против 33%. В основной группе было 114 пациенток, в группе сравнения – 120. Количество мужчин в обеих группах составляло 56 и 60 соответственно (рис. 3).
Клинические проявления патологии при поступлении различались у пациентов с и без АЗ (табл. 1). Чаще всего отмечались повышение температуры тела, слабость, потливость, кашель с или без отхождения мокроты, одышка, боль в грудной клетке, боль в горле. В основной группе потеря обоняния наблюдалась у 14 (8,0%) больных, в группе сравнения – у 31 (17,7%) (р < 0,007), одышка – у 63 (36,0%) и 82 (46,9%) соответственно (р < 0,039), боль в грудной клетке – у 24 (13,7%) и 38 (21,7%) (р < 0,05). Разница была достоверной. Симптом повышенной потливости чаще наблюдали в основной группе – 37 (21,1%) против 16 (9,1%) (р < 0,002).
Присоединение одышки считается неблагоприятным фактором. Такие пациенты чаще переходили в критическое состояние и/или умирали.
В период госпитализации разница в количестве умерших в основной группе и группе сравнения не была достоверной.
Лабораторные показатели оценивали в день поступления, на пике заболевания и при выписке. Проанализированы уровень ИЛ-6, МНО, фибриногена, С-реактивного белка, лейкоцитов, нейтрофилов, эозинофилов, лимфоцитов, скорость оседания эритроцитов по Вестергрену. Значимых различий между основной группой и группой сравнения не выявлено.
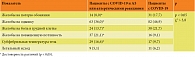
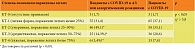
По результатам мультиспиральной КТ в основной группе преимущественно обнаруживали КТ-2, что соответствует умеренному течению патологии и поражению 25–50% легких. В группе сравнения течение патологии было более тяжелым и с большим процентом поражения легочной ткани (табл. 2), диагнозом «интерстициальная пневмония».
Пациентам основной группы в два раза реже требовалось назначение олокизумаба (препарата Артлегия) в курсовой дозе 128 мг или левилимаба (препарата Илсира) в дозе 324 мг. Количество больных в основной группе, получивших по одному курсу препаратов, было достоверно меньше (табл. 3). В основной группе 99 (56,6%) больным не потребовалось введения ИЛ-6, в группе сравнения – 50 (28,6%). Разница оказалась достоверной (р < 0,05). Процент получавших олокизумаб или левилимаб в основной группе и группе сравнения был аналогичным.
Сердечно-сосудистые заболевания – наиболее частая коморбидная патология у пациентов с COVID-19 [10]. Метаанализ шести клинических исследований, включивших 1527 случаев новой коронавирусной инфекции, продемонстрировал наличие артериальной гипертензии у 17,1% пациентов, ишемической болезни сердца и/или цереброваскулярной болезни – у 16,4%, сахарного диабета 2 типа – у 9,7% пациентов. Сопутствующая патология ассоциировалась с наиболее тяжелым состоянием у поступавших в отделение интенсивной терапии [11].
Согласно результатам китайского исследования, коморбидная патология существенно повышала риск неблагоприятного исхода [15]. Установлено, что у пациентов с сердечно-сосудистыми заболеваниями летальность увеличивалась до 10,5%, у пациентов с сахарным диабетом 2 типа – до 7,3%, у пациентов c изолированной артериальной гипертензией – до 6,0%. При этом показатели летальности у этих больных в среднем составляли 2,3%. Итальянские ученые представили аналогичные данные [16]. Согласно китайскому протоколу, летальность от COVID-19 при наличии сердечно-сосудистых заболеваний составляла 13,2% по сравнению с 1% в популяции без коморбидной патологии. Отмечена также более высокая доля сахарного диабета (9,2%) и артериальной гипертензии (8,4%) у умерших пациентов [17, 18].
Среди возможных механизмов столь высокой распространенности сочетания коронавирусной инфекции и сердечно-сосудистых заболеваний следует указать на потенциально общие факторы риска развития. Например, возраст и инволюция иммунной системы повышают восприимчивость к вирусной инфекции и способствуют более тяжелому ее течению. Описано снижение титра протективных антител примерно на 50% у лиц старше 65 лет после вакцинации против гриппа. При этом у более молодых пациентов такой динамики не наблюдалось [19]. Такие факторы сердечно-сосудистого риска, как сахарный диабет и дислипидемия, способны нарушать иммунный ответ, повышая риск присоединения вирусной инфекции [20, 21]. Кроме того, сердечно-сосудистые заболевания рассматриваются в качестве маркера иммунного старения с негативным влиянием на течение и прогноз при COVID-19 [10].
С летальным исходом достоверно чаще было связано присоединение одышки [22, 23]. Респираторные симптомы (дыхательная недостаточность и низкая сатурация) в момент госпитализации признаны прогностически сильными предикторами крайне тяжелого течения COVID-19 и летальности [24, 25].
Астма и АЗ обычно характеризуются развитием воспаления Тh2-типа с участием эпителиальных клеток, врожденных лимфоидных клеток T2 (ILCs), макрофагов, T-клеток, дендритных клеток, Т-хелперов 2, эозинофилов, тучных клеток и базофилов. Роль активации Th2 и ILC2 описана в развитии воспаления при БА. Цитокины, включая ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-13 и ИЛ-31, действуют совместно с цитокинами, синтезируемыми эпителиальными клетками, ИЛ-33, ИЛ-25 и тимическим стромальным лимфопоэтином [8, 9].
Некоторые исследователи полагают, что при генетической предрасположенности к развитию АЗ могут снижаться восприимчивость к COVID-19 и, как следствие, тяжесть его течения [10, 11]. Противоречивые данные о распространенности астмы у госпитализированных пациентов с COVID-19 привели к обсуждению роли БА и ее различных фенотипов в восприимчивости к COVID-19, тяжести течения инфекции и смерти от нее, экспрессии ангиотензинпревращающего фермента 2 и других рецепторов для SARS-CoV-2 у пациентов с БА и без АЗ. Пока не изучено потенциальное воздействие других АЗ, включая АР, атопический дерматит, пищевую и лекарственную аллергию, и методов их лечения на тяжесть клинических симптомов COVID-19.
В настоящее время выделяют несколько возможных причин меньшей подверженности инфицированию SARS-CoV-2 и более легкого течения заболевания у пациентов с атопией [26, 27]:
- сниженная экспрессия рецепторов ангиотензинпревращающего фермента 2, которые являются мишенью для вируса, у пациентов с атопической БА и получающих ингаляционные глюкокортикостероиды;
- Th2-опосредованный тип воспаления (эффект ИЛ-4 и ИЛ-13);
- потенциальный протективный эффект эозинофилов;
- противовоспалительный эффект ингаляционных глюкокортикостероидов в отношении цитокинового шторма.
Выводы
Полученные нами результаты позволяют сделать следующие выводы.
- У пациентов с СOVID-19 и сопутствующими аллергическими заболеваниями или реакциями достоверно реже отмечались такие симптомы, как потеря обоняния, боль в грудной клетке, одышка, достоверно чаще – повышенная потливость, повышение температуры тела.
- В данной популяции достоверно чаще встречалась степень поражения легких КТ-2, реже – КТ-3 и КТ-4.
- Больше половины больных СOVID-19 с сопутствующими аллергическими заболеваниями или реакциями не нуждались в назначении таргетной терапии. В основной группе таких было 99 (56,6%), в группе сравнения – 50 (43,4%). В основной группе 57 (27%) пациентов получили по одному курсу олокизумаба или левилимаба, в группе сравнения – 96 (55%), при этом разница между группами оказалась достоверной.
- У пациентов с СOVID-19 и сопутствующими аллергическими заболеваниями или реакциями течение инфекции было менее тяжелым, что подтверждалось частотой клинических симптомов, результатами КТ и снижением потребности в таргетной терапии.
M.В. Shadyzheva, D.G. Chuvirov, PhD, A.V. Troitskiy, MD, PhD, T.P. Markova, MD, PhD, Prof.
Academy of Postgraduate Education of the Federal Scientific and Clinical Center of Specialized types of Medical Care and Medical Technologies of the Federal Medical-Biological Agency
National Research Center ‘Institute of Immunology’ Federal Medical-Biological Agency
Contact person: Madina В. Shadyzheva, madina.sch@yandex.ru
The article presents data on the severity of the course of the new coronavirus infection in patients with and without allergic diseases (AD).
Statistically significant differences were revealed between clinical manifestations, indicators of functional diagnosis and prescribed immunobiological drugs in COVID-19 patients without and with allergic reactions and diseases (allergic rhinitis, bronchial asthma). Thus, depending on the presence or absence of AD, loss of sense of smell was observed in 14 (8.0%) and 31 (17.7%) cases, respectively, shortness of breath – in 63 (36.0%) and 82 (46.9%) cases, chest pain – in 24 (13.7%) and 38 (21.7%). Complaints of excessive sweating were more common in AD – 37 (21.1%) versus 16 (9.1%) patients. An increase in body temperature to subfebrile was also more often recorded in individuals with AD – 29 (16.6%) versus 17 (9.7%). The indicators of functional diagnosis were more pronounced in the absence of AD. When assessing the degree of lung damage, CT-3 was detected in 36 (20.6%) patients without AD and 25 (14.3%) with AD, CT-4 in 13 (7.4%) and 6 (3.4%), respectively. Immunobiological drugs (olokizumab at a dose of 128 mg and levilimab at a dose of 324 mg) were received by 47 (26.9%) people with AD and 96 (54.9%) without AD. 99 (56.6%) and 50 (28.6%) patients did not need such therapy, respectively (p < 0.05).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.