Фенотипические особенности саркопении при жировой болезни печени
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В настоящее время актуальность проблемы саркопении и механизмов ее развития возрастает в связи с глобальным демографическим старением, а также распространенностью ожирения. Саркопения может возникать и в более раннем возрасте, что обусловлено различными причинами, в том числе неправильным питанием, недостаточной физической активностью, хроническими заболеваниями и др. По данным скринингового исследования пациентов с жировой болезнью печени, выделены и даны характеристики четырем фенотипам саркопении. Наиболее часто встречающийся фенотип саркопении – саркопеническое ожирение, а наименее распространенный – изолированная саркопения.
Заключение. Несмотря на то что изучением саркопении занимаются многие исследователи, на данный момент имеется недостаточно информации о маркерах этого состояния, методах диагностики, фенотипах саркопении с неалкогольной жировой болезнью печени, алкогольной болезнью печени, метаболически ассоциированной алкогольной болезнью печени, а также профилактике его развития у пациентов трудоспособного возраста с хроническими заболеваниями печени. Тем не менее достаточно четко прослеживается влияние саркопении на прогноз, выживаемость и частоту клинических осложнений у пациентов с хроническими заболеваниями печени. Это подчеркивает необходимость изучения саркопении, поиска ее предикторов и способов эффективного лечения.
Материал и методы. В настоящее время актуальность проблемы саркопении и механизмов ее развития возрастает в связи с глобальным демографическим старением, а также распространенностью ожирения. Саркопения может возникать и в более раннем возрасте, что обусловлено различными причинами, в том числе неправильным питанием, недостаточной физической активностью, хроническими заболеваниями и др. По данным скринингового исследования пациентов с жировой болезнью печени, выделены и даны характеристики четырем фенотипам саркопении. Наиболее часто встречающийся фенотип саркопении – саркопеническое ожирение, а наименее распространенный – изолированная саркопения.
Заключение. Несмотря на то что изучением саркопении занимаются многие исследователи, на данный момент имеется недостаточно информации о маркерах этого состояния, методах диагностики, фенотипах саркопении с неалкогольной жировой болезнью печени, алкогольной болезнью печени, метаболически ассоциированной алкогольной болезнью печени, а также профилактике его развития у пациентов трудоспособного возраста с хроническими заболеваниями печени. Тем не менее достаточно четко прослеживается влияние саркопении на прогноз, выживаемость и частоту клинических осложнений у пациентов с хроническими заболеваниями печени. Это подчеркивает необходимость изучения саркопении, поиска ее предикторов и способов эффективного лечения.
![Таблица 1. Кардиометаболические факторы риска (по [11])](/upload/resize_cache/iblock/d19/195_350_1/Adamova1.jpg)


Введение
Саркопения (от греч. sarx – тело, плоть, penia – снижение) – это мышечная недостаточность, в основе которой лежит прогрессирующая и генерализованная потеря массы и функции скелетных мышц, ассоциированная с метаболическими нарушениями, ростом неблагоприятных исходов, включая падения, функциональное снижение, хрупкость и смертность [1]. Термин «саркопения» был введен в клиническую практику в 1989 г. профессором И. Розенбергом и применялся для описания возрастного атрофического дегенеративного изменения скелетной мускулатуры, приводящего к постепенной потере мышечной массы и силы [2].
В настоящее время вопрос саркопении и механизмов ее развития становится все более актуальным, особенно с учетом глобального демографического старения, а также распространенности ожирения. До недавнего времени вопрос саркопении рассматривался мировым врачебным сообществом в отношении пожилой популяции пациентов, однако, согласно данным новых исследований, саркопения может возникать и в более раннем возрасте, что обусловлено различными причинами, в том числе неправильным питанием, недостаточной физической активностью, хроническими заболеваниями и др. [3]. Исходя из этого, принято разделение на первичную саркопению, связанную с возрастом, и вторичную, развивающуюся на фоне заболеваний.
Саркопения только в 2016 г. была выделена в самостоятельную нозологическую единицу и включена в Международную классификацию болезней. В 2009 г. была создана Европейская рабочая группа по изучению саркопении у пожилых людей (EWGSOP). В Международной классификации болезней 10-го пересмотра с клинической модификацией (International Classification of Diseases, 10th Revision, Clinical Modification, ICD-10-CM) код диагноза саркопении – M62.84 [4].
С появлением термина «саркопения» отмечен повышенный интерес к эпидемиологии, патогенезу и классификации этого состояния. В последнее время активно изучается взаимосвязь саркопении с различными хроническими заболеваниями. Так, имеются данные о том, что саркопения является важным прогностическим фактором, влияющим на выживаемость и частоту клинических осложнений у пациентов с хроническими заболеваниями печени (ХЗП), почек и др. [5–7].
По данным систематического обзора и метаанализа, распространенность первичной саркопении в мировой популяции составляет 10% (95%-ный доверительный интервал (95% ДИ) 8–12%) среди мужчин и 10% (95% ДИ 8–13%) среди женщин соответственно [8].
Жировая болезнь печени (ЖБП) возникает при патологии, имеющей общие патогенетические основы и различную этиологию. Значительную часть данной группы заболеваний составляют алкогольная (АБП) и неалкогольная жировая болезнь печени (НАЖБП). J. Ludwig и соавт. в 1980 г. при исследовании печени лиц, не злоупотреблявших алкоголем, обнаружили гистологическую картину, идентичную таковой при алкогольном гепатите [9].
В настоящее время установлено, что существуют перекрестные биологические процессы, которые могут способствовать развитию как НАЖБП, так и заболеваний печени, связанных с избыточным употреблением алкоголя. В 2023 г. было разработано консенсусное заявление Delphi по изменению номенклатуры «неалкогольная жировая болезнь печени» на термин «связанная с метаболической дисфункцией стеатозная болезнь печени», который объединяет пациентов с ЖБП независимо от количества и характера потребления алкоголя [10].
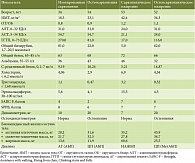
Критерии постановки диагноза основаны на наличии доказанного стеатоза печени и хотя бы одного из пяти кардиометаболических факторов риска (табл. 1).
Отдельно выделяют АБП. Кроме того, эксперты предложили использовать аббревиатуру MeтАБП для обозначения пациентов с НAЖБП, которые употребляют алкоголь в гепатотоксичных дозах (140–350 г в неделю для женщин и 210–420 г в неделю для мужчин; 20–50 г в день для женщин, 30–60 г в день для мужчин). Среди пациентов с MeтАБП следует выделять пациентов с преобладающей НAЖБП или АБП [11].
Последняя метааналитическая работа Z. Younossi и соавт. (2023) показала, что глобальная распространенность НАЖБП преодолела частоту в 30% и составляет 32,16% (95% ДИ 18,40–50,14) [12].
В эпидемиологическом исследовании, проведенном в Российской Федерации, ЭССЕ-РФ-2 распространенность стеатоза печени (индекс стеатоза печени (Fatty Liver Index – FLI) ≥ 60) составила 31,8%, в том числе 38,5% у мужчин и 26,6% у женщин, и значимо увеличивалась с возрастом, преобладая среди мужчин и сельских жителей. Кроме того, высокий FLI у мужчин статистически значимо ассоциировался с низкой физической активностью, а у женщин – с курением. Выявлена связь высокого уровня образования у женщин с более низким FLI (≥ 60) [13].
Одним из проявлений ЖБП может выступать саркопения. Распространенность саркопении выше у пациентов, страдающих НАЖБП, и коррелирует с тяжестью ЖБП. Один из патофизиологических механизмов развития саркопении связан с инсулинорезистентностью, которая играет важную роль в развитии НАЖБП. Скелетная мышца является одним из основных органов, участвующих в инсулинозависимом процессе утилизации глюкозы, поэтому снижение мышечной массы играет ключевую роль в инсулинорезистентности и метаболическом синдроме [14]. В обзоре Y. Yang и соавт. (2021) [15] рассмотрены молекулярные механизмы саркопении и остеосаркопении при ХЗП. Повышенная резорбция костей через активацию пути RANK – RANKL – OPG (рецепторный ядерный фактор каппа – RANK-лиганд – остеопротегерин) и воздействие воспалительных цитокинов считаются важными механизмами развития остеопороза при НАЖБП. Саркопения при НАЖБП связана с инсулинорезистентностью и ожирением, в то время как при циррозе печени (ЦП) на нее влияют гипераммониемия, низкий уровень аминокислот разветвленной цепи и гипогонадизм. Также значимую роль в развитии и прогрессировании саркопении играют миокины. Миокины представляют собой небольшие белки (5–20 кДа), секретируемые мышцами [16]. Наиболее изученным миокином является миостатин, также называемый фактором роста и дифференцировки 8, который относится к надсемейству трансформирующего фактора роста бета и в основном рассматривается как супрессор мышечного роста. Действительно, миостатин ингибирует синтез белка скелетных мышц путем связывания с рецептором активина типа IIB (ActRIIB) и последующего фосфорилирования Smad2 и Smad3. Этот процесс приводит к активации генов, участвующих в деградации мышечных белков, и одновременному ингибированию синтеза белка вследствие подавления рапамицин (mTOR)-опосредованного синтеза белка Akt млекопитающих (mTOR). Миостатин также способствует мышечной атрофии через путь белка O1 (FoxO1) и, ингибируя GLUT4 и AMP-активируемую протеинкиназу, снижает поглощение глюкозы в скелетных мышцах [18]. Помимо миокинов в регуляции обмена веществ скелетной мускулатуры участвует аммиак. Гипераммониемия активирует протеолиз скелетных мышц с помощью аутофагии и усиливает экспрессию миостатина, что нарушает синтез белков в мышцах с развитием впоследствии саркопении [19].
Миостатин экспрессируется преимущественно в скелетных мышцах и в меньшей степени – в жировой ткани и сердечной мышце [17]. Показано, что при ожирении наблюдается повышение уровня миостатина, и его влияние на адипогенез. Установлено также, что миостатин может индуцировать ингибирование биосинтеза иризина, способствуя увеличению жировой массы и снижению мышечной массы, что особенно опасно для людей с ХЗП, предрасполагая к развитию саркопенического ожирения [20]. Кроме того, остеопороз и саркопения имеют общие основные механизмы, включая инсулинорезистентность, снижение анаболических гормонов, таких как ИФР-1 и тестостерон, увеличение воспалительных цитокинов, включая интерлейкин-1 (ИЛ-1), ИЛ-6 и фактор некроза опухоли-α (ФНО-α), а также изменение кишечной микробиоты. Выявленные биохимические перекрестные механизмы между костью и мышцами через различные сигнальные пути подчеркивают распространенность комбинации остеопороза и саркопении. Эргокальциферол (витамин D) также является одним из регуляторов этих механизмов в костной и мышечной ткани. Он связывается с рецептором к витамину D на мышечных волокнах и увеличивает их размер, улучшая мышечную силу и функцию. В процессе старения количество рецепторов на мышечной ткани постепенно уменьшается и сопровождается более низкой чувствительностью к витамину D, что приводит к потере мышечной массы и мышечной силы [21].
Внешние и клинические проявления саркопении очень многообразны и, вероятно, обусловлены различным патогенезом развития данного состояния.
В настоящее время фенотипы саркопении представлены следующими вариантами: изолированная саркопения, остеосаркопения, саркопеническое ожирение, остеосаркопеническое ожирение. Изолированная саркопения и саркопеническое ожирение характеризуются снижением мышечной массы, ее функции и силы, но при этом плотность костной ткани остается в норме.
Клинические наблюдения
С целью выявления саркопении у пациентов с ЖБП проведено комплексное клинико-лабораторное и инструментальное обследование, включавшее определение общего и ионизированного кальция, витамина D в крови, липидного спектра; биохимический и общий анализ крови; ультразвуковое исследование (УЗИ) органов брюшной полости (ОБП); денситометрию; биоимпедансный анализ состава тела (БИАСТ) (рисунок).
На основании скрининга пациентов, находившихся на стационарном лечении в ГКБ им. В.М. Буянова, из 50 больных с НАЖБ и АБП (26 мужчин и 24 женщины) в возрасте от 33 до 79 лет (средний возраст – 59,5 ± 9,8 года) саркопения была выявлена у 25 пациентов.
Критерии включения в исследование: мужчины и женщины в возрасте от 18 лет с алкогольной и неалкогольной жировой болезнью печени, подписавшие информированное согласие на обследование и публикацию полученных результатов. Критерии исключения: пациенты с наличием злокачественных опухолей и декомпенсированных заболеваний сердца, легких, печени, почек, активной наркомании, токсикомании, острых инфекционных и психических заболеваний, отказ от подписания информированного согласия.
Протокол обследования и используемые опросники были утверждены локальным этическим комитетом Российского национального исследовательского медицинского университета им. Н.И. Пирогова (протокол № 235 от 18.12.2023). Все пациенты дали письменное информированное согласие на участие в исследовании и анализ их данных.
При анализе фенотипов саркопении выявлены остеосаркопения, саркопения, саркопеническое и остеосаркопеническое ожирение (табл. 2).
Таким образом, выявлено, что наиболее частым фенотипом саркопении является саркопеническое ожирение, а наименее распространенным – изолированная саркопения.
Далее рассмотрены клинические примеры фенотипов саркопении (табл. 3).
Наблюдение 1. Фенотип «изолированная саркопения»
Пациентка К. 34 лет находилась на стационарном лечении по поводу алкогольного гепатита. Из анамнеза известно, что она употребляет спиртосодержащие напитки в гепатотоксичных дозах в течение двух лет. Течение гепатита осложнилось энцефалопатией смешанного генеза (печеночная + токсическая) и судорожным приступом. Выявлена умеренная гепатомегалия по данным УЗИ. В биохимическом анализе крови установлены минимальный цитолиз, холестаз, дефицит витамина D. По результатам тестов и опросников установлено снижение мышечной силы и функции. При остеоденситометрии поясничного отдела позвоночника и проксимальных отделов обеих бедренных костей T-показатель в пределах нормы. По результатам БИАСТ, выявлено снижение активной клеточной массы.
Наблюдение 2. Фенотип «остеосаркопения»
Пациент П. 54 лет поступил для планового обследования с жалобами на общую слабость. Пациент длительное время страдает ЦП алкогольной этиологии класса А по Чайлду – Пью (6 баллов), сахарным диабетом второго типа (СД 2). По данным УЗИ ОБП, выявлены гепатоспленомегалия, дилатация селезеночной вены, мелкие конкременты желчного пузыря. В биохимическом анализе крови зарегистрированы гипергликемия, гипербилирубинемия, признаки холестаза, дефицит витамина D. Отмечено снижение мышечной функции и силы по данным исследования. При остеоденситометрии поясничного отдела позвоночника и проксимальных отделов обеих бедренных костей установлена остеопения. По результатам БИАСТ, активная клеточная, скелетно-мышечная и жировая массы – в пределах нормы.
Наблюдение 3. Фенотип «саркопеническое ожирение»
Пациентка В. 52 лет госпитализирована с жалобами на общую слабость, утомляемость, сонливость, одышку при минимальной физической нагрузке, боли в ногах, сухость кожи. В анамнезе имеется гипертоническая болезнь третьей степени, СД 2, НАЖБП, ожирение третьей степени. По данным УЗИ ОБП, выявлена умеренная гепатомегалия. В биохимическом анализе крови зарегистрированы дислипидемия, гипергликемия, дефицит витамина D. По данным опросников и тестов, отмечено затруднение при вставании со стула и ходьбе (тест «встань и иди»), снижение мышечной силы при динамометрии. При остеоденситометрии поясничного отдела позвоночника и проксимальных отделов обеих бедренных костей отклонений от нормы не выявлено. По данным БИАСТ, отмечено увеличение жировой массы, тощая и скелетно-мышечная массы – в пределах нормы.
Наблюдение 4. Фенотип «остеосаркопеническое ожирение»
Пациент Т. 53 лет поступил в стационар с жалобами на желтушность склер, одышку при минимальной физической нагрузке, отеки нижних конечностей. Из анамнеза известно, что пациент страдает ЦП смешанной этиологии (АБП + НАЖБП) класса B по Чайлду – Пью (8 баллов); гипертонической болезнью второй степени, ожирением первой степени. По данным УЗИ ОБП, выявлены гепатоспленомегалия, асцит. В биохимическом анализе крови зарегистрированы минимальный цитолиз, холестаз, гипоальбуминемия, дефицит эргокальциферола. По данным опросников и выполненных тестов, отмечено снижение мышечной функции и мышечной силы. При остеоденситометрии поясничного отдела позвоночника и проксимальных отделов обеих бедренных костей установлена остеопения. По результатам БИАСТ, выявлено увеличение жировой массы, активная и скелетная мышечная массы – в пределах нормы.
Обсуждение
Истощение мышечной и костной ткани тесно взаимосвязано с патологией печени. При целенаправленном выявлении саркопения зарегистрирована у половины пациентов с ЖБП. Развитие саркопении при ЖБП имеет мультифакториальный характер, в том числе связано с системным хроническим воспалением, отражением которого становятся повышенные концентрации провоспалительных цитокинов ИЛ-2, ИЛ-6, ИЛ-8 в жировой ткани.
В данном клиническом наблюдении рассматривается вторичная саркопения, ассоциированная с заболеваниями. По данным антропометрии, у пациентов с ожирением выявлен абдоминальный тип ожирения, сопровождающийся наличием НАЖБП, что может говорить о наличии кардиометаболических факторов риска. При анализе фенотипических вариантов саркопении обращает на себя внимание наличие остеопении у пациентов с ЦП, что подтверждается многими исследованиями: остеопения является репрезентативным осложнением заболевания печени [22, 23]. B. Crawford и соавт. [23] продемонстрировали, что частота остеопорозных переломов у пациентов с ХЗП примерно в два раза выше, чем у соответствующих по возрасту в группе контроля.
С учетом значительной роли этих нарушений опорно-двигательного аппарата как прогностических предикторов и их значимого участия в патогененезе заболеваний печени расширенные знания о молекулярном механизме этих нарушений могут способствовать улучшению не только диагностики и лечения самого расстройства опорно-двигательного аппарата, но и прогноза заболевания печени с помощью использования существующих потенциальных терапевтических средств для остеосаркопении, дальнейшему поиску и применению патогенетических методов лечения.
В отношении методов исследования саркопении и остеопении наименее чувствительным оказался БИАСТ, так как при выраженном снижении мышечной силы и функции, по данным динамометрии и опросников, сохранялась нормальная скелетно-мышечная и активная клеточная масса.
По мнению экспертов, более существенным клиническим маркером саркопении служит двухэнергетическая рентгеновская абсорбциометрия. Так, в исследовании C. Beaudart и соавт. саркопения выявлялась в 8,4–27,6% случаев, однако при использовании БИАСТ ее распространенность составляла 12,8%, а по данным двухэнергетической рентгеновской абсорбциометрии – 21% [24].
Следует отметить, что во всех наблюдениях выявлен дефицит эргокальциферола. Полученные данные и результаты многих исследований [21, 26, 27] позволяют сделать вывод о необходимости определения витамина D и его приема у пациентов с ХЗП для профилактики остео- и саркопении.
Основной стратегией профилактики и лечения саркопении является модификация образа жизни в виде включения физических упражнений в повседневную активность и коррекция питания. Силовые тренировки улучшают физическую силу и мышечную массу благодаря увеличению размера мышечных волокон типа II и набору массы скелетных мышц. Аэробные упражнения восстанавливают миофибры и улучшают кардиореспираторную физическую форму. Помимо вмешательства в образ жизни, надлежащая питательная поддержка (белок, незаменимая аминокислота, β-гидрокси-β-метилбутират, витамин D, креатинин и т.д.) имеет решающее значение при саркопении, а польза от физических упражнений усиливается благодаря нутритивной поддержке [25]. Установлено, что добавки эргокальциферола увеличивают мышечную силу, но не влияют на мышечную массу [26], сочетание белка и витамина D может улучшить такие функции, как подъем по лестнице, в дополнение к наращиванию мышечной массы [27].
Заключение
Таким образом, пациенты с саркопенией могут иметь широкий спектр клинических проявлений, обусловленных многофакторным патогенезом формирования саркопении. Необходимо учитывать фенотипические особенности саркопении у больных ЖБП. Это позволит специалистам первичного звена и стационара улучшить качество медицинской помощи по своевременному выявлению, лечению и профилактике данного состояния.
I.G. Adamova, B.M. Taraki, G.M. Ibragimova, I.G. Fedorov, PhD, O.O. Manuylova, PhD, I.G. Pshennikova, L.Yu. Ilchenko, PhD, Prof., I.G. Nikitin, PhD, Prof.
Pirogov Russian National Research Medical University, Moscow
V.M. Buyanov City Clinical Hospital, Moscow
Contact person: Imara G. Adamova, miss.imara@mail.ru
Objective – to show phenotypic variants of sarcopenia in patients with fatty liver disease.
Material and methods. Currently, the issue of sarcopenia and mechanisms of its development is becoming more and more relevant, taking into account the current trends of increasing life expectancy, as well
as the prevalence of obesity. Sarcopenia can also occur at an earlier age due to various reasons, including improper nutrition, insufficient physical activity and chronic diseases, among others. Four phenotypes of sarcopenia have been identified and characterized based on a screening study of patients with fatty liver disease. The most common phenotype of sarcopenia is sarcopenic obesity and the least common is isolated sarcopenia.
Conclusion. Despite the fact that sarcopenia attracts much attention of researchers, there is insufficient information on markers of this condition, diagnostic methods, phenotypes of sarcopenia with nonalcoholic fatty liver disease (NAFLD), alcoholic liver disease (ALD), metabolically associated alcoholic liver disease (MetALD), and prevention of its development in working-age patients with chronic liver disease.
However, the impact of sarcopenia on prognosis, on survival and on the incidence of clinical complications in patients with chronic liver disease is quite clear. This emphasizes the need to study sarcopenia, search for its predictors and ways of effective treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.