Саркопеническое ожирение и индекс саркопении у женщин пожилого возраста с артериальной гипертензией и висцеральным ожирением
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить распространенность и клинические особенности саркопенического ожирения, а также возможность использования ИС для его диагностики у женщин пожилого возраста с артериальной гипертензией (АГ) и висцеральным ожирением.
Материал и методы. Обследовано 95 женщин в возрасте от 60 до 74 лет с АГ первой – третьей степени, индексом массы тела ≥ 30 кг/м2 и окружностью талии > 88 см.
Всем участницам исследования проведены антропометрия, тест с шестиминутной ходьбой, кистевая динамометрия, биоимпедансный анализ. Индекс саркопении рассчитывался как отношение уровня сывороточного креатинина (мг/дл) к уровню сывороточного цистатина С (мг/л), умноженное на 100%.
Результаты. Распространенность саркопенического ожирения в данной популяции составила 16,8%. У участниц исследования с саркопеническим ожирением имели место более выраженное висцеральное ожирение, повышенный уровень цистатина С, низкая скорость клубочковой фильтрации по цистатину С, худшие результаты теста с шестиминутной ходьбой, а также меньший ИС. Индекс саркопении коррелировал с мышечной массой и силой. Пороговое значение ИС для диагностики саркопенического ожирения составило 80,0% с чувствительностью 67,2% и специфичностью 84,6%.
Заключение. Данный фенотип ожирения характеризовался выраженным висцеральным ожирением, неблагоприятными функциональными характеристиками, низкой функцией почек и меньшими значениями ИС. Полученные нами результаты позволяют рекомендовать ИС для скрининга саркопенического ожирения у женщин пожилого возраста с АГ и висцеральным ожирением.
Цель исследования – оценить распространенность и клинические особенности саркопенического ожирения, а также возможность использования ИС для его диагностики у женщин пожилого возраста с артериальной гипертензией (АГ) и висцеральным ожирением.
Материал и методы. Обследовано 95 женщин в возрасте от 60 до 74 лет с АГ первой – третьей степени, индексом массы тела ≥ 30 кг/м2 и окружностью талии > 88 см.
Всем участницам исследования проведены антропометрия, тест с шестиминутной ходьбой, кистевая динамометрия, биоимпедансный анализ. Индекс саркопении рассчитывался как отношение уровня сывороточного креатинина (мг/дл) к уровню сывороточного цистатина С (мг/л), умноженное на 100%.
Результаты. Распространенность саркопенического ожирения в данной популяции составила 16,8%. У участниц исследования с саркопеническим ожирением имели место более выраженное висцеральное ожирение, повышенный уровень цистатина С, низкая скорость клубочковой фильтрации по цистатину С, худшие результаты теста с шестиминутной ходьбой, а также меньший ИС. Индекс саркопении коррелировал с мышечной массой и силой. Пороговое значение ИС для диагностики саркопенического ожирения составило 80,0% с чувствительностью 67,2% и специфичностью 84,6%.
Заключение. Данный фенотип ожирения характеризовался выраженным висцеральным ожирением, неблагоприятными функциональными характеристиками, низкой функцией почек и меньшими значениями ИС. Полученные нами результаты позволяют рекомендовать ИС для скрининга саркопенического ожирения у женщин пожилого возраста с АГ и висцеральным ожирением.





Введение
Согласно прогнозам, к 2030 г. более 1 млрд лиц пожилого и старческого возраста будут страдать ожирением [1]. Другой распространенной патологией у лиц старшего возраста признана саркопения – снижение мышечной силы и массы, а также физического функционирования [2, 3]. Сочетание ожирения и саркопении, или саркопеническое ожирение (СО), является независимым фактором риска хрупкости, коморбидности и смерти [4]. Негативное воздействие ожирения на мышечную ткань связано с метаболическими нарушениями. К основным механизмам такового относят окислительный стресс, воспаление и инсулинорезистентность [5]. Дополнительными факторами могут служить снижение физической активности, наличие сопутствующих заболеваний, усиливающих катаболизм в мышцах, несбалансированная диета и циклическое изменение массы тела [5, 6]. К 2051 г. вследствие глобального старения населения мира распространенность СО может достичь 100–200 млн [7], поэтому раннее выявление и коррекция этого патологического состояния представляет особую значимость для современной медицины.
Трудности в выявлении саркопении и СО обусловлены большим разнообразием диагностических критериев, а также необходимостью использования высокотехнологичных, дорогостоящих и зачастую малодоступных в широкой клинической практике методик, таких как компьютерная томография, двухэнергетическая рентгеновская абсорбциометрия, биоимпедансометрия [8].
В 2022 г. экспертами Европейской ассоциации клинического питания и метаболизма (изначально Европейское общество парентерального и энтерального питания (European Society of Parenteral and Enteral Nutrition, ESPEN)) и Европейской ассоциации по изучению ожирения (European Association for the Study of Obesity, EASO) были предложены единое определение и критерии СО [9]. Согласно консенсусу ESPEN/EASO, скринингу на СО подлежат лица с повышенными значениями индекса массы тела (ИМТ) и/или окружности талии (ОТ), имеющие признаки саркопении. Следующим диагностическим шагом является подтверждение наличия избытка жировой и дефицита мышечной массы (ММ) в сочетании со снижением мышечной силы, а также стадирование в зависимости от наличия/отсутствия осложнений (рис. 1). Эксперты ESPEN/EASO рекомендуют внедрение данного алгоритма в клиническую практику и проспективные научные исследования, а также проведение вторичного анализа имеющихся баз данных для изучения его прогностической ценности и клинической эффективности.
В последние годы ведется активный поиск суррогатных маркеров для оценки ММ [10]. Так, в 2017 г. K.B. Kashani и соавт. предложили использовать индекс саркопении (ИС), представляющий собой отношение сывороточного уровня креатинина к сывороточному уровню цистатина С [11]. Было показано, что ИС коррелирует с площадью поперечного сечения мышц на уровне поясничных позвонков L2–L4 по данным компьютерной томографии (КТ), массой скелетной мускулатуры (МСМ), определенной с помощью биоимпедансного анализа [12], скоростью ходьбы и силой сжатия кисти (ССК) по данным кистевой динамометрии [13].
Индекс саркопении оказался полезным инструментом не только для диагностики, но и для прогнозирования развития саркопении и неблагоприятных событий в популяциях высокого риска – у пациентов отделений реанимации и интенсивной терапии [11], лиц пожилого возраста [10, 13], онкологических больных [12, 14]. Однако в современной научной литературе представлено недостаточно данных о возможности его использования для диагностики саркопении у пациентов с ожирением и сердечно-сосудистыми заболеваниями.
Совокупность вышесказанного определила цель исследования. Целью настоящего исследования стала оценка распространенности и фенотипических особенностей СО, а также возможности использования ИС в диагностике СО у женщин пожилого возраста с артериальной гипертензией (АГ) и висцеральным ожирением.
Материал и методы
Проведено одноцентровое открытое обсервационное одномоментное неконтролируемое исследование.
В исследование включены 95 женщин с АГ и ожирением.
Критерии включения в исследование:
- возраст от 60 до 74 лет;
- компенсированная АГ;
- ИМТ ≥ 30 кг/м2;
- ОТ > 88 см.
Критерии исключения:
- фракция выброса левого желудочка < 50%;
- онкологические и острые воспалительные заболевания;
- тяжелая почечная и печеночная недостаточность;
- невозможность дать информированное согласие на участие в исследовании.
Все пациентки получали стандартную терапию АГ, ожирения и сопутствующих заболеваний.
Участницам исследования проводились антропометрия с оценкой ОТ, окружности бедер (ОБ), расчетом соотношения ОТ/ОБ, тест с шестиминутной ходьбой (ТШХ), оценка ССК с помощью кистевого динамометра ДК-100 и состава тела с помощью биоимпедансного анализатора InBody 770, общеклинические лабораторные исследования с дополнительной оценкой уровня цистатина С. Для определения функции почек рассчитывали скорость клубочковой фильтрации по креатинину (СКФкр) по формуле CKD-EPI-креатинин (2021 г.) и по цистатину С (СКФцистС) по формуле CKD-EPI-цистатин С (2012 г.), исследовали уровень суточной микроальбуминурии (МАУ).
Наличие недостаточности питания устанавливали по краткой шкале оценки питания (Mini Nutritional Assessment, MNA).
Для диагностики СО применяли критерии ESPEN/EASO 2022 г. Выбраны отрезные точки: для низкой мышечной силы – снижение ССК < 20 кг, для дефицита ММ и избытка жировой массы (ЖМ) – снижение относительной ММ (отношение массы скелетной мускулатуры к массе тела) ≤ 27,6% и повышение доли ЖМ > 43% по данным биоимпедансного анализа [9].
Индекс саркопении рассчитывался как отношение уровня креатинина (мг/дл) к уровню цистатина С (мг/л) в сыворотке крови, умноженное на 100%.
Статистическая обработка данных проводилась с помощью пакетов программ Statistiсa 10.0 и SPSS Statistics 23.0. В связи с ненормальным распределением показателей количественные данные представлены в виде медианы, 25-го и 75-го процентилей (Ме [Q1; Q3]). Качественные признаки приведены в виде абсолютных значений и процентных долей. При сравнении независимых групп применяли критерий Манна – Уитни с поправкой Бонферрони и р < 0,017. Корреляции определяли по методу Спирмена с p < 0,05. Для оценки возможности использования ИС в диагностике СО были определены его чувствительность и специфичность, построена ROC-кривая.
Результаты
Согласно результатам анализа состава тела, у всех участниц отмечалось повышение площади висцерального жира (ВЖ) (239,9 [213,0; 262,1] см2) и доли ЖМ (50,9 [47,5; 52,6]%), у 68,4% – снижение относительной ММ (26,7 [25,6; 28,3]%). При проведении кистевой динамометрии практически у 17,0% пациенток обнаружена низкая мышечная сила (23 [20; 27] кг).
С учетом полученных данных и диагностических критериев СО все участницы исследования были разделены на три группы (табл. 1).
Все пациентки отрицали факт курения на момент проведения исследования и в анамнезе.
В трех группах частота встречаемости сопутствующих заболеваний была сопоставимой, однако в третьей группе (пациентки с СО) наблюдалась тенденция к увеличению количества случаев ишемической болезни сердца (ИБС), фибрилляции предсердий (ФП) и сахарного диабета (СД) 2 типа (рис. 2).
С помощью MNA установлено, что у пациенток отсутствовала недостаточность питания, однако у 2,1% имел место риск таковой.
Участницы исследования были сопоставимы по возрасту, систолическому артериальному давлению (САД) и диастолическому артериальному давлению (ДАД), частоте сердечных сокращений (ЧСС) (p > 0,05) (табл. 2). Однако в отношении антропометрических показателей, связанных с висцеральным ожирением, функциональных параметров и маркеров повреждения почек между ними отмечались статистически значимые различия (см. табл. 2).
Как видно из табл. 2, у женщин с изолированным снижением ММ (вторая группа) и женщин с СО (третья группа) ожирение было более выраженным, чем у женщин с нормальной мышечной массой и силой (первая группа). Кроме того, при проведении ТШХ участницы исследования из второй и третьей групп проходили меньшее расстояние по сравнению с участницами исследования из первой группы, что отражает относительно худшее функциональное состояние, характерное для потери мышечной ткани.
При оценке состава тела у пациенток второй и третьей групп выявлены большая площадь ВЖ и доля ЖМ, меньшие относительная ММ, фазовый угол и фитнес-балл по сравнению с пациентками первой группы (рис. 3). В третьей группе отмечалось выраженное висцеральное ожирение, что согласовалось с антропометрическими данными.
Как видно из табл. 2, значимые различия в отношении функции почек регистрировались лишь при оценке дополнительного параметра – уровня цистатина С.
У пациенток с СО наблюдались значимо больший уровень цистатина С и меньшее значение СКФцистС. Уровень креатинина, СКФкр и МАУ у участниц исследования были сопоставимы (p > 0,05), однако отмечалась некоторая тенденция к снижению уровня сывороточного креатинина и повышению МАУ у пациенток с СО.
Медиана ИС в общей популяции составила 85,72 [72,06; 99,40]%. В третьей группе значения ИС оказались значимо ниже, чем в первой и второй группах (p = 0,009 и p = 0,002 соответственно) (рис. 4).
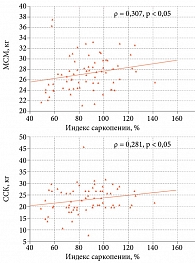
При корреляционном анализе ИС был ассоциирован с МСМ (ρ = 0,307, p < 0,05), но не с относительной ММ (ρ = 0,098, p > 0,05). Кроме того, ИС коррелировал с ССК (ρ = 0,281, p < 0,05) (рис. 5).
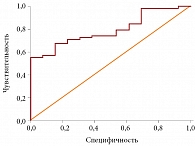
Для определения порогового значения ИС, предсказывающего наличие СО, была построена ROC-кривая. Значение ИС, равное 80%, позволяло диагностировать СО с чувствительностью 67,2% и специфичностью 84,6%. Площадь под кривой (AUC) составила 0,792 при 95%-ном доверительном интервале (ДИ) 0,681–0,903 (p = 0,001) (рис. 6).
Обсуждение
Согласно результатам нашего исследования, распространенность СО, оцениваемого по критериям ESPEN/EASO, среди женщин пожилого возраста с АГ и висцеральным ожирением составила 16,8%.
Необходимо отметить, что на настоящий момент времени проведено небольшое количество исследований распространенности СО у лиц пожилого возраста, опирающихся на новые рекомендации. В недавнем метаанализе 106 исследований лишь в четырех из них мышечная масса оценивалась по отношению к массе тела, как это предложено ESPEN/EASO, а не по отношению к росту, возведенному в квадрат, как это принято в большинстве диагностических алгоритмов саркопении [15]. В этих четырех работах распространенность СО составила 23%, а при индексации тощей массы к росту, возведенному в квадрат, – лишь 8%. Авторы предположили, что нормализация мышечной массы к массе тела у пациентов с ожирением может приводить к гипердиагностике СО. В исследовании D. Scott и соавт., включавшем 1416 мужчин в возрасте ≥ 70 лет, частота встречаемости СО, диагностируемого по критериям ESPEN/EASO, достигала 9,6% против 0,3% при использовании критериев Европейской рабочей группы по саркопении у пожилых людей второго созыва (European Working Group on Sarcopenia in Older People 2, EWGSOP2) [16]. Саркопеническое ожирение, диагностированное по новым критериям, ассоциировалось с инвалидностью и большей частотой падений. В исследовании A.L. Danielewicz и соавт., включавшем 90 пациентов пожилого возраста с ИМТ ≥ 35 кг/м2, распространенность СО, оцениваемого по критериям ESPEN/EASO, варьировалась от 23,3 до 40,0% в зависимости от используемых методик определения дефицита мышечной массы и снижения мышечной силы [17]. В связи со сказанным представляются важными проведение дальнейших исследований с учетом критериев ESPEN/EASO, их использование при анализе существующих баз данных для уточнения распространенности СО и его ассоциации с неблагоприятными исходами, а также оценка преимуществ и недостатков новых алгоритмов по сравнению с другими алгоритмами диагностики саркопении.
В ходе нашего исследования установлено, что у пожилых женщин с СО и АГ имело место выраженное висцеральное ожирение как на основании антропометрических данных, так и на основании результатов анализа состава тела. Кроме того, у них отмечалась низкая толерантность к физическим нагрузкам.
Результаты нашего наблюдения согласуются с данными литературы. Известно, что ожирение сопровождается приростом абсолютной мышечной массы, что может объясняться хронической гиперинсулинемией, стимулирующей синтез белка и гипертрофию мышц, а также повышенной нагрузкой на опорно-двигательную систему. Однако при прогрессировании ожирения увеличение мышечной массы оказывается недостаточным и оно не сопровождается увеличением мышечной силы [18]. По этой причине для диагностики СО рекомендуется оценивать не абсолютную, а относительную мышечную массу, то есть нормализованную к массе тела [9].
В настоящем исследовании у пациенток с СО также фиксировались меньшие фазовый угол тела и фитнес-балл по данным биоимпедансного анализа, чем у пациенток с нормальной мышечной массой и силой. Известно, что низкий фазовый угол тела ассоциирован с хрупкостью, гиподинамией и саркопенией [19]. Фитнес-балл – интегральный показатель, отражающий соотношение основных компонентов состава тела, таких как мышцы, жир и вода. Меньшие его значения могут быть обусловлены низкой физической активностью, недостатком ММ и избытком ЖМ [20].
Полученные нами показатели отражают неблагоприятные изменения состава тела и функциональных характеристик при СО.
Другими важными характеристиками данного фенотипа ожирения в нашем исследовании были сравнительно высокие уровни цистатина С и низкие значения СКФцистС, а также тенденция к повышению МАУ. Согласно данным литературы, для своевременной диагностики поражения почек при саркопении и кахексии в расчетах целесообразно использовать цистатин С, который в отличие от креатинина не вызывает ложного завышения СКФ при дефиците ММ [21]. Однако известно, что у пациентов с ожирением отмечаются меньшие значения СКФцистС по сравнению с общей популяцией, что может объясняться как начальными стадиями поражения клубочкового аппарата почек, так и избыточной продукцией цистатина С в жировой ткани [22]. В недавнем исследовании D.C. Chen и соавт. было показано, что снижение СКФцистС независимо от значений ИМТ и ОТ ассоциировалось со смертью от всех причин, почечной недостаточностью, сердечно-сосудистыми заболеваниями атеросклеротического генеза и сердечной недостаточностью [23]. Таким образом, выявленные нами изменения у женщин с СО могут указывать на поражение почек, а также на больший риск развития сердечно-сосудистых и почечных осложнений.
Как было отмечено ранее, в 2017 г. K.B. Kashani и соавт. предложили новый показатель, отражающий состояние мышечной массы, – индекс саркопении, который представляет собой отношение уровня креатинина к уровню цистатина С в сыворотке крови [11]. Согласно данным авторов, ИС коррелировал с площадью поперечного сечения параспинальных мышц на уровне поясничного позвонка L4, измеренной КТ-методом, а также служил предиктором госпитальной и 90-дневной смертности. В последующих исследованиях были подтверждены корреляция ИС с ММ и его значимость в прогнозировании риска развития неблагоприятных событий. Так, согласно данным R. Shodo и соавт., у пациентов с плоскоклеточным раком головы и шеи ИС коррелировал как с площадью поперечного сечения мышц по данным КТ, так и с МСМ по результатам биоимпедансного анализа, а меньшие значения ИС ассоциировались с худшей выживаемостью [12]. В исследовании C. Ren и соавт. установлено, что низкие значения ИС ассоциировались со смертью от всех причин (отношение рисков (ОР) 0,61 (95% ДИ 0,47–0,79)), недостаточностью питания (отношение шансов (ОШ) 0,38 (95% ДИ 0,29–0,49)) и саркопенией (ОР 0,58 (95% ДИ 0,45–0,74)) [10]. Тем не менее данный диагностический метод не обладает достаточной чувствительностью и специфичностью в качестве полноценного биомаркера мышечной массы и, скорее всего, может рассматриваться для стратификации риска неблагоприятных исходов [24].
В нашем исследовании у пожилых женщин с АГ и висцеральным ожирением значения ИС коррелировали с абсолютной мышечной массой по данным биоимпедансного анализа, а также с ССК, что соответствует данным литературы [10, 12]. Кроме того, ИС позволял предсказывать наличие СО, диагностированного по критериям ESPEN/EASO, с чувствительностью 67,2% и специфичностью 84,6% (AUC 0,792; p = 0,001). Полагаем, что ИС может использоваться как простой и неинвазивный метод скрининга на СО в данной популяции больных.
В доступной литературе мы не нашли исследований ИС как маркера СО, диагностированного по новым алгоритмам, у пациентов с сердечно-сосудистой патологией.
В недавнем исследовании M. Khalil и соавт., в котором диагноз СО устанавливали при сочетании ожирения с критериями саркопении EWGSOP2, не было обнаружено значимой ассоциации между ИС и наличием СО (ОШ 0,09 (95% ДИ 0,001–8,860)). При этом, согласно данным ROC-анализа, прогностическая значимость ИС в диагностике саркопении в общей популяции была достаточно высокой (AUC 0,721; p = 0,0001), особенно у пациентов без хронической болезни почек (ХБП) (AUC 0,84; p < 0,00001) [25].
Необходимо дальнейшее проведение исследований диагностической ценности маркеров СО с применением в качестве критерия включения пациентов алгоритма, предложенного ESPEN/EASO.
В настоящее время активно изучается прогностическая роль ИС при различных сердечно-сосудистых заболеваниях. В исследовании, включавшем 1086 пациентов старше 65 лет после чрескожного коронарного вмешательства, низкий ИС ассоциировался с большей частотой смертей от всех причин, инфаркта миокарда и рестеноза стента (ОР 2,23 (95% ДИ 1,62–3,07); p < 0,001) [26]. У пожилых пациентов с АГ высокие значения ИС ассоциировались с меньшей частотой инсультов (ОР 0,46 (95% ДИ 0,35–0,59); p < 0,001) [27]. У пациентов с сердечной недостаточностью низкие значения ИС были связаны с более тяжелым клиническим состоянием, выраженным воспалением и изменениями микробиоты полости рта [28]. В исследовании NHANES с участием 9894 человек (средний возраст – 45,64 года, 50,3% – мужчины), и средним периодом наблюдения 15,62 ± 4,68 года показано, что высокий ИС ассоциировался с меньшим риском сердечно-сосудистой (ОР 0,41 (95% ДИ 0,31–0,53); p < 0,001) и общей смертности (ОР 0,41 (95% ДИ 0,35–0,49); p < 0,001) [29]. Таким образом, ИС является важным предиктором неблагоприятных событий и может быть использован для стратификации риска у пациентов с сердечно-сосудистой патологией.
Ограничениями нашего исследования стали дизайн, небольшой размер выборки и отсутствие участников мужского пола. Кроме того, состав тела оценивался с помощью биоимпедансного анализа, который может недооценивать жировую и переоценивать безжировую массу тела у лиц с ИМТ > 34 кг/м2 [9]. В качестве метода оценки мышечной силы мы использовали только кистевую динамометрию, так как у большинства пациенток была недоступна оценка силы мышц нижних конечностей при помощи пятикратного теста «Сесть – встать» в связи с дегенеративным поражением суставов.
Для уточнения клинической значимости ИС в выявлении СО, а также в прогнозировании неблагоприятных исходов требуется проведение дополнительных исследований.
Заключение
Саркопеническое ожирение встречалось у 16,8% обследованных пожилых женщин с АГ и висцеральным ожирением, а низкая ММ без снижения мышечной силы – у 51,6%. Для этих пациенток были характерны более высокие значения ИМТ, ОТ, площади ВЖ, доли ЖМ и снижение функциональных возможностей по результатам ТШХ по сравнению с пациентками без признаков саркопении. Кроме того, наличие саркопенического ожирения сопровождалось более высокими уровнями цистатина С, более низкими значениями СКФцистС и ИС.
Низкие значения ИС коррелировали со снижением мышечной массы и силы. Пороговое значение ИС, равное 80,0%, позволяло диагностировать саркопеническое ожирение с чувствительностью 67,2% и специфичностью 84,6% (AUC 0,792 (95% ДИ 0,681–0,903); p = 0,001).
Полученные нами результаты позволяют сделать вывод, что ИС можно рассматривать в качестве неинвазивного и доступного метода для скрининга СО у женщин пожилого возраста с АГ и висцеральным ожирением.
Финансирование. Научно-исследовательская работа подготовлена за счет средств субсидий на выполнение государственного задания по теме № FGMF-2022-0005.
Конфликт интересов. Авторы заявляют об отсутствии потенциального конфликта интересов.
A.A. Mikaelyan, Yu.R. Varaeva, Yu.V. Liskova, MD, PhD, O.A. Kislyak, MD, PhD, Prof., S.D. Kosyura, PhD, I.V. Zolkina, PhD, A.V. Starodubova, MD, PhD
N.I. Pirogov Russian National Research Medical University
Federal Research Centre of Nutrition, Biotechnology and Food Safety
Contact person: Angela A. Mikaelyan, poppysinclair8@gmail.com
Sarcopenic obesity – a combination of decreased muscle mass, muscle strength and obesity – is an urgent problem of modern medical science and a difficult condition to diagnose. One of the available methods for detecting sarcopenic obesity can be the sarcopenia index (SI).
The aim of the study was to evaluate the prevalence and clinical features of the sarcopenic obesity phenotype, as well as the possibility of using SI in the diagnosis of sarcopenic obesity in elderly women with arterial hypertension (AH) and visceral obesity.
Material and methods. 95 women aged 60 to 74 years with AH stages 1–3, body mass index ≥ 30 kg/m2 and waist circumference > 88 cm were examined. The participants underwent anthropometry, a 6-minute walking test, hand dynamometry, and bioimpedance analysis. SI was calculated as the ratio of serum creatinine (mg/dl) to serum cystatin C (mg/L) × 100%.
Results. The prevalence of sarcopenic obesity was 16.8%. Participants with sarcopenic obesity had more pronounced visceral obesity, elevated levels of cystatin C and lower cystatin C-based estimates of glomerular filtration rate, worse results in 6-minute walking test and lower SI. SI correlated with muscle mass and muscle strength. The threshold value of SI for the diagnosis of sarcopenic obesity was 80.0% with a sensitivity of 67.2% and a specificity of 84.6%.
Conclusion. The sarcopenic obesity phenotype was characterized by pronounced visceral obesity, unfavorable functional characteristics, worse kidney function and low SI. In our opinion, SI can be used as a screening for the detection of sarcopenic obesity in elderly women with AH and visceral obesity.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.