Ассоциации между жировой болезнью печени и инфицированием Helicobacter pylori
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведен поиск с использованием ключевых слов в текстовых базах данных Scopus, Web of Science, PubMed по литературным источникам последних 10 лет о взаимосвязи между H. pylori и НАЖБП.
Результаты. В обзоре представлены результаты исследований, подтверждающих и отрицающих взаимосвязь между хеликобактерной инфекцией и НАЖБП, с акцентом на метаанализы и клинические рандомизированные контролируемые исследования. Обсуждены возможные патогенетические механизмы, посредством которых H. pylori-инфекция может способствовать усугублению течения НАЖБП: воздействие воспалительных цитокинов и адипоцитокинов, усугубление инсулинорезистентности, измененный метаболизм липидов, нарушенный кишечный барьер и измененная микробиота, везикуляция наружной мембраны, а также инфицированные H. pylori клеточно-внеклеточные везикулы.
Заключение. Результаты экспериментальных, клинических исследований по установлению взаимосвязи между H. pylori и НАЖБП неоднозначны. Изучение этих ассоциаций, возможных патогенетических механизмов влияния бактерии на НАЖБП важно для понимания того, насколько эрадикационная терапия H. pylori-инфекции может задержать прогрессирование или улучшить метаболический статус H. pylori-позитивных пациентов с НАЖБП и оптимизировать терапию данного заболевания. Необходимы дальнейшие крупномасштабные исследования в данном направлении.
Материал и методы. Проведен поиск с использованием ключевых слов в текстовых базах данных Scopus, Web of Science, PubMed по литературным источникам последних 10 лет о взаимосвязи между H. pylori и НАЖБП.
Результаты. В обзоре представлены результаты исследований, подтверждающих и отрицающих взаимосвязь между хеликобактерной инфекцией и НАЖБП, с акцентом на метаанализы и клинические рандомизированные контролируемые исследования. Обсуждены возможные патогенетические механизмы, посредством которых H. pylori-инфекция может способствовать усугублению течения НАЖБП: воздействие воспалительных цитокинов и адипоцитокинов, усугубление инсулинорезистентности, измененный метаболизм липидов, нарушенный кишечный барьер и измененная микробиота, везикуляция наружной мембраны, а также инфицированные H. pylori клеточно-внеклеточные везикулы.
Заключение. Результаты экспериментальных, клинических исследований по установлению взаимосвязи между H. pylori и НАЖБП неоднозначны. Изучение этих ассоциаций, возможных патогенетических механизмов влияния бактерии на НАЖБП важно для понимания того, насколько эрадикационная терапия H. pylori-инфекции может задержать прогрессирование или улучшить метаболический статус H. pylori-позитивных пациентов с НАЖБП и оптимизировать терапию данного заболевания. Необходимы дальнейшие крупномасштабные исследования в данном направлении.
Введение
Helicobacter pylori (H. pylori) – грамотрицательная бактерия, инфицирующая слизистую оболочку желудка человека и заражающая около 4,4 млрд человек во всем мире с коэффициентом распространенности 44,3% (95%-ный доверительный интервал (95% ДИ) 40,9–47,7) [1–3]. Результаты многочисленных исследований подтвердили, что именно H. pylori инициирует воспаление и прогрессирование хронического гастрита в рак желудка [4–6].
Связь инфекции H. pylori с различными патологическими состояниями желудка хорошо изучена, но влияние бактерии на организм в целом до сих пор вызывает сомнения. Общеизвестно, что некоторые локальные патогены могут оказывать системное патологическое воздействие [7]. Есть исследования о взаимосвязи инфекции H. pylori с различными экстрагастральными заболеваниями: железодефицитной анемией, первичной иммунной тромбоцитопенией, дефицитом витамина В12, инсультом, болезнью Альцгеймера и неалкогольной жировой болезнью печени (НАЖБП) [8]. Причем активно обсуждается не только роль H. pylori в возникновении внежелудочной патологии, но и способность бактерии изменять фенотип заболевания. Согласно последним консенсусным документам в отношении лечения H. pylori-инфекции, H. pylori следует выявлять и в случае ее обнаружения эрадицировать только у пациентов с идиопатической тромбоцитопенической пурпурой, железодефицитной анемией и дефицитом витамина B12 [7].
НАЖБП, как и H. pylori-инфекция, имеет высокую распространенность, которая во всем мире оценивается приблизительно в 29,1% (95% ДИ 26,8–31,5) [9, 10].
Однако вопросы, связанные с патогенезом НАЖБП, до сих пор активно изучаются с основными акцентами на инсулинорезистентность (ИР), воздействие секретируемых жировой тканью гормонов, факторов питания и кишечной микробиоты [11].
После сообщения M. Cindoruk и соавт. об обнаружении ДНК H. pylori в печени пациента со стеатогепатитом [12] потенциальная связь между инфекцией H. pylori и НАЖБП стала активно изучаться [13–15]. С учетом высокого уровня как хеликобактерной инфекции, так и НАЖБП в мире, значительная часть пациентов имеет оба заболевания одновременно. В ряде многоцентровых клинических исследований выявлены различные ассоциации между инфицированием H. pylori и НАЖБП [13, 16, 17], однако в других исследованиях связи между этими патологиями не было обнаружено [18–20]. Таким образом, вопросы по вероятным патогенетическим механизмам этой взаимосвязи остаются актуальными и в настоящее время.
Цель исследования – проанализировать ассоциации между H. pylori и НАЖБП, возможные патогенетические механизмы воздействия хеликобактерной инфекции на развитие и прогрессирование НАЖБП.
Экспериментальные данные
Экспериментальные модели на животных дают нам немного информации. В одном исследовании [14] была сконструирована мышиная модель инфекции H. pylori с диетическими различиями: рацион с высоким содержанием жиров (кетогенная диета) и контрольная диета в течение шести месяцев. Наблюдение показало, что у мышей, инфицированных H. pylori и получавших кетогенную диету, была значительно увеличена окружность живота, выше уровень глюкозы в крови натощак, холестерина липопротеидов низкой плотности (ХС ЛПНП) и активность аланинаминотрансферазы; также наблюдалась большая степень стеатоза печени по сравнению с животными группы с кетогенной диетой без H. pylori. Было также продемонстрировано влияние инфекции H. pylori на способность тетрахлорметана индуцировать фиброз печени на животных моделях [21] с определением в качестве провоспалительных сигнальных путей трансформирующего ростового фактора бета-1 (TGF-beta1) [22].
Положительная корреляция между инфекцией H. pylori и НАЖБП
Клинические исследования, по результатам ряда метаанализов, показали положительную корреляцию между инфекцией H. pylori и НАЖБП. Так, результаты девяти метаанализов с включением от 38 622 до 218 573 участников в каждом исследовании, выполненных K. Wijarnpreecha и соавт. (2018), R. Liu. и соавт. (2019), A. Mantovani и соавт. (2019), L. Ning и соавт. (2019), B.G. Zhou и соавт. (2019), L.Wei et Ding (2021), K. Heydari и соавт. (2022), Z. Ma и соавт. (2022), G. Xu и соавт. (2023), продемонстрировали повышенный риск развития или прогрессирования НАЖБП у лиц, инфицированных H. pylor [23–31]. Необходимо отметить, что данные ассоциации особенно характерны для азиатских популяций, что, в свою очередь, связано с различиями в статусе цитотоксин-ассоциированного гена А (CagA) и, соответственно, вирулентности штаммов H. pylori между Азией и другими регионами [32, 33]. Доля инфекции H. pylori у пациентов с НАЖБП была в 1,14–1,53 раза выше, чем у пациентов без НАЖБП. Было сделано предположение, что данная инфекция в сочетании с питанием полуфабрикатами, продуктами быстрого приготовления, неправильным образом жизни может усугубить фенотипические проявления НАЖБП. Еще одно крупное исследование с включением 16 942 участников также показало значимую связь между инфекцией H. pylori и метаболическим индексом у людей [34], что согласуется с данными G.M. Buzás и соавт. [35].
Следует отметить, что большинство включенных в обзор исследований были перекрестными и не могли проиллюстрировать причинно-следственную связь между H. pylori и НАЖБП, более того, достаточно сложно скорректировать влияние таких искажающих факторов, как уровень гигиены, пищевые привычки, физическая активность и генетика, на основе клинических данных, собранных с помощью метаанализов.
Отрицательная корреляция между H. pylori и НАЖБП
В ряде исследований отрицается корреляция между H. pylori и НАЖБП. Так, результаты 13 клинических исследований, включая одно исследование двунаправленной менделевской рандомизации [36], два клинических испытания [18, 37], десять перекрестных исследований [19, 20, 38–45], не подтвердили причинно-следственной связи между H. pylori и НАЖБП.
Y. Liu и соавт. [36] не выявили причинно-следственной связи между инфекцией H. pylori и НАЖБП (отношение шансов (ОШ) 1,05 (95% ДИ 0,78–1,41). H. pylori-инфекция не была значимо связана с уровнем триглицеридов (ТГ), ХС ЛПНП, холестерина липопротеидов высокой плотности (ХС ЛПВП) и уровнем глюкозы в плазме крови натощак. Низкий показатель 95% ДИ для ОШ в некоторых исследованиях [19, 20, 43, 44] был близок к единице, следовательно, такие статистические результаты имеют сомнительную надежность на практике.
Другими исследователями [39] значимость связи H. pylori и НАЖБП была показана после внесения поправки на возраст и пол (ОШ 1,1; 95% ДИ 1,0–1,1; р = 0,004). Тем не менее после поправки на индекс массы тела (ИМТ), а также систолическое и диастолическое артериальное давление значимой связи выявлено не было (ОШ 0,9; 95% ДИ 0,9–1,0; р = 0,097). Результаты корректировки метаболического индекса показали отсутствие связи между H. pylori-инфекцией и НАЖБП и вызвали предположение, что инфекция H. pylori может приводить к метаболическим нарушениям, а не вызывать НАЖБП напрямую.
Эрадикация H. pylori у позитивных пациентов с НАЖБП
Клинические рандомизированные контролируемые исследования по эрадикации H. pylori у позитивных пациентов с НАЖБП [15, 18, 37, 46, 47] указывают, что элиминация инфекции способствует улучшению метаболических показателей. Y.Y. Yu и соавт. [15] включили в исследование 191 H. pylori-позитивного пациента с НАЖБП и случайным образом разделили их на группы – без эрадикации (рекомендации по здоровому образу жизни) и с эрадикационной терапией H. pylori (здоровый образ жизни плюс 14-дневная четырехкомпонентная терапия). Через год в группе успешно пролеченных улучшились такие показатели, как метаболический индекс и контролируемый параметр затухания (CAP-функция) FibroScan.
Показатели, используемые для оценки инсулинорезистентности (метаболический индекс, HOMA-индекс, ТГ, ИМТ), значение CAP-функции и воспалительные маркеры (уровень лейкоцитов, высокочувствительный С-реактивный белок, интерлейкин 6 (ИЛ-6), фактор некроза опухоли альфа (ФНО-α)) в группе с проведенной эрадикационной терапией оказались значимо ниже по сравнению с группой без лечения. R. Jamali и соавт. в исследовании пациентов с НАЖБП не выявили различий в показателях в зависимости от наличия или отсутствия эрадикационной терапии [18].
Не показано и долгосрочного влияния эрадикации инфекции на стеатоз печени, оцениваемый с помощью магнитно-резонансной томографии [37]. Тем не менее была выявлена тенденция к улучшению показателей фиброза при НАЖБП после эрадикации H. pylori. Проведенное в 2020 г. ретроспективное исследование показало, что активная инфекция H. pylori была в значительной степени связана с функцией печени, результатами гомеостатической модели оценки ИР и стадией фиброза печени [17].
Проспективное наблюдение 369 пациентов с НАЖБП (171 H. pylori-положительный и 198 H. pylori-отрицательных) в течение 24 месяцев показало снижение ИР, улучшение липидного профиля, индекса стеатоза печени (HSI) и показателя содержания жира в печени при НАЖБП на фоне эрадикации H. pylori [46], а также повышение уровня ХС ЛПВП и улучшение других метаболических параметров [47].
Возможный механизм прогрессирования НАЖБП при инфицировании H. рylori
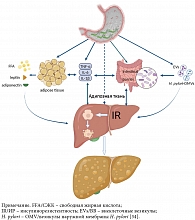
Нет прямых экспериментальных доказательств того, что инфекция H. pylori оказывает непосредственное влияние на НАЖБП [48–50]. Предполагают воздействие внеклеточных везикул или везикул наружной мембраны H. pylori (рисунок). У пациентов с персистирующей инфекцией H. pylori может возникнуть хроническое воспаление низкой степени активности и повышенный уровень воспалительного NOD-подобного рецепторного белка 3 (NLRP3) [51] и воспалительных цитокинов (ИЛ-1β, ил-6 и фно-α) [35]. Инфламмасомы (многобелковые олигомерные комплексы, способствующие секреции провоспалительных цитокинов и активирующие воспалительный ответ) и воспалительные цитокины, секретируемые инфицированными H. pylori эпителиальными клетками желудка, слизистыми и циркулирующими моноцитами [52], попадают в печень через систему кровообращения. В частности, ИЛ-1β принимает непосредственное участие в ИЛ-1β/ФНО-индуцированном некрозе гепатоцитов [53]. ФНО-α напрямую увеличивает экспрессию протеиназы 1 тучных клеток, трансформирующего фактора роста бета-1 и тканевого ингибитора металлопротеиназы-1 в гепатоцитах, участвуя таким образом в метаболизме липидов в печени, воспалении и процессах фиброгенеза [54]. Исследования показали, что ИЛ-6 участвует в прогрессировании неалкогольного стеатогепатита через IL-6/сигнальный передатчик и активатор транскрипции 3 (STAT3) [55, 56].
Таким образом, системное воспаление низкой активности, вызванное инфекцией H. pylori, может усугублять течение НАЖБП. Более того, различные воспалительные цитокины прямо или опосредованно действуют на жировую ткань, печень и кишечник, вызывая ИР или усугубляя ее, а также разрушают кишечный барьер, приводя к стеатозу гепатоцитов или активируя развитие фиброза печени. Другим возможным механизмом является воздействие внеклеточных везикул, выделяемых клетками хозяина, инфицированными H. pylori, или везикул наружной мембраны, секретируемых H. pylori, которые действуют непосредственно на печень и способствуют развитию НАЖБП.
Висцеральная белая жировая ткань при инфильтрации воспалительными клетками высвобождает адипоцитокины (включая адипонектин, лептин и резистин) и факторы воспаления (ФНО-α, ИЛ-6), которые участвуют в регуляции ИР и воспаления через эндокринную систему или паракринные механизмы [57, 58]. Связь инфекции H. pylori с адипоцитокинами сыворотки остается предметом дискуссии, поскольку клинические наблюдательные исследования показали противоречивые результаты. Так, L.W. Chen и соавт. не обнаружили значительной разницы в уровнях циркулирующего в кровотоке лептина и адипонектина в зависимости от H. pylori-статуса [59]. Другими исследователями было выявлено значительное снижение уровня лептина в сыворотке и отсутствие изменений в показателях адипонектина после эрадикационной терапии H. pylori [46], тогда как T. Ando и соавт. зафиксировали значительное повышение уровня адипонектина в сыворотке после успешного лечения этой инфекции [60]. Противоречивость вышеуказанных результатов требует проведения крупномасштабных проспективных исследований для определения конкретных связей между инфекцией H. pylori и адипоцитокинами.
Инсулинорезистентность
Инсулинорезистентность как ключевое звено патогенеза НАЖБП играет значительную роль в отложении ТГ в печени, воспалительной реакции и прогрессировании фиброза печени [61]. Многочисленные исследования показали, что инфицирование H. pylori является независимым фактором риска развития ИР [62]. Так, у H. pylori-инфицированных пациентов показатели уровня глюкозы, инсулина натощак, гликированного гемоглобина (HbA1c) и HOMA-IR значительно снизились после эрадикации H. pylori [63–65]. Исследования на животных показали, что у мышей, получавших диету с высоким содержанием жиров и инфицированных H. pylori, развивалась более тяжелая ИР, чем у мышей, получавших только такую диету [66]. Дальнейшие исследования показали, что инфекция H. pylori увеличивает экспрессию транскрипционного фактора c-Jun, связанного с воспалением, который в свою очередь может связываться с промоторной областью гена miR-203, ингибируя экспрессию miR-203 (ингибитора инсулинового регулятора отрицательной обратной связи SOCS3), и в конечном итоге стимулировать печеночную ИР через метаболический путь c-Jun/miR-203/SOCS3 [67].
Нарушение липидного обмена в гепатоцитах при НАЖБП
В результате некоторых исследований получены данные о влиянии инфекции H. pylori на липидный обмен [35, 68, 69] с улучшением липидных показателей после эрадикации H. pylori [70].
При НАЖБП наблюдается отложение ТГ в печени, в том числе из-за их повышенного синтеза (липогенез de novo) и избыточного поступления свободных жирных кислот в клетки печени [71, 72].
Нет прямых доказательств того, что инфекция H. pylori увеличивает липолиз жировой ткани, однако показано, что хроническое системное воспаление, вызванное хеликобактером, индуцирует липолиз белой жировой ткани [73, 74]. Тем не менее вопрос о непосредственном влиянии H. pylori на липогенез de novo в печени остается открытым и нуждается в дальнейших экспериментальных исследованиях.
Инфекция H. pylori оказывает влияние на кишечный барьер и микробиоту кишечника, воздействуя таким образом на метаболизм липидов, обусловленный рационом питания. Липопротеиды очень низкой плотности (ЛПОНП) являются транспортерами ТГ, синтезируемых печенью, к периферическим органам или в систему кровообращения [75]. Уровень переносимых током крови ЛПОНП значительно выше у пациентов, инфицированных H. pylori, чем у неинфицированных пациентов [76], что может быть косвенным результатом ИР, вызванной инфекцией H. pylori или стрессом эндоплазматического ретикулума в гепатоцитах.
Взаимодействие кишечного барьера и микробиоты с инфекцией H. рylori
При гипоксии, воспалительных реакциях и нарушениях микробиоты кишечника кишечные бактерии и их метаболиты проходят через поврежденный кишечный барьер, попадая в кровоток и участвуя в развитии НАЖБП [77]. В клинических исследованиях инфекция H. pylori была связана с изменениями в фекальной микробиоте и увеличением общего разнообразия фекальных микроорганизмов [78]. Экспериментальные исследования показали, что в кишечнике у мышей на фоне гиперкалорийной диеты и Н. pylori-инфекции увеличивалась численность Helicobacter и снижалась численность Lactobacillus с потерей разнообразия. В то же время инфекция H. pylori усугубляла гипергликемию, вызванную диетой с высоким содержанием жиров, которую не удалось вернуть к референтным значениям даже после эрадикации H. pylori [79].
Другое исследование на мышах, также с пищевым рационом с высоким содержанием жиров и инфицированных H. pylori, показало, что экспрессия компонентов плотных соединений, таких как окклюдин, зона плотных контактов-1 и клаудин-1, которые являются важными компонентами кишечного барьера, значительно снижается. Это свидетельствует о том, что инфекция H. pylori напрямую влияет на барьерную функцию кишечника [66]. Дальнейшие исследования показали, что CagA-содержащие экзосомы повышают проницаемость кишечника вследствие усиления экспрессии клаудина-2 посредством активации CDX2 (каудальносвязанная гомеодоменовая транскрипция 2) [80]. Таким образом, дисфункция кишечного барьера приводит к увеличению кишечной проницаемости для кишечных бактерий, их метаболитов (таких как диметиламин, триметиламин) и липополисахаридов, поступающих в печень и вызывающих воспалительную реакцию, повреждение гепатоцитов и фиброз печени [81]. Более того, эпителиальные клетки кишечника выделяют воспалительные цитокины, способствующие прогрессированию НАЖБП [82] и нарушающие всасывание нутриентов в кишечнике с нарастанием дефицита холина [83].
Заключение
НАЖБП и инфицирование H. pylori являются хроническими и часто встречающимися заболеваниями. Важно понимать, насколько эрадикационная терапия H. pylori может задержать прогрессирование или улучшить метаболический статус H. pylori-позитивных пациентов с НАЖБП, поскольку полученные на сегодняшний день результаты исследований неоднозначны. Анализ взаимосвязи между инфекцией H. pylori и НАЖБП поможет понять механизмы, посредством которых инфицирование H. pylori приводит к экстрагастральным заболеваниям, что будет способствовать оптимизации терапии НАЖБП, в том числе, возможно, и с помощью эрадикации H. pylori. Необходимы новые многоцентровые проспективные исследования для демонстрации того, имеет ли эрадикация H. pylori дополнительные преимущества для пациентов с НАЖБП; а экспериментальные исследования помогут в более глубоком понимании механизмов развития этой патологии и участия в этом различных воспалительных процессов, включая хеликобактерную инфекцию.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Информация о финансовой поддержке
Работа выполнена по Государственному заданию в рамках бюджетных тем FWNR-2022-0024, FWNR-2023-0003.
M.V. Kruchinina, PhD, Prof., M.F. Osipenko, PhD, Prof., A.V. Belkovets, PhD, P.A. Senshina
Research Institute of Internal and Preventive Medicine – Branch of the Institute of Cytology and Genetics, Siberian Branch of the Russian Academy of Sciences, Novosibirsk
Novosibirsk State Medical University
Contact person: Margarita V. Kruchinina, kruchmargo@yandex.ru
The aim of this review is to analyze the associations between Helicobacter pylori (H. pylori) and non-alcoholic fatty liver disease (NAFLD), possible pathogenic mechanisms of the effect of H. pylori infection on the development and progression of NAFLD.
Material and methods. Keywords were searched in the text databases Scopus, Web of Science, PubMed from literature sources of the last 10 years on the relationship between H. pylori and NAFLD.
Results. The review presents the results of studies confirming and rejecting the relationship between Helicobacter infection and NAFLD, with a focus on meta-analyses and clinical randomized controlled trials. Possible pathogenic mechanisms by which H. pylori infection can aggravate the course of NAFLD are discussed: the effect of inflammatory cytokines and adipocytokines, worsening of insulin resistance, altered lipid metabolism, impaired intestinal barrier and altered microbiota, outer membrane vesiculation, as well as H. pylori infected cell-extracellular vesicles.
Conclusion. The results of experimental, clinical studies to establish a relationship between H. pylori and non-alcoholic fatty liver disease are mixed. Studying these associations, possible pathogenetic mechanisms of the influence of the bacterium on NAFLD is important for understanding how eradication therapy of H. pylori infection can delay progression or improve the metabolic status of H. pylori-positive patients with NAFLD and optimize therapy of this disease. Further large-scale research in this direction is needed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.