Гардасил® – первая вакцина для профилактики рака шейки матки
- Аннотация
- Статья
- Ссылки
ПЧ – это наиболее частая сексуально–трансмиссивная инфекция (13). По эпидемиологическим оценкам, в мире инфицировано 9–13% населения или приблизительно 630 млн человек (35). Эти данные получены на основании обнаружения ВПЧ ДНК в цервикальных мазках, полученных из различных регионов мира. Риск инфицирования ВПЧ в течение жизни для сексуально активной женщины превышает 70% (4).
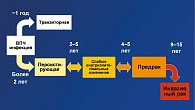
Большинство папилломовирусных инфекций являются доброкачественными и транзиторными, однако персистирующая инфекция онкогенными типами ВПЧ может привести к интраэпителиальным неоплазиям и раку аногенитальной области (рисунок 1). Наиболее частым клиническим проявлением инфекции онкогенными типами ВПЧ является рак шейки матки (3, 17).
Рак шейки матки – это вторая по частоте злокачественная опухоль в мире после рака молочной железы, поражающая женщин, с распространенностью 2,3 млн человек (8, 33).
За последнее десятилетие ежегодно в мире диагностируется около 500000 новых случаев цервикального рака, умирает от него более 250 000 женщин. Более 80% новых случаев регистрируется в развивающихся странах, где цервикальный рак является ведущей причиной смерти женщин от рака (8).
В развитых странах, несмотря на интенсивные скрининговые программы, рак шейки матки – второй по частоте в структуре онкологической заболеваемости и смертности у молодых женщин (8, 12).
В Российской Федерации, по данным Globocan 2002 database, в 2002 году зарегистрировано 12215 новых случаев заболевания, умерло 7784 женщин. Анализ показателей диагностики РШМ в России выявил рост запущенности (III-IV стадия) и одногодичной летальности при снижении активной выявляемости и выявляемости в I-II стадии опухолевого процесса. В 2001 году опухоли шейки матки в поздних стадиях выявлялись у 39,6% больных, а рак in situ диагностирован лишь у 12,8% пациенток с онкологической патологией данной локализации (1).
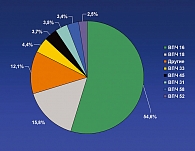
Онкогенные типы ВПЧ обнаруживаются практически во всех случаях (99,7%) цервикального рака (32), но они также ассоциированы с ~ 50% раков влагалища, вульвы и полового члена и с ~ 85% раков анальной локализации (34). Из 15–20 генитальных типов ВПЧ, классифицированных как онкогенные, наиболее часто с цервикальным раком ассоциированы ВПЧ 16-го и 18–го типов (4, 7, 11) (рисунок 2).
Клиническим проявлением папилломовирусной инфекции ВПЧ типами низкого риска являются генитальные кондиломы, более чем в 90% обусловленные ВПЧ 6–го или 11–го типов (11). Несмотря на доброкачественный характер, генитальные кондиломы вызывают значительный физический и психологический дискомфорт и обычно требуют неоднократных визитов к врачу для диагностики и лечения (6, 14).
Еще одно, к счастью, редкое заболевание, которое обычно вызывается 6-м или 11-м типами ВПЧ, – возвратный респираторный папилломатоз, встречается у детей, рожденных через инфицированные родовые пути. Этот папилломатоз может вызывать хроническое воспаление и повреждение голосовых связок, обструкцию дыхательных путей, требует неоднократных хирургических вмешательств и является причиной значительной детской заболеваемости и смертности (2).
Более 50 лет единственной реальной профилактикой рака шейки матки являлась вторичная его профилактика – цервикальный скрининг, направленный на своевременное выявление и лечение заболеваний, которые могут прогрессировать в цервикальный рак. В последней декаде прошлого века доказательство роли ВПЧ в этиологии цервикального рака привело к пониманию, что иммунизация для предупреждения инфекции наиболее распространенными типами ВПЧ может стать стратегией первичной профилактики цервикального рака и других ВПЧ–ассоциированных заболеваний.
Развитие вакцинных программ началось после того, как несколькими академическими группами было открыто, что L1 капсидный протеин папилломовируса может формировать вирусоподобные частицы (virus-like particle – VLP) при экспрессии в качестве рекомбинантного протеина в гетерологичной эукариотической системе. VLP морфологически идентичны ВПЧ вириону и стимулируют продукцию типо–специфичных антител как у животных, так и у человека (6, 21). Поскольку VLP не содержат вирусного генетического материала, риск онкогенной прогрессии и продуктивной инфекции при вакцинации отсутствует (11, 15).
В результате последующих многолетних экспериментальных и клинических исследований в июне 2006 года U.S. Food and Drug Administration была зарегистрирована первая в мире вакцина против ВПЧ – вакцина ГардасилÒ (Co Merck Sharp & Dohme Idea Inc.). В настоящее время, помимо США, вакцина доступна во многих странах мира: Канаде, Австралии, Новой Зеландии, Мексике, Бразилии, 25 странах Евросоюза и других. В ноябре 2006 г. вакцина Гардасил® зарегистрирована в России.
Гардасил® – это квадривалентная ВПЧ L1 VLP вакцина против ВПЧ 6, 11, 16 и 18–го типов. VLP для каждого ВПЧ типа получены путем экспрессии соответствующих L1 протеинов посредством рекомбинантного вектора Saccharomyces cerevisiae. Каждая доза вакцины содержит L1 VLP ВПЧ типов 6/11/16/18 в количестве 20/40/40/20 мг и 225 мг алюминиевого адъюванта – amorphous aluminum hydroxyphosphate sulfate (30). Рекомендуемый курс вакцинации состоит из трех доз и проводится по схеме 0–2–6 месяцы.
В России вакцина Гардасил® разрешена к применению детям и подросткам в возрасте от 9 до 17 лет и молодым женщинам в возрасте от 18 до 26 лет для профилактики заболеваний, вызываемых вирусом папилломы человека 6, 11, 16 и 18–го типов:
- рака шейки матки, вульвы и влагалища;
- генитальных кондилом;
предраковых диспластических состояний:
- аденокарциномы шейки матки in situ (AIS);
- цервикальной интраэпителиальной неоплазии II и III степени (CIN 2/3);
- интраэпителиальной неоплазии вульвы II и III степени (VIN 2/3);
- интраэпителиальной неоплазии влагалища II и III степени (VaIN 2/3);
- цервикальной интраэпителиальной неоплазии I степени (CIN 1).
Профилактическая эффективность
Эффективность вакцины Гардасил® оценивалась в четырех двойных слепых, плацебоконтролируемых, рандомизированных клинических исследованиях, в которые было включено 20542 женщин в возрасте от 16 до 26 лет. Длительность наблюдения за участницами исследования составила пять лет (24, 26, 30).
Гинекологическое исследование, включающее забор цервикальных образцов для тонкослойного Пап–тестирования, было выполнено исходно и затем с регулярными интервалами, согласно алгоритму выполнялась кольпоскопия и биопсия с ВПЧ–типированием.
Конечными точками эффективности были комбинированные показатели: CIN любой степени, включая AIS, ассоциированные с ВПЧ 6/11/16/18 (24); CIN 2/3 и AIS или более, ассоциированные с ВПЧ 16/18 (26); генитальные кондиломы, интраэпителиальная неоплазия или рак вульвы или влагалища, ассоциированные с ВПЧ 6/11/16/18 (24); персистирующая инфекция вакцинными типами ВПЧ или ассоциированные заболевания (30). Персистирующая инфекция означала обнаружение одного и того же типа ВПЧ в двух последовательных образцах, полученных с интервалом ≥4 месяца или в последний исследовательский визит; заболевание включало CIN и более и наружные генитальные поражения.
У женщин, которые были негативны ко всем четырем вакцинным типам, CIN, генитальные кондиломы, VIN и VaIN, вызванные любым из 4 вакцинных типов, рассматривались в качестве конечной точки.
Среди женщин, которые были позитивны (ПЦР и/или серопозитивны) к вакцинному типу в день 1-й, конечные точки, связанные с этим типом, не были включены в анализ профилактической эффективности. Конечные точки, связанные с оставшимися типами, по отношению к которым субъект был негативен, учитывались.
Первичный анализ был выполнен у тех женщин, которые получили все три дозы вакцины в течение первого года от момента включения в исследование, не имели значимых отклонений от протокола исследования и у которых не были выявлены ВПЧ соответствующих типов в начале исследования и через месяц после завершения вакцинации. Эффективность изучалась как в индивидуальных исследованиях, так и путем комбинированного анализа, начиная с седьмого месяца исследования (24, 26).
Цервикальная интраэпителиальная неоплазия
Гардасил® в 100% случаев предотвратил развитие CIN 2/3 и аденокарциномы in situ (AIS), вызываемых ВПЧ 16–го и 18–го типов. В группе из 8478 женщин, которые получили Гардасил®, не было отмечено случаев возникновения этих заболеваний – по сравнению с 53 зарегистрированными случаями в контрольной группе из 8460 женщин, получивших плацебо.
Гардасил® в 95% случаев предупредил развитие CIN 1 и предраковых поражений (CIN 2/3 или AIS), которые вызываются ВПЧ 6, 11, 16 и 18–го типов. В группе из 7858 женщин, получивших Гардасил®, наблюдалось четыре случая возникновения этих заболеваний, в то время как в группе плацебо (7861 женщина) было 83 случая этих заболеваний.
Интраэпителиальная неоплазия вульвы и влагалища
Гардасил® в 100% случаев предупредил развитие предраковых поражений вульвы и влагалища (VIN 2/3 и VaIN 2/3), вызванных ВПЧ 16-го и 18-го типов, у женщин ранее ими не инфицированных. В группе из 7769 женщин, получивших Гардасил, не было отмечено случаев возникновения этих заболеваний в сравнении с контрольной группой, состоящей из 7741 женщин, где было зарегистрировано 10 случаев этих заболеваний
Генитальные кондиломы
Гардасил® в 99% случаев предупредил развитие генитальных кондилом, которые вызываются ВПЧ 6–го, 11–го типов. В группе из 7897 женщин, получивших Гардасил, наблюдался один случай возникновения генитальных кондилом, а в группе из 7899 женщин, получивших плацебо, это заболевание было выявлено у 91 женщины.
Персистирующая впч инфекция
Квадривалентная ВПЧ вакцина в результате 30–месячного наблюдения, продемонстрировала 90% эффективность в предупреждении персистирующей ВПЧ инфекции 6, 11, 16 и 18–го типами ВПЧ или ассоциированных заболеваний; эффективность была 100% при учете только заболеваний. В результате продолжительного наблюдения (241 женщина наблюдалась 5 лет) вакцина показала высокую эффективность в профилактике случаев инфекции или заболеваний (96%) и абсолютную эффективность (100%) при учете только заболеваний (29).
Исследования также показали, что назначение вакцины Гардасил® женщинам, которые уже были инфицированы одним или более вакцинными типами перед вакцинацией, защищает их от клинического заболевания, вызванного оставшимися вакцинными типами. Не получено очевидных доказательств защиты от заболеваний, вызванных ВПЧ типами, по отношению к которым женщины были позитивны исходно (9).
Для того чтобы оценить потенциальное влияние вакцины Гардасил® на уровень заболеваемости раком шейки и другими ВПЧ–ассоциированными заболеваниями в общей популяции был проведен вторичный анализ (19). В этот анализ были включены все женщины независимо от их исходного ВПЧ статуса, а также те, которые не получили полный курс вакцинации. Согласно данным этого анализа, в течение двух–четырех лет вакцинация квадривалентной вакциной снижала риск развития предраковых заболеваний и рака шейки матки, вызванных ВПЧ 16–го и 18–го типов, примерно на 40%. Вероятность развития генитальных кондилом, связанных с ВПЧ 6-го, 11-го типов, развивающихся быстрее, чем рак и предраковое состояние шейки матки, снижалась на 70%. Большинство зарегистрированных эпизодов возникновения CIN и генитальных кондилом у вакцинированных Гардасилом® были результатом инфекций, которые на момент вакцинации уже имели место.
В результате исследований были также получены важные дополнительные данные: Гардасил® нейтрализовал два дополнительных онкогенных типа ВПЧ – 31 и 45 – которые не содержатся в вакцине, но являются родственными ВПЧ 16–го и 18–го (27). Эти результаты in vitro позволяют предположить, что иммунная реакция, индуцированная вакциной Гардасил, может предотвратить инфицирование, вызванное ВПЧ 31 и 45 типов, которые являются причиной ~ 8–9% всех случаев рака шейки матки. В настоящее время проводятся исследования для подтверждения этих данных.
Иммуногенность. Иммуногенность вакцины оценивалась в нескольких рандомизированных двойных слепых исследованиях у девочек и мальчиков 9–15 лет и молодых женщин 16–26 лет (18, 22, 23, 24).
Типоспецифичный иммунологический анализ с типо–специфичными антителами использовался для оценки иммуногенности каждого вакцинного типа. С помощью этого анализа измеряли уровень антител против нейтрализующих эпитопов для каждого типа. Шкалы для этих анализов уникальны для каждого ВПЧ типа, поэтому сравнение между типами и с результатами других анализов невозможны.
Клинические исследования показали, что вакцина Гардасил® генерирует сильный анти-ВПЧ иммунный ответ сразу по завершении вакцинации. В целом, 99,8% и 99,5% девочек или женщин, которые получили Гардасил® стали анти–ВПЧ 6, анти–ВПЧ 11, анти– ВПЧ 16 и анти– ВПЧ 18 серопозитивными, соответственно, через месяц после завершения вакцинации во всех возрастных группах тестируемых (18).
Иммунный ответ на вакцину был более выраженным, чем вследствие естественной инфекции. Титр антител у вакцинированных пациенток оказался существенно выше, чем у реципиентов плацебо, которые имели ВПЧ–инфекцию в анамнезе, т. е. естественный иммунный ответ. И хотя титр антител у вакцинированных Гардасилом® после 7–го месяца начинал снижаться, через 5 лет он оставался все еще более высоким, чем у тех, кто имел естественный иммунитет в группе плацебо. Снижение титра антител не было связано со снижением эффективности (30).
Одно из исследований, спланированное для сравнения иммуногенности вакцины у подростков и молодых женщин, продемонстрировало наибольшую иммуногенность вакцины у подростков: геометрически значимый титр антител (GMT) был у них в 1,7–2,7 раз выше, чем у молодых женщин (18).
Продолжительность иммунитета вследствие полной вакцинации Гардасилом®, по меньшей мере, 5 лет. Но бустерная доза вряд ли понадобится, поскольку вакцинированные женщины продемонстрировали наличие иммунологической памяти. Через 5 лет наблюдения на введение провокационной дозы антигена наблюдался сильный анамнестический ответ у тех женщин, которые были ДНК негативны к ВПЧ типам в течение этого периода. В результате введения 4–х доз антигена титр антител в течение месяца увеличился в 11–40 раз в сравнении с величиной непосредственно перед дополнительной вакцинацией (31).
Переносимость. Безопасность и переносимость вакцины оценена у 21464 субъектов. Из них 5088 девочек и женщин в возрасте 9–26 лет, получивших вакцину и 3790 – плацебо, подробно наблюдались в течение 14 дней после каждой инъекции (16).
Квадривалентная вакцина хорошо переносилась. Слабо и умеренно–выраженная реакция в месте инъекции была наиболее частым вакцин–обусловленным побочным явлением: боль 84%, отек 25%, эритема 25%, зуд 3% против 75%, 16%, 18% и 3%, соответственно, у получивших алюминиево–содержащий плацебо. Гипертермия значительно чаще (13%) наблюдалась у подростков, чем у молодых женщин (7%), но была кратковременной и не имела серьезных клинических последствий.
Головная боль была наиболее частым системным побочным явлением. Серьезных неблагоприятных побочных явлений у вакцинированных не наблюдалось.
Несмотря на то, что репродуктивные исследования, выполненные в эксперименте на животных, не выявили неблагоприятного влияния вакцины Гардасил® на фертильность, плод и дальнейшее развитие потомства, специально спланированных и хорошо контролируемых исследований у беременных женщин не проводилось, поэтому ее введение во время беременности противопоказано. В случае беременности необходимо прервать вакцинацию и завершить ее после разрешения беременности.
Вакцину Гардасил® можно вводить кормящим матерям. Во время клинических исследований 995 кормящих матерей получили Гардасил® или плацебо (500 из вакцинной группы и 495 из группы плацебо). Ни одно из заболеваний новорожденных от женщин, получивших Гардасил® или плацебо, не было расценено исследователями, как связанное с вакцинацией.
Продолжающиеся и будущие исследования. ВПЧ вакцина предназначена, в первую очередь, подросткам и молодым женщинам. Причем предпочтительна ранняя вакцинация, поскольку вакцину важно ввести до встречи с вирусом. Кроме того, иммунологические данные демонстрируют более выраженный иммунный ответ на ВПЧ вакцину, как и на другие вакцины, именно в препубертатном возрасте (28).
Вместе с тем обсуждается вопрос о целесообразности вакцинации женщин старшего возраста, поскольку риск инфекции остается на протяжении всей сексуально–активной жизни женщины. Поэтому в настоящее время компанией MSD проводятся исследования иммуногенности, переносимости и эффективности Гардасила® у женщин 26–45 лет.
Хотя женщины страдают от ВПЧ инфекции в большей степени, генитальные кондиломы одинаково часто встречаются у мужчин и у женщин, ~ 85% анальных раков ассоциированы с ВПЧ (10, 11, 34). Кроме того, мужчины являются векторами – переносят инфекцию женщинам (11). В рамках мужской программы уже исследована иммуногенность вакцины у 10–15–летних мальчиков. С сентября 2004 года начато и в настоящее время продолжается исследование по оценке безопасности и эффективности квадривалентной вакцины у молодых (16–23 летних) мужчин.
Для оценки долгосрочной эффективности вакцины MSD работает в сотрудничестве с органами здравоохранения четырех северных стран Европы (Дании, Норвегии, Исландии и Швеции). Эти страны имеют наиболее организованную скрининговую инфраструктуру, с централизованной регистрацией всех Пап-тестов. Это, как ожидается, поможет оценить продолжительность защиты, оценить уровень ВПЧ–ассоциированных заболеваний в популяции и мониторировать долгосрочную безопасность вакцины.
Заключение. Усилия по элиминации цервикального рака начались 50 лет назад с внедрения Пап-теста. Цитологический скрининг снизил показатели цервикального рака на 75% в странах, которые были способны внедрить и поддерживать централизованные качественно–контролируемые программы. Следующая значительная веха в профилактике цервикального рака пришла в 1980–х с открытием связи между цервикальным раком и ВПЧ. В течение последующих 20 лет эпидемиологические исследования четко продемонстрировали, что инфекция типами «высокого риска» или «канцерогенными» необходима для развития цервикального рака. Это привело к развитию чувствительных молекулярных методов для обнаружения ВПЧ и обеспечило базис для вакцинных стратегий для первичной профилактики рака шейки матки. Ввиду огромного распространения ВПЧ–16, 18–обусловленных раков в мире и ограниченных возможностей цитологического скрининга, потенциальную выгоду для здравоохранения от эффективной ВПЧ вакцины трудно преувеличить. Вакцина Гардасил® способна предотвратить 80% случаев цервикального рака. Вместе с тем важно отметить, что ВПЧ вакцинация не отменяет рутинный скрининг рака шейки матки, который останется главным оплотом превентивных программ, так как он будет являться условием долгосрочной оценки эффективности вакцин и женщины все еще будут восприимчивы к оставшимся онкогенным ВПЧ типам, не связанным с вакцинными типами.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.