количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Гастроинтестинальные стромальные опухоли: современная классификация, дифференциальная диагностика и факторы прогноза
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Онкология, гематология и радиология." № 1 (14)
- Аннотация
- Статья
- Ссылки
- English
В статье представлены современные данные по классификации, дифференциальной диагностике и факторам прогноза гастроинтестинальных стромальных опухолей.
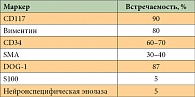
Таблица 1. Иммуногистохимическое исследование ГИСО
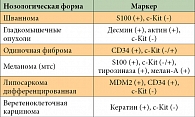
Таблица 2. Иммуногистохимические особенности дифференциальной диагностики ГИСО
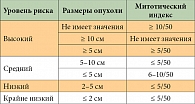
Таблица 3. Оценка злокачественного потенциала ГИСО
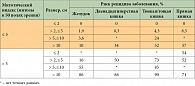
Таблица 4. Риск прогрессирования ГИСО в зависимости от митотического индекса, размера и локализации опухоли
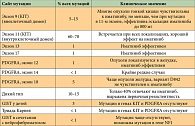
Таблица 5. Клиническое значение различных мутаций гена KIT
В настоящее время к гастроинтестинальным стромальным опухолям (ГИСО) относят мезенхимальные новообразования желудочно-кишечного тракта (ЖКТ), для которых характерна гиперэкспрессия гена KIT, а также CD34, антигенов гладкомышечной и нейрогенной дифференцировки с различной частотой [1–3]. На их долю приходятся 80% всех сарком ЖКТ и 5% сарком мягких тканей [4]. Заболеваемость ГИСО составляет 10–20 случаев в год на 1 млн населения. Ежегодно в США регистрируется около 5000–6000 новых случаев [5–7]. В России точных данных нет, расчетная частота составляет 2000–2500 случаев в год.
ГИСО встречаются в любом отделе ЖКТ, но чаще в желудке (60–70%) и тонкой кишке (20–25%), редко – в пищеводе (2%) и толстой кишке (5%), еще реже – вне ЖКТ, например, в брыжейке или сальнике (менее 2%) [8, 9].
В отдельную нозологическую группу ГИСО были выделены 30 лет назад после того, как в 1983 г. M.T. Mazur и H.B. Clark [10] описали ультраструктурные отличия ГИСО от опухолей с истинной нейрогенной (шванномы) и гладкомышечной (лейомиомы и лейомиосаркомы) дифференцировкой. В прошлом 72% ГИСО диагностировались как «другие» типы сарком [6].
В настоящее время патологоанатомический диагноз ГИСО базируется на морфологических и иммуногистохимических данных. Основными гистологическими типами ГИСО считаются веретеноклеточный (70%), эпителиоидный (20%) и смешанный [1–3, 11]. ГИСО веретеноклеточного типа представлены полисадообразными структурами с мономорфными ядрами округлой или вытянутой формы. Для эпителиоидного типа гистологического строения характерно наличие клеток полигональной или округлой форм со светлой цитоплазмой, формирующих солидные, солидно-альвеолярные структуры и клеточные гнезда [12]. К редко встречающимся типам ГИСО относятся плеоморфный, перстневидно-клеточный, мезотелиомоподобный и онкоцитарный.
Следует отметить: несмотря на то что клеточный полиморфизм в той или иной степени свойственен всем ГИСО, при эпителиоидном типе гистологического строения опухоли он наиболее выражен. С данным типом строения ГИСО сопряжено более агрессивное течение заболевания [13].
Существенный вклад в понимание патогенеза и конкретизацию классификации был внесен в 1998 г. исследованиями, выявившими гиперэкспрессию клетками ГИСО тирозинкиназного рецептора c-Kit (CD117) и его безлигандную активацию [14]. Это явление представляет собой главный механизм неопластической трансформации, приводящей к развитию данных новообразований.
Ген KIT кодирует белок c-Kit, который выступает в качестве трансмембранного рецептора фактора роста стволовых клеток. Мутации гена KIT могут наблюдаться в экзонах 9, 11, 13 или 17, кодирующих внеклеточный или внутриклеточный домены рецептора [15]. Помимо этого аналогичные, но при этом взаимоисключающие, мутации позже были выявлены в 5% ГИСО со стороны гена, кодирующего рецептор тромбоцитарного фактора роста альфа (PDGFRA). Следует отметить, что в 10–15% ГИСО отсутствуют мутации генов KIT и PDGFRA – это так называемый дикий тип.
К прочим маркерам относятся: молекула, условно названная DOG-1 (присутствует в 87% ГИСО), протеинкиназа тэта (80%), CD34 (60–70%), а также актин гладкомышечных клеток (30–40%). Некоторые ГИСО также дают положительные результаты иммуногистохимических анализов на белок S100 (5%), десмин (1–2%) и кератин (1–2%) [1–3, 16–19].
Иммуногистохимическое исследование должно быть выполнено без демаскировки антигенов, так как это может привести к ложноположительному результату CD117-окрашивания. В сложных диагностических случаях морфологический диагноз следует подтверждать в референс-лабораториях. В табл. 1 приведены иммуногистохимические маркеры, наиболее характерные для ГИСО, хотя по своей специфичности они несколько уступают окраске на CD117.
Объективными признаками неблагоприятного прогноза являются повышение индекса пролиферации по экспрессии маркера Ki-67 (более 10% ядер, экспрессирующих Ki-67) и утрата опухолевыми клетками экспрессии маркеров нейрогенной и гладкомышечной дифференцировок.
Дифференциальная диагностика ГИСО проводится с опухолями, которые можно разделить на две группы: опухоли, экспрессирующие CD117, и опухоли, которые не экспрессируют CD117 [20, 21]. К первой группе относятся такие опухоли, как меланома, ангиосаркома, злокачественные глиомы, мелкоклеточный рак легких, саркома Капоши и реактивная нодулярная фиброзная псевдоопухоль ЖКТ. Особенности клинической картины в совокупности с определением различных иммуногистохимических маркеров (CD34, CD31, виментин, SMA, десмин, MSA, CD99 и др.) позволяют в случае обнаружения опухолей из этой группы поставить правильный диагноз. Во вторую группу входят лейомиомы, лейомиосаркомы, шванномы и другие опухоли ЖКТ. Отсутствие экспрессии CD117 позволяет исключить диагноз ГИСО (табл. 2).
В случае диагностики CD117-негативных опухолей или опухолей редкой локализации (сальники, матка, забрюшинное пространство) необходимо проведение молекулярно-генетического анализа, позволяющего установить гистогенез опухоли. Выполнение данного вида исследования возможно при фиксации образцов опухоли в формалине. А заморозка тканевых образцов позволит использовать в будущем новые молекулярные методы патоморфологической диагностики [22].
В соответствии с Международной онкологической классификацией выделяют доброкачественные, с неуточненным прогнозом и злокачественные ГИСО. Существует мнение как о потенциальной злокачественности всех ГИСО, так и о доброкачественном характере опухолей размером до 2 см и с минимальной митотической активностью. В то же время описаны случаи рецидивов и метастазирования ГИСО любых размеров.
Дифференцируя ГИСО по степени злокачественности, ряд авторов опираются на систему критериев, предложенную Федерацией французских национальных онкологических центров (Fédération Nationale des Centres de Lutte Contre le Cancer – FNCLCC), разработанную для гистологической градации сарком, в совокупности с оценкой выраженности клеточного полиморфизма, показателями клеточности опухоли, наличием инвазии в слизистую оболочку и очагов некроза. В то же время Объединенная рабочая группа Национальных институтов здоровья США (GIST workshop, National Institutes of Health), созданная для изучения ГИСО, рекомендует использовать систему определения «риска агрессивности», учитывающую только размеры опухоли и число митозов в 50 репрезентативных полях зрения при увеличении в 400 раз (табл. 3) [23].
Вместе с тем в руководствах Европейского общества медицинской онкологии (European Society for Medical Oncology – ESMO) и Национальной всеобщей онкологической службы США (National Comprehensive Cancer Network – NCCN) (табл. 4) подчеркивается, что еще большей прогностической значимостью обладает локализация первичного опухолевого очага [24]. В частности, об этом свидетельствует то, что ГИСО с локализацией в желудке имеют лучший прогноз, чем ГИСО тонкой или прямой кишки. Кроме того, руководством ESMO признается важность разрыва капсулы опухоли (как спонтанного, так и при выполнении хирургической резекции) в качестве неблагоприятного прогностического фактора, учитывая сопровождающую его контаминацию брюшины [22].
Последние данные и кооперированные клинические исследования говорят о том, что сайт мутации имеет большое клиническое значение, так как позволяет прогнозировать эффективность таргетной терапии первой линии (табл. 5) [25].
В ряде работ было продемонстрировано наличие взаимосвязи между анатомическим расположением первичной ГИСО, ее гистологическим строением и наличием специфических мутаций
[26, 27, 28].
Таким образом, в сегодняшней клинической практике с целью оценки агрессивности опухоли необходимо применять анализ совокупности прогностических факторов, таких как гистологический тип опухоли, частота митозов, размер и локализация новообразования, разрыв капсулы опухоли при проведении хирургического лечения и сайт генной мутации.
1. Miettinen M., Lasota J. Gastrointestinal stromal tumors (GISTs): definition, occurrence, pathology, differential diagnosis and molecular genetics // Pol. J. Pathol. 2003. Vol. 54. № 1. P. 3–24.
2. Анурова О.А. Морфологическая и иммуногистохимическая диагностика стромальных опухолей желудочно-кишечного тракта (GIST) / Материалы выездной школы 16–18.10.2006 «Актуальные проблемы диагностики и лечения стромальных опухолей ЖКТ (GIST)» // Современная онкология. 2007. Экстра-выпуск. С. 79–99.
3. Казанцева И.А. Морфологические особенности ГИСО / Материалы выездной школы 16–18.10.2006 «Актуальные проблемы диагностики и лечения стромальных опухолей ЖКТ (GIST)» // Современная онкология. 2007. Экстра-выпуск. С. 50–79.
4. Sakurai S., Fukasawa T., Chong J.M. et al. C-kit gene abnormalities in gastrointestinal stromal tumors (tumors of interstitial cells of Cajal) // Jpn. J. Cancer Res. 1999. Vol. 90. № 12. P. 1321–1328.
5. Mucciarini C., Rossi G., Bertolini F. et al. Incidence and clinicopathologic features of gastrointestinal stromal tumors. A population-based study // BMC Cancer. 2007. Vol. 7. P. 230.
6. Nilsson B., Bümming P., Meis-Kindblom J.M. et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era – a population-based study in western Sweden // Cancer. 2005. Vol. 103. № 4. P. 821–829.
7. Tryggvason G., Gíslason H.G., Magnússon M.K., Jónasson J.G. Gastrointestinal stromal tumors in Iceland, 1990-2003: the icelandic GIST study, a population-based incidence and pathologic risk stratification study // Int. J. Cancer. 2005. Vol. 117. № 2. P. 289–293.
8. Corless C.L., Heinrich M.C. Molecular pathobiology of gastrointestinal stromal sarcomas // Annu. Rev. Pathol. 2008. Vol. 3. P. 557–586.
9. Miettinen M., Lasota J. Gastrointestinal stromal tumors – definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis // Virchows Arch. 2001. Vol. 438. № 1. P. 1–12.
10. Mazur M.T., Clark H.B. Gastric stromal tumors. Reappraisal of histogenesis // Am. J. Surg. Pathol. 1983. Vol. 7. № 6. P. 507–519.
11. Серяков А.П. Гастроинтестинальные стромальные опухоли // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2010. Т. 20. № 4. С. 49–57.
12. Blay J.Y., Bonvalot S., Casali P. et al. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO // Ann. Oncol. 2005. Vol. 16. № 4. P. 566–578.
13. Singer S., Rubin B.P., Lux M.L. et al. Prognostic value of KIT mutation type, mitotic activity, and histologic subtype in gastrointestinal stromal tumors // J. Clin. Oncol. 2002. Vol. 20. № 18. P. 3898–3905.
14. Hirota S., Isozaki K., Moriyama Y. et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors // Science. 1998. Vol. 279. № 5350. P. 577–580.
15. Kawanowa K., Sakuma Y., Sakurai S. et al. High incidence of microscopic gastrointestinal stromal tumors in the stomach // Hum. Pathol. 2006. Vol. 37. № 12. P. 1527–1535.
16. Miettinen M., Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis // Arch. Pathol. Lab. Med. 2006. Vol. 130. № 10. P. 1466–1478.
17. Miettinen M., Makhlouf H., Sobin L.H., Lasota J. Gastrointestinal stromal tumors of the jejunum and ileum: a clinicopathologic, immunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term follow-up // Am. J. Surg. Pathol. 2006. Vol. 30. № 4. P. 477–489.
18. Rubin B.P., Heinrich M.C., Corless C.L. Gastrointestinal stromal tumour // Lancet. 2007. Vol. 369. № 9574. P. 1731–1741.
19. Стилиди И.С., Архири П.П., Никулин М.П. и др. Клинико-морфологические факторы прогноза у больных стромальными опухолями желудочно-кишечного тракта // Фарматека. 2010. № 6. С. 50–54.
20. Demetri G.D., Benjamin R., Blanke C.D. et al. NCCN Task Force report: optimal management of patients with gastrointestinal stromal tumor (GIST) – expansion and update of NCCN clinical practice guidelines // J. Natl. Compr. Canc. Netw. 2004. Vol. 2. Suppl. 1. P. S1–S26.
21. Orosz Z., Tornóczky T., Sápi Z. Gastrointestinal stromal tumors: a clinicopathologic and immunohistochemical study of 136 cases // Pathol. Oncol. Res. 2005. Vol. 11. № 1. P. 11–21.
22. ESMO Clinical Recommendations for diagnosis, treatment and follow-up. 2010. P. 147–153.
23. Fletcher C.D., Berman J.J., Corless C. et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach // Hum. Pathol. 2002. Vol. 33. № 5. P. 459–465.
24. Dematteo R.P., Gold J.S., Saran L. et al. Tumor mitotic rate, size, and location independently predict recurrence after resection of primary gastrointestinal stromal tumor (GIST) // Cancer. 2008. Vol. 112. № 3. P. 608–615.
25. Debiec-Rychter M., Sciot R., Le Cesne A. et al. KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours // Eur. J. Cancer. 2006. Vol. 42. № 8. P. 1093–1103.
26. Sakurai S., Hasegawa T., Sakuma Y. et al. Myxoid epithelioid gastrointestinal stromal tumor (GIST) with mast cell infiltrations: a subtype of GIST with mutations of platelet-derived growth factor receptor alpha gene // Hum. Pathol. 2004. Vol. 35. № 10. P. 1223–1230.
27. Wardelmann E., Hrychyk A., Merkelbach-Bruse S. et al. Association of platelet-derived growth factor receptor alpha mutations with gastric primary site and epithelioid or mixed cell morphology in gastrointestinal stromal tumors // J. Mol. Diagn. 2004. Vol. 6. № 3. P. 197–204.
28. Wasag B., Debiec-Rychter M., Pauwels P. et al. Differential expression of KIT/PDGFRA mutant isoforms in epithelioid and mixed variants of gastrointestinal stromal tumors depends predominantly on the tumor site // Mod. Pathol. 2004. Vol. 17. № 8. P. 889–894.
Gastrointestinal stromal tumors: contemporary classification, differential diagnosis and prognostic factors
A.G. Kornilova, L.M. Kogoniya, V.S. Mazurin, S.V. Mordanov, O.S. Oksenyuk
M.F. Vladimirsky Moscow Regional Clinical Research Institute, Moscow
Rostov State Medical University, Rostov-on-Don
Contact person: Anush Grigoryevna Kornilova, doc.kornilova@mail.ru
Contemporary classification, differential diagnostics and prognostic factors for gastrointestinal stromal tumors are outlined.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.