Консервативная терапия черепно-мозговой травмы
- Аннотация
- Статья
- Ссылки
- English
Классификация черепно-мозговой травмы
Согласно классификации А.Н. Коновалова и соавт. 1992 г., выделяют следующие клинические формы черепно-мозговой травмы (ЧМТ):
- сотрясение головного мозга – ушиб головного мозга:
- легкой степени тяжести;
- средней степени тяжести;
- тяжелой степени;
- диффузное аксональное повреждение мозга – сдавление:
- мозга (на фоне ушиба мозга);
- головы (без ушиба головного мозга) [1].
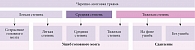
Выделяют три степени тяжести ЧМТ:
- легкую (сотрясение и ушиб мозга легкой степени);
- среднюю (ушиб мозга средней степени);
- тяжелую (ушиб мозга тяжелой степени и сдавление мозга) (рисунок) [1].
Разные степени тяжести ЧМТ характеризуются определенными клиническими признаками (таблица) [2, 3].
Клиническая картина при ЧМТ средней и тяжелой степени, как правило, характеризуется повреждением головного мозга вследствие прямого удара, противоудара и гидравлического удара, отеком, набуханием головного мозга, внутричерепной гипертензией, возможной дислокацией и вклинением ствола головного мозга.
В случае ЧМТ легкой степени грубого патоморфологического субстрата при нейровизуализационном исследовании не обнаруживается. Однако диффузное аксональное повреждение вследствие линейного или вращательного ускорения, приводящего к смещению больших полушарий относительно жестко фиксированного ствола и соответственно натяжению и скручиванию длинных аксонов в глубине белого вещества полушарий, мозолистом теле и стволе [4], обусловливает сбой тонкого сбалансированного механизма деятельности высшего интегративного органа – головного мозга. Нарушаются ассоциативные связи. В основе повреждающего воздействия при ЧМТ легкой степени лежит асинапсия – результат воздействия инерционного и ударного ускорения на нейросети [5]. Нарушение коллоидного равновесия в нервных клетках приводит к набуханию синапсов и блокаде импульсации (охранительное торможение) [6].
По опасности инфицирования внутричерепного содержимого ЧМТ подразделяют на закрытую и открытую. Под закрытой ЧМТ понимают повреждения, при которых отсутствуют нарушения кожных покровов головы или имеются ранения мягких тканей без повреждения апоневроза. Переломы костей свода черепа, не сопровождающиеся ранением прилегающих мягких тканей или апоневроза, относят также к закрытым повреждениям черепа. Об открытой ЧМТ говорят в тех случаях, когда имеют место раны мягких покровов головы с повреждением апоневроза или переломом основания черепа, кровотечения или ликворея (назальная или ушная). В свою очередь открытые ЧМТ подразделяют на непроникающие (при сохранении целости твердой мозговой оболочки) и проникающие (при нарушении целости твердой мозговой оболочки).
Периоды ЧМТ
В настоящее время выделяют три периода ЧМТ (травматической болезни головного мозга) – острый, промежуточный, отдаленный [7].
Острый период ЧМТ определяется взаимодействием травматического субстрата, реакций повреждения и реакций защиты и исчисляется временным промежутком от момента повреждающего воздействия механической энергии до стабилизации на том или ином уровне нарушенных общемозговых и общеорганизменных функций либо смерти пострадавшего. Продолжительность острого периода – от двух до десяти недель в зависимости от клинической формы ЧМТ.
Промежуточный период характеризуется рассасыванием и организацией участков повреждений и развертыванием компенсаторно-приспособительных процессов до полного или частичного восстановления или устойчивой компенсации нарушенных функций. Продолжительность промежуточного периода при нетяжелой ЧМТ – до шести месяцев, при тяжелой – до года.
Отдаленный период связывают с завершением или сосуществованием дегенеративных и репаративных процессов. Продолжительность периода при клиническом выздоровлении – до двух-трех лет, при прогредиентном течении не ограничена.
Острый период
Клинический синдромокомплекс ЧМТ определяется характером первичного повреждения мозга и развивающимися вторичными повреждениями.
К первичным повреждениям относятся:
- повреждения (переломы) свода черепа и лицевой части скелета;
- кровоизлияния (гематомы): эпи- и субдуральные, субарахноидальные, внутримозговые;
- церебральные контузии с кровоизлияниями и без них;
- диффузное аксональное повреждение волокон белого вещества мозга;
- повреждение экстра- и интракраниальных сосудов;
- сопутствующие травмы позвоночника.
Вторичные повреждения:
- отек мозга;
- гипоксия и гипотензия (как следствие, вторичная ишемия мозга);
- тромбозы;
- гипергликемия;
- гипертермия (лихорадка) с дальнейшим нарастанием отека мозга;
- ацидоз;
- повышенное высвобождение глутамата;
- вазоспазм.
Осложнениями ЧМТ считаются церебральная ишемия, инфекции, эпиприпадки, тромбоз глубоких вен нижних конечностей, полиневропатии и миопатии критических состояний.
Терапия в остром периоде направлена на предупреждение вторичных повреждений и осложнений ЧМТ. Терапия внутричерепной гипертензии (отека мозга) позволяет предотвратить вторичное повреждение паренхимы мозга. Следует избегать факторов, способствующих повышению внутричерепного давления (ВЧД). Речь, в частности, идет о кашле, срыгивании, чрезмерных переворачиваниях при перекладывании и транспортировке, холодовой дрожи. К повышению ВЧД могут приводить боль и стресс [8]. В таких случаях целесообразно выполнять адекватное обезболивание, седацию. В остром периоде не следует применять гипоосмолярные растворы. Назначают препараты, снижающие ВЧД: маннитол 20%, гипертонический раствор натрия хлорида 7,5%, глицерин.
При ЧМТ не стоит применять кортизон («препарат последней надежды») [9]. Нежелательно назначение цереброваскулярных препаратов, увеличивающих приток артериальной крови в полость черепа. Показано назначение венотонических препаратов.
Во избежание вторичной ишемии мозга проводятся мероприятия, предупреждающие гипоксию, гипотензию. По мнению ряда экспертов, при ЧМТ не следует использовать магний, нимодипин [9].
В целях профилактики гипертермии необходимо снижать температуру тела. Для этого применяют физические методы (обтирание, холодовые компрессы, лечебная гипотермия) [10] и вводят антипиретики.
Для профилактики гипергликемии пациентам с ЧМТ обычно проводят коррекцию гипергликемии с помощью инсулинотерапии [11].
Лечебная физкультура и пассивные движения конечностей, ношение компрессионного трикотажа показаны в целях профилактики тромбоза.
Профилактика инфекций предполагает проведение антибиотикотерапии у всех пациентов с открытой ЧМТ. Сказанное в первую очередь касается пациентов с рино- и отоликвореей.
Противосудорожная терапия (ранние припадки отмечаются у 20% пациентов) целесообразна при ранних судорожных приступах (в течение первой недели ЧМТ) и критическом состоянии. Назначают карбамазепин, вальпроевую кислоту на короткий период с последующим постепенным снижением дозы и полной отменой препарата. После позднего приступа (спустя неделю) риск повторных эпиприступов значительно возрастает, поэтому проводится длительная противоэпилептическая терапия [12].
Терапии боли предусматривает использование неселективных нестероидных противовоспалительных препаратов (НПВП), миорелаксантов.
Полиневропатия, или миопатия критических состояний, проявляется генерализованной атрофией мышц и выраженными дистальными вялыми парезами тяжелой степени. Подобное состояние обусловлено аксональным повреждением, как правило, моторных нервных волокон на фоне денервации мышц. При развитии полиневропатии/миопатии критических состояний в дальнейшем в 2–7 раз усложняется отлучение пациента от системы жизнеобеспечения (например, аппарата искусственной вентиляции легких). Кроме того, замедляется и усложняется мобилизация пациента, восстановление двигательных функций.
Промежуточный и отдаленный периоды
В промежуточном и отдаленном периодах ЧМТ могут наблюдаться патологические синдромы.
Синдром вегетативной дисфункции характеризуется нестабильным артериальным давлением, синусовой тахикардией, ангиоспазмами (церебральными, кардиальными, периферическими), нарушениями терморегуляции (субфебрилитетом, термоасимметрией), обменно-эндокринными нарушениями (дистиреозом, гипоаменореей, импотенцией, изменениями углеводного, водно-солевого и жирового обменов). В рамках вегетативной недостаточности и в отдаленном периоде ЧМТ могут развиться тромбоз глубоких вен нижних конечностей и полиневропатия критических состояний.
Посттравматический астенический синдром (АС). Выделяют простой и сложный типы АС, в каждом типе – гипостенический и гиперстенический. Чаще встречается простая астения в виде повышенной психической и физической истощаемости с резким снижением умственной деятельности, нарушением сна. Для купирования посттравматического АС назначают энерготропные (например, левокарнитин), метаболомные препараты, витамины.
Посттравматические ликвородинамические нарушения развиваются в более чем трети случаев ЧМТ, наблюдаются в виде не только ликворной гипертензии (гиперсекреторной или гипорезорбтивной, обычно вследствие поражения пахионовых грануляций белком или детритом), но и ликворной гипотензии (из-за нарушения ликворопродукции, целости оболочек головного мозга, на фоне ликвореи, а также длительного неадекватного использования дегидратирующих препаратов).
Церебрально-очаговый синдром, развивающийся преимущественно у больных, перенесших тяжелую ЧМТ, клинически проявляется различными нарушениями высших корковых функций, расстройствами движений и чувствительности, поражением черепных нервов. В большинстве случаев имеет место регредиентный тип течения, а клиническая симптоматика определяется локализацией и величиной очага деструкции мозговой ткани.
Психоэмоциональные (эмоционально-личностные) расстройства. В данном аспекте особое значение имеют посттравматическое стрессовое расстройство (ПТСР), распространенность которого достигает 8% всех ЧМТ, острое и хроническое расстройство адаптации и др.
ПТСР возникает в результате психологической травмы, исключительно неблагоприятного события или нежелательной перемены в жизни. У пациента после ЧМТ формируется избегание стимулов, ассоциируемых с перенесенной травмой. Беспокоят эпизоды повторяющихся переживаний травмирующего события в навязчивых воспоминаниях на фоне возможного оцепенения, эмоциональной заторможенности, эмоциональной анестезии, отчужденности. Могут наблюдаться усиление возбудимости (нарушения сна, концентрации внимания, раздражительность, стартл-реакция), избегание действий и ситуаций, напоминающих о травме. В рамках ПТСР имеют место идеи и попытки суицида.
Продолжительность ПТСР превышает 3–6 месяцев. Не исключено и хроническое течение, которое затягивается на многие годы с переходом в устойчивое изменение личности, нарушение социальной адаптации. Возможен латентный период дебюта проявлений (до нескольких месяцев). В DSM-IV выделены три типа ПТСР: острый (менее трех месяцев), хронический, отставленный (симптомы становятся очевидными спустя шесть и более месяцев после травмы).
Когнитивное снижение. ЧМТ особенно опасны для пациентов молодого возраста и детей. Имеются данные, демонстрирующие отставание в развитии, обучении у пациентов, перенесших ЧМТ. Когнитивное снижение нередко развивается в рамках отдаленных последствий ЧМТ. Это обусловлено тем, что в результате травмы не только развивается первичное повреждение мозговой ткани, отек мозга, но и нарастает оксидативный стресс, провоцируется нейрогенное воспаление, которое в свою очередь способно провоцировать и элиминировать детрит из очага травмы на неповрежденную мозговую ткань [13]. Кроме того, длительное персистирующее воспаление может спровоцировать нейродегенеративные процессы и отложение тау-протеина [9]. Длительное нарушение сознания при ЧМТ коррелирует с вероятностью отложения телец Леви, развития синдрома и болезни Паркинсона [14]. Вероятно, причиной увеличения риска нейродегенеративных процессов в отдаленном периоде ЧМТ (даже легкой степени) служит дисфункция глимфатической системы головного мозга.
Отдельно описывается так называемый посттравматический коммоционный синдром, или посткоммоционный синдром (ПКС), – интегративный синдромокомплекс, включающий не только эмоционально-личностные, но и вегетативные расстройства, когнитивное снижение. ПКС часто развивается даже при легкой ЧМТ в случае недостаточного соблюдения режима и неадекватной терапии, существенно снижает качество жизни пациента и ухудшает прогноз выздоровления.
Бытует мнение, что клиническая картина ПКС обусловлена исключительно эмоциональным потрясением во время ЧМТ (нередко легкая ЧМТ происходит в результате насилия), обидой, ятрогенными и стрессогенными последствиями. Пациентов с ПКС «подозревают» в рентных установках. Безусловно, психоэмоциональный фактор играет серьезную роль, особенно на фоне преддиспозиционных факторов и имевших место до травмы тревожно-фобических и депрессивных расстройств. Однако считать, что клиническая картина ПКС обусловлена только функциональными (психоэмоциональными) факторами, ошибочно и чревато осложнениями, в частности в виде утраты эффективной трудоспособности.
ПКС клинически проявляется головной болью, как правило напряженного типа, раздражительностью, снижением стрессоустойчивости, утомляемостью, нарушением сна. Нередко имеют место и психовегетативные расстройства как перманентного, так и пароксизмального характера.
В Международной классификации болезней 10-го пересмотра четко очерчены клинические признаки, необходимые для верификации ПКС:
- анамнестические сведения о травме головы с потерей сознания перед развитием симптоматики в период до четырех недель;
- минимум три признака из перечисленных ниже:
- жалобы на неприятные ощущения, такие как головная боль, головокружение, общее недомогание и повышенная утомляемость или непереносимость шума;
- эмоциональные изменения, в частности раздражительность, эмоциональная лабильность, некоторая степень депрессии и/или тревоги;
- субъективные жалобы на трудности сосредоточения внимания при умственных нагрузках, а также на нарушение памяти;
- бессонница;
- снижение толерантности к алкоголю;
- озабоченность указанными симптомами и страх хронического поражения мозга до степени ипохондрических сверхценных идей и принятия роли больного.
Для дифференциального диагноза ПКС с другими заболеваниями (депрессия, мигрень, цервикогенная патология) предлагают проведение физической нагрузки (например, тредмил-тест). Если физическая нагрузка не меняет состояние или приносит облегчение, значит, стоит искать альтернативное заболевание. Если на фоне физической нагрузки самочувствие ухудшается, значит, это ПКС [15].
Психоорганический синдром (ПОС). ПОС формируется у большинства больных, перенесших тяжелую ЧМТ, но нередко наблюдается и при легкой ЧМТ. К синдромам пограничного уровня относят астеноневротический, ипохондрический, обсессивно-фобический (страх, навязчивые мысли, действия), к синдромам субпсихотического уровня – гипоманиакальный, депрессивный, паранойяльный синдром, дезинтеграцию сознания – корсаковский синдром и глобальную амнезию, синдромы выпадения – дисмнестический синдром, аспонтанность, агнозии.
Посттравматическая эпилепсия (ПЭ) развивается в 5–15% случаев ЧМТ. Чаще приступы ПЭ начинаются в первый год от момента ЧМТ. Встречаются простые и сложные, а также вторично генерализованные тонико-клонические приступы. При ПЭ отмечаются сопутствующие психотические расстройства в виде дисфорий – периодически возникающих аффективных нарушений, раздражительности, злобы, агрессии.
У пациентов, перенесших ЧМТ, регистрируются эндокринологические осложнения:
- недостаточность передней доли гипофиза определяется у 30–70% пациентов после ЧМТ;
- дефицит гормона роста проявляется ухудшением умственной работоспособности и концентрации внимания, излишними жировыми отложениями в области живота и брюшной полости, уменьшением мышечной массы;
- дефицит тиреотропного гормона ассоциируется с личностными изменениями, аспонтанностью, депрессией, усталостью, непереносимостью холода, брадикардией, увеличением веса, сухостью кожных покровов;
- дефицит фолликулостимулирующего гормона/лютеинизирующего гормона приводит к бесплодию, уменьшению либидо/потенции, олиго-/аменорее, атрофии молочных желез, уменьшению оволосения в подмышечной и лобковой областях, бледности кожных покровов;
- дефицит адренокортикотропного гормона провоцирует депрессию, слабость, страх, потерю веса, гипогликемию, бледность кожных покровов, склонность к тошноте и рвоте в стрессовых ситуациях.
Учитывая высокий риск развития после ЧМТ гормональной недостаточности, необходимо всех пациентов направлять на консультацию эндокринолога и соответствующее эндокринологическое обследование.
После ЧМТ часто имеют место сочетанные повреждения, в том числе последствия цервикальной «хлыстовой» травмы [16].
Терапия ЧМТ в амбулаторной практике
В поликлинических условиях проводится терапия острого и промежуточного периодов легкой ЧМТ, а также курируются пациенты в отдаленном периоде ЧМТ любой степени тяжести.
Согласно клиническим рекомендациям Ассоциации нейрохирургов России (2016), при легких ЧМТ в остром и промежуточном (подостром) периодах применяют обезболивающие (НПВП), дегидратационные (Диакарб 250 мг один раз в день утром в течение пяти дней), противорвотные (например, метоклопрамид 10–20 мг/сут при необходимости); седативные (в частности, аминофенилмасляная кислота 750 мг/сут при необходимости), снотворные препараты [13]. Целесообразно также использование антихолинэстеразных препаратов в промежуточном периоде легкой ЧМТ (ипидакрин 20 мг три раза в день три-четыре недели) для профилактики и лечения ПКС. Важна коррекция эмоционально-личностных расстройств и нарушений сна.
Нейрометаболическую терапию назначают в любом периоде легкой ЧМТ, промежуточном (подостром) и отдаленном периодах ЧМТ средней и тяжелой степени. Применяют антиоксиданты, антигипоксанты, нейротрофические и ноотропные препараты (при ЧМТ следует выбирать ГАМКергические ноотропы, препараты холина альфосцерата).
Нейрометаболическая терапия направлена на активизацию восстановительных, репаративных процессов мозговой ткани, нейропластичности, нейрогенеза, а также на торможение вторичных деструктивных процессов в мозге. С этой точки зрения весьма перспективным представляется отечественный препарат Целлекс. Препарат производится из мозговой ткани эмбрионов свиней, находящихся на ранней стадии гестации, что определяет хорошую переносимость препарата, минимизацию побочных эффектов и аллергических реакций.
Целлекс представляет собой тканеспецифический высокомолекулярный белково-полипептидный комплекс с массой протеинов от 10 до 250 кДа и выраженным нейропротективным и нейрорепаративным действием. Эффекты Целлекса, обусловленные нормализацией белкового синтеза, восстановлением баланса нейротрансмиттеров, в частности возбуждающих аминокислот, реализуются за счет активации процессов синаптогенеза, восстановления сигналов аутофагии, нормализации тканевой иммунорегуляции, угнетения иммуногенной цитотоксичности макрофагов [17].
Целлекс содержит свыше 1200 сигнальных белков и регуляторных пептидов, включая факторы роста и дифференцировки нервных клеток и сосудов, оказывает как первичное, так и вторичное нейропротективное действие [18]. Первичное нейропротективное действие обусловлено регуляцией нейромедиации с торможением возбуждающих нейротрансмиттеров, прерыванием процесса апоптоза, уменьшением очага некроза мозговой ткани. Вторичное нейропротективное действие связано с регуляцией сигналов каспаз-зависимого и метаболического каскадов апоптоза, восстановлением энергетического метаболизма, белкового и нуклеотидного синтеза в условиях мозговой катастрофы, улучшением тканевой иммунорегуляции с торможением иммуногенной цитотоксичности макрофагов, активацией аутофагии (убиквитин-шаперонового каскада клиренса поврежденных молекул).
Кроме того, Целлекс оказывает нейрорепаративное действие, стимулируя миграцию стволовых клеток мозга и нейробластов к очагу повреждения, восстанавливая тем самым регенеративный потенциал клеток, активизируя процессы нейропластичности и синаптогенеза жизнеспособных нейронов [19].
Врачебной аудитории препарат Целлекс широко известен как препарат, эффективный при восстановлении утраченных или поврежденных функций после мозговых катастроф. Описано позитивное влияние препарата на восстановление когнитивных и речевых нарушений [20], двигательных функций [19], а также при дисфагии [21].
В российском многоцентровом сравнительном открытом клиническом исследовании оценивали эффективность Целлекса у пациентов в возрасте от 35 до 80 лет с ишемическим (82% пациентов) и геморрагическим (18% пациентов) инсультом. В результате четырехнедельной терапии среди 166 пациентов, завершивших исследование, в группе больных, получавших Целлекс, отмечалось достоверное улучшение исходов с регрессом двигательных, зрительных, речевых и чувствительных расстройств [22].
Использование препарата Целлекс (1 мл подкожно десять дней) в рамках комплексной реабилитации пациентов после мозговой катастрофы ассоциируется со значимым увеличением показателей восстановления неврологических функций (по индексу Бартел, шкале Линдмарка и Скандинавской шкале), уровня социально-бытовой адаптации (по шкале самооценки бытовых возможностей повседневной жизни Мертон и Саттон), а также нормализацией психоэмоционального состояния (по опроснику Бека и шкале самооценки депрессии Уэйкфилда) [23].
В многочисленных клинических исследованиях доказана эффективность препарата у больных с острым нарушением мозгового кровообращения в остром, подостром и восстановительном периодах. Показана его эффективность у пациентов в критическом состоянии при энцефалопатиях различного генеза (постгипоксической, дисметаболической, токсической) [24]. Целлекс демонстрирует хорошие результаты в активизации репаративных процессов, профилактике когнитивных и аффективных расстройств у пациентов, перенесших ЧМТ.
Учитывая определенную универсальность патологических процессов в мозге при острых нарушениях мозгового кровообращения и ЧМТ (наличие очага некроза, зоны возможной пластичности мозга, вторичной зоны замены утраченных функций, активизация «зеркальной» зоны в противоположном полушарии, активизация возбуждающих нейротрансмиттеров, распространение нейровоспаления, инициация апоптоза и др.), можно утверждать, что препарат с доказанной нейропротективной и нейрорепаративной активностью эффективен при восстановлении утраченных функций мозга как при остром нарушении мозгового кровообращения, так и при ЧМТ.
В 2016 г. завершилось исследование с участием 90 пациентов, перенесших острую ЧМТ. Они получали Целлекс 1,0 подкожно в течение десяти дней. Состояние когнитивных функций (Краткая шкала оценки психического статуса, МоСА-тест), выраженность депрессии (госпитальная шкала тревоги и депрессии HADS), характер ночного сна и степень независимости в повседневной жизни (индекс Бартел) оценивали до начала лечения, непосредственно после его окончания, через четыре и восемь недель после его окончания. На фоне применения препарата отмечались улучшение когнитивных функций, в частности способности к запоминанию и пространственно-зрительных функций, уменьшение значения индекса Бартел, регресс диссомнических нарушений. Положительный эффект регистрировался начиная с четвертой недели терапии, нарастал и достигал максимума к восьмой неделе лечения [25].
Заключение
Черепно-мозговые травмы представляют угрозу для жизни пациента. Кроме того, ЧМТ, в том числе легкой степени, опасны осложнениями и отдаленными последствиями, которые значительно снижают качество жизни, ограничивают трудоспособность и социальную адаптацию, способствуют инвалидизации.
С учетом того что первичная профилактика ЧМТ невозможна, крайне актуально грамотное лечение пациента в остром, промежуточном (подостром) и отдаленном периодах травмы. Важно адекватно оценивать тяжесть состояния больного, грамотно выстраивать терапевтическую тактику. Это позволит предупредить развитие вторичного повреждения мозга, избежать осложнений и отдаленных последствий.
Использование современных нейрометаболических препаратов (Целлекс), улучшающих нейропластичность и нейрорегенераторные возможности мозга, восстановление поврежденных функций мозга и обладающих нейромодулирующим и нейропротективным эффектами, позволяет врачам добиваться успеха в нейрореабилитации и минимизировать негативные прогнозы ЧМТ.
L.P. Sokolova, PhD, Prof.
N.I. Pirogov Russian National Research Medical University
Contact person: Lyubov P. Sokolova, lsocolova@yandex.ru
The article discusses the issues of diagnosis and conservative treatment of traumatic brain injury (TBI) at all its stages. The classification of TBI according to the severity of the condition and the risk of infection of intracranial contents is given, the periods of traumatic illness, mechanisms of brain damage, complications in the acute and intermediate periods, possible long-term consequences of TBI are described. The directions of therapy for the prevention of secondary brain damage, prevention of complications and long-term consequences are considered.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.