Гепатопротективная терапия жировой болезни печени неалкогольного и алкогольного генеза
- Аннотация
- Статья
- Ссылки
- English
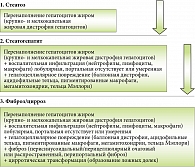











Жировая болезнь печени (ЖБП) – собирательный термин, объединяющий хронические заболевания печени c различной этиологией, но со схожими патофизиологическими механизмами, способствующими формированию гистопатологических изменений со стороны ткани печени – от накопления жира в гепатоцитах (стеатоза) до воспаления и фиброза разной степени (стеатогепатита и стеатофиброза) [1–3].
Еще в древние времена в странах с высоким уровнем развития культуры (Египте, Индии, Греции) было известно, что алкоголь негативно воздействует на печень. Но только во второй половине ХХ в. было установлено, что начальной стадией поражения печени, обусловленной приемом алкоголя, является накопление жира в гепатоцитах. Впоследствии на фоне регулярного употребления алкоголя и развития воспалительных реакций возникает алкогольный стеатогепатит (АСГ). В результате развивается алкогольный цирроз печени [2].
В 1980-х гг. было показано, что последовательность изменений – жировая инфильтрация → стеатогепатит → цирроз – нередко имеет место и в отсутствие систематического употребления алкоголя. Наиболее значимыми причинами ЖБП неалкогольного генеза становятся морбидное ожирение с нарушением толерантности к глюкозе и сахарный диабет.
В зависимости от этиологии различают [1, 2, 4]:
- алкогольную жировую инфильтрацию печени и жировую дистрофию печени с воспалением и повреждением – АСГ;
- неалкогольную жировую инфильтрацию печени и жировую дистрофию печени с воспалением и повреждением – неалкогольный стеатогепатит (НАСГ) (понятие «неалкогольный» означает, что количество употребляемого алкоголя у мужчин не превышает 30 г/сут, у женщин 20 г/сут).
Как показывает анализ данных литературы последних лет, ЖБП (не только алкогольной, но и неалкогольной этиологии) все чаще признают серьезной патологией, распространенной во всем мире, с возможной трансформацией в цирроз, печеночную недостаточность и печеночно-клеточную карциному (рис. 1) [3].
До 25% всех случаев хронических заболеваний печени связано с употреблением алкоголя. Между частотой развития цирроза у лиц, употребляющих алкоголь, и количественными показателями его приема существует линейная зависимость. При этом у женщин более низкая толерантность. Имеют значение и генетические различия активности ферментов, участвующих в метаболизме этанола [2, 3].
В экономически развитых странах распространенность жировой инфильтрации печени, не связанной с приемом алкоголя, соответствует частоте метаболического синдрома – 20–40% в общей популяции. Ведущую роль в развитии гормональных нарушений играет инсулинорезистентность с исходно повышенной секрецией инсулина. Причем развитию инсулинорезистентности способствуют не «классические» контринсулярные гормоны (например, глюкагон, глюкокортикостероиды, норадреналин), а протеогормоны, образующиеся в жировой ткани. Установлена четкая корреляция между индексом массы тела (ИМТ, кг/м2) и частотой жировой инфильтрации печени, не связанной с приемом алкоголя. Не последнюю роль играет висцеро-абдоминальный характер отложения жировой ткани [4–6].
В 8–10% случаев ЖБП развивается на фоне хронической интоксикации, обусловленной приемом психоактивных веществ и лекарственных препаратов, а также перманентным воздействием внешних факторов (воздух, питьевая вода, продукты питания, загрязненные органическими соединениями и тяжелыми металлами). Частота развития первичной ЖБП вследствие прямого влияния лекарственной терапии достигает 5%. К препаратам, используемым в режиме монотерапии и способным приводить к возникновению ЖБП, относятся ацетилсалициловая кислота, амиодарон, ко-тримоксазол, верапамил, ибупрофен, индометацин, кетоконазол, метилдопа, напроксен, нифедипин, парацетамол, преднизолон, рифампицин, тетрациклин. Риск развития ЖБП увеличивается при полифармакотерапии/полипрагмазии [1].
Патогенез жирового гепатоза печени алкогольной и неалкогольной этиологии
Основные компоненты гепатоцеллюлярных липидов представлены триглицеридами, субстратами для синтеза которых служат жирные кислоты и глицерофосфат.
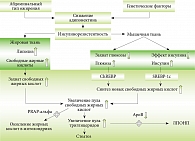
ЖБП как алкогольного, так и неалкогольного генеза характеризуется повышенным отложением триглицеридов в гепатоцитах вследствие избыточного поступления свободных жирных кислот (СЖК) в печень и/или их усиленного синтеза печенью из ацетил-коэнзима А (ацетил-КоА), особенно при избытке последнего. Продукция триглицеридов в гепатоците напрямую зависит от содержания в нем жирных кислот, ацетил-КоА и глюкозы, которая в процессе гликолиза превращается в фосфатидную кислоту, запускающую реакцию синтеза триглицеридов. По мере накопления жира гепатоциты становятся более уязвимыми и чувствительными к токсическому воздействию и утрачивают функциональные свойства [3, 4, 7].
Патофизиологические механизмы трансформации жировой дистрофии печени в стеатогепатит представлены в виде модели «двойного удара» [2]. Отложение липидов в печени – первый этап развития ЖБП (жировой гепатоз в чистом виде, «первый удар»), что впоследствии может приводить к развитию эффекта липотоксичности, инициации воспаления и прогрессированию заболевания (стеатогепатит, «второй удар»).
Главную роль в накоплении жира в гепатоцитах на фоне употребления алкоголя играет ацетальдегид – основной токсический продукт метаболизма этанола. В процессе окисления этанола отмечается повышенный расход кофермента никотинамидадениндинуклеотида (НАД+), который, присоединяя протон, восстанавливается до НАДН (НАДH+):
1) алкогольдегидрогеназа (цитозольный фермент желудка, печени) → этанол + НАД+ ацетальдегид + НАДН + Н+;
2) альдегиддегидрогеназа (внутримитохондриальный фермент печени) → ацетальдегид + НАД+ + КоА ацетил-КоА + НАДН + Н+.
Увеличение восстановленной формы НАД+Н при систематическом употреблении алкоголя снижает активность ферментов, обеспечивающих транспорт жирных кислот в митохондрии, уменьшает их внутримитохондриальное окисление, что приводит к выраженному нарушению метаболизма жиров, накоплению в клетках печени триглицеридов и развитию стеатоза. Стимуляция синтеза триглицеридов в печени происходит также за счет увеличения активности ацетил-КоА. В результате повреждения микротубулярных структур, обусловленного действием алкоголя, снижается секреция липопротеинов очень низкой плотности (ЛПОНП), которые выполняют функции транспортеров эндогенных липидов. Нарушения ультраструктуры митохондрий обусловливают недостаточное обеспечение гепатоцитов кислородом и уменьшение производства энергии ниже пределов, необходимых для нормальной жизнедеятельности печени (табл. 1).
Ацетальдегид вступает в химическую реакцию с антиоксидантами, выполняющими защитную функцию от свободных радикалов, образующихся в ответ на токсическое действие этанола. Таким образом гепатоциты лишаются противоокислительных свойств, что негативно сказывается на всех сферах метаболизма клеток и приводит к обширным повреждениям (окислительный стресс) [1–3].
При жировой инфильтрации, не связанной с приемом алкоголя, накопление триглицеридов обусловлено в основном избыточным питанием, инсулинорезистентностью и генетическими факторами [4].
Механизм накопления триглицеридов в гепатоцитах при жировой инфильтрации печени неалкогольного генеза связан с нарушением баланса жирных кислот в гепатоцитах. Но, как известно, баланс жирных кислот в печени зависит не только от метаболических процессов в ней, но и от ее взаимодействия с жировой тканью. Гиперинсулинемия вследствие инсулинорезистентности приводит к увеличению липогенеза de novo в печени и нарушает процессы ингибирования липолиза в жировой ткани. В результате возрастает отток СЖК из жировой ткани в печень. Избыточное усвоение СЖК из кровотока формирует субстрат для повышения синтеза триглицеридов в гепатоцитах. Одновременно с увеличением поступления жирных кислот в клетки в них (как ни парадоксально) при гиперинсулинемии увеличивается синтез новых жирных кислот из глюкозы. Изначально увеличению содержания СЖК в гепатоците противостоит их повышенное окисление в митохондриях и усиленное выделение в форме триглицеридов в ЛПОНП. Но при длительно выраженной гиперинсулинемии возникают метаболические и структурные нарушения внутриклеточных органелл, что приводит к уменьшению митохондриального окисления СЖК, повышенному разрушению ЛПОНП. В итоге возрастает пул триглицеридов в печени (рис. 2) [1–4].
Если причины первоначального накопления триглицеридов в гепатоцитах различны, то в развитии трансформации стеатоза в стеатогепатит с воспалением, гибелью клеток и фиброзом как при алкогольном, так и при неалкогольном генезе ведущую роль играют:
- реактивные кислородные радикалы и процессы перекисного окисления липидов;
- провоспалительные цитокины (включая фактор некроза опухоли альфа, интерлейкины 6 и 8, инициирующие воспалительные реакции, структурные изменения на субклеточном и клеточном уровнях, а также некроз гепатоцитов);
- активация профиброгенных факторов; генетические факторы.
Окислительное повреждение, приводящее к дисрегуляции апоптоза, – главный механизм развития стеатогепатита («второй удар»). Потенциальными источниками окислительного стресса служат митохондрии, микросомальный цитохром Р450, пероксисомы и избыточное поступление железа. Продукты перекисного окисления липидов, некроз гепатоцитов, провоспалительные цитокины являются активаторами звездчатых клеток. Их стимуляция сопровождается избыточной продукцией компонентов соединительной ткани с развитием перисинусоидального фиброза, а при длительном течении – цирроза печени и гепатоцеллюлярной карциномы.
Хотя нозологическая самостоятельность алкогольного и неалкогольного стеатоза сомнений не вызывает, следует учитывать, что этиология стеатогепатита может быть смешанной. Во-первых, пациенты с метаболическим синдромом и ожирением нередко употребляют алкоголь. Во-вторых, после первоначальной жировой инфильтрации печень становится чрезвычайно восприимчивой к воздействию повреждающих факторов (этанолу, окислительному стрессу, дисрегуляции апоптоза, бактериальному эндотоксикозу, активации звездчатых клеток). Именно поэтому на практике хроническое заболевание печени не всегда удается соотнести с конкретной причиной. Но сочетание факторов риска существенно сказывается на частоте обнаружения стеатоза и прогрессировании стеатогепатита в цирроз (табл. 2) [1, 2, 8].
Последующие этапы развития заболеваний печени и их интенсивность (фиброз, цирроз) зависят от продолжительности воздействия персистирующих факторов формирования стеатогепатита и отсутствия эффективной фармакотерапии (табл. 3).
Диагностика
Диагностика ЖБП вызывает определенные трудности, поскольку яркая симптоматика отсутствует. Больные жировой дистрофией печени и/или стеатогепатитом, как правило, не предъявляют никаких жалоб [5, 8].
Некоторые пациенты отмечают боль в области правого подреберья, что в большинстве случаев является следствием дисфункции желчного пузыря и образования в нем билиарного сладжа. Нарушение физико-химических свойств желчи при ЖБП связано с изменением функции гепатоцитов, что приводит к формированию неполноценных желчных мицелл с увеличением уровня холестерина и снижением содержания фосфолипидов и желчных кислот. В результате повышается литогенность желчи, возникает билиарный сладж, образуются холестериновые камни, развивается хронический холецистит. Нередко именно гепатобилиарная дисфункция определяет симптоматику неалкогольного или алкогольного стеатогепатита.
У 50–75% больных увеличена печень, в ряде случаев селезенка, но часто размеры печени трудно оценить из-за ожирения.
Проявления стеатогепатита неспецифичны и не коррелируют со степенью его активности.
Подозрение на неалкогольную жировую болезнь печени возникает при наличии других признаков метаболического синдрома (нарушение толерантности к глюкозе, ожирение висцерального типа в сочетании с дислипидемией). С учетом неярко выраженной клинической картины ЖБП для верификации заболевания целесообразно проводить ультрасонографическое исследование (точность – 80–85%). Трансабдоминальное ультразвуковое исследование (УЗИ) позволяет выявлять признаки жировой инфильтрации печени: значительное повышение эхогенности паренхимы, увеличение затухания эхосигнала, сглаженность сосудистого рисунка, гепатомегалию. Более специфические признаки, обнаруженные при компьютерной томографии, включают ослабление излучения при исследовании печени по сравнению с селезенкой (затухание «селезенка – печень» ≥ 10 по шкале Хаунсфилда).
Магнитно-резонансная спектроскопия – наиболее точный метод количественного определения стеатоза печени и в то же время наиболее затратный. Биопсия печени, проведение которой не всегда необходимо, является единственным тестом, позволяющим достоверно отличить стеатоз от стеатогепатита, и остается золотым стандартом оценки тяжести стеатоза и фиброза [2].
Вместе с тем в настоящее время из-за неопределенности в выборе диагностических тестов и методов лечения скрининг на ЖБП у взрослых пациентов с диабетом или ожирением, даже с высоким риском заболевания, на уровне врача первичного звена недостаточно обоснован.
Если стеатоз печени выявлен при инструментальном обследовании в отсутствие клинических или лабораторных признаков поражения печени, дальнейшее обследование и выполнение биопсии печени не рекомендуются [3, 5, 6].
Пациентам без предшествующего подозрения на стеатоз печени, если он был обнаружен в результате инструментального обследования, при наличии клинических или лабораторных признаков поражения печени проводится дифференциальный диагноз, прежде всего между стеатогепатитом алкогольного и неалкогольного генеза. У больных НАСГ часто выявляют нарушения липидного спектра, тогда как гипербилирубинемия, снижение протромбинового индекса и уровня альбумина наблюдаются редко. Поскольку злоупотребление алкоголем у таких пациентов должно быть исключено, в качестве дополнительной информации используют показатели высокого уровня гамма-глутамилтранспептидазы (ГГТП), ферритина, преобладание подъема уровня аспартатаминотрансферазы (АСТ) (табл. 4).
Цирроз печени с ЖБП обычно развивается бессимптомно на протяжении многих лет и проявляется только, когда у пациента развиваются признаки выраженного заболевания печени – желтуха и анасарка.
Лечение
Стандартного метода лечения заболеваний печени как на стадии стеатоза, так и на стадии стеатогепатита, основанного на доказательной базе, не существует. Поэтому основная цель терапии состоит в улучшении биохимических показателей, характеризующих воспаление и цитолиз, замедлении и блокировании фиброгенеза.
Если при алкогольной этиологии заболевания основная рекомендация – отказ от спиртного, то при НАСГ – коррекция метаболических нарушений (инсулинорезистентности, окислительного стресса, гиперлипидемии) [5, 6, 9].
Таким образом, задачами патогенетической гепатопротективной терапии при ЖБП являются:
- снижение накопления СЖК в печени;
- уменьшение окислительного стресса и защита органелл клетки;
- уменьшение фиброза;
- нормализация желчеобразования;
- снижение гиперлипидемии.
Лекарственные препараты, применяемые для лечения пациентов со стеатогепатитом, должны характеризоваться гепатопротекторным, антифибротическим, детоксикационным эффектами, способствовать нормализации желчеобразования и липидного обмена.
Многоцелевая терапия при ЖБП связана с гетерогенностью этиологических факторов, вовлеченностью множественных механизмов в развитие и поддержание воспалительных повреждений гепатоцитов и прогрессирование фиброгенеза.
Как известно, по сравнению с отдельным лекарственным веществом в высоких дозах комбинации растительных экстрактов позволяют достигать более выраженного эффекта. Кроме того, благодаря низким дозам отдельных компонентов риск побочных эффектов значительно снижен или полностью отсутствует. Такой подход предусмотрен современной концепцией многоцелевой терапии, которая признана обоснованной в лечении полиэтиологической ЖБП.
К числу препаратов, отвечающих требованиям многоцелевой терапии, относится комбинированный препарат растительного происхождения Орниксил (Новатор Фарма, Великобритания, производитель PRIMEA LIMITED, Великобритания). В его состав входят:
- экстракт расторопши пятнистой (Silybi mariani fructuum extract) – силимарин 70 мг со стандартизированным количеством флавоноида – силибинина, который оказывает гепатопротективное действие;
- экстракт артишока полевого (extractum foliorum Cynarae scomuli) 200 мг, нормализующего секрецию желчи и моторику желчевыводящих путей;
- орнитин – заменимая аминокислота, принимающая активное участие в метаболизме аммиака и его превращении в мочевину, а также в метаболизме глутамина.
От других фитофармацевтических препаратов Орниксил выгодно отличает внушительное доказательное досье – полученные в ходе проведенных экспериментальных и клинических исследований научные данные, подтверждающие гепатопротективную эффективность и безопасность всех его компонентов.
Силибинин (основная составляющая силимарина) обладает антиоксидантными свойствами, которые продемонстрированы как in vitro, так и in vivo. Антиоксидантная активность позволяет предотвращать разрушение клеточных мембран свободными радикалами. Сохранение митохондриальной мембраны приводит к увеличению содержания аденозинтрифосфата в клетке и ее большей устойчивости к повреждающим факторам.
Антиоксидантный эффект силимарина дополняется его противовоспалительным действием. Силибинин способен предотвращать активацию ядерных факторов воспаления, в основном транскрипционного фактора NF-kappa B, регулирующего продукцию провоспалительных интерлейкинов 1 и 6, контролирующего экспрессию генов иммунного ответа, апоптоза и клеточного цикла.
К настоящему времени антифибротическая способность силимарина дозозависимо блокировать накопление коллагена и проколлагена, а также факторов, стимулирующих фиброгенез (например, трансформирующего фактора роста бета), показана в ряде экспериментальных работ. Кроме того, силибинин индуцирует апоптоз активных звездчатых клеток и их трансформацию в миофибробласты, ответственные за развитие сначала фиброза, затем цирроза. Дополнительно силимарин прямо ингибирует коллагеназу и эластазу и стимулирует апоптоз уже активных миофибробластов.
Следовательно, силимарин, будучи антиоксидантом, стабилизатором клеточных мембран и иммуномодулятором, оказывает мощное противовоспалительное действие. Именно поэтому при алкогольных и неалкогольных поражениях печени силимарин назначают для коррекции функциональной активности гепатоцитов. Применение силимарина при ЖБП любой этиологии на стадии стеатоза и/или стеатогепатита приводит к улучшению самочувствия пациентов, стойкому снижению уровня трансаминаз, выраженности стеатоза, фиброза, гиперинсулинемии [10, 11].
Гепатопротекторное действие артишока посевного при ЖБП достигается за счет стимуляции желчеобразования и желчевыделения, что способствует снижению выраженности синдрома холестаза. Диуретический эффект артишока выражается в устранении задержки жидкости в организме. Инулин, входящий в состав артишока, служит питательной средой для размножения бифидо- и лактобактерий. Благодаря этому нормализуется количественный и качественный состав микрофлоры. Уменьшается доля условно патогенной и патогенной микрофлоры кишечника, которая продуцирует эндотоксин, играющий существенную роль в инициации стеатоза и прогрессировании стеатогепатита.
Основной механизм действия экзогенного орнитина заключается в восполнении внутриклеточных запасов этой аминокислоты, которая является метаболитом в цикле образования мочевины. Около 80% аммиака метаболизируется в орнитиновом цикле, протекающем в гепатоците. Этот механизм в основном и обусловливает клиническое применение орнитина, ведь именно интоксикация аммиаком считается если не единственным, то одним из главных патогенетических факторов печеночной энцефалопатии при циррозе и стеатогепатите [7]. Помимо этого орнитин играет важную роль в синтезе полиаминов (спермин, спермидин, путресцин) – биологически активных веществ, регулирующих синтез белка, рост и дифференциацию клеток, а также продукцию энергетических субстанций (никотинамидадениндинуклеотидфосфат). Описанные механизмы обусловливают гепатопротективный эффект (за счет увеличения энергетического резерва митохондрий гепатоцитов).
Таким образом, компоненты препарата Орниксил оказывают комплексное воздействие на печеночный метаболизм, способствуя уменьшению воспаления и восстановлению гепатоцитов, улучшению детоксикационной и белково-синтетической функций печени, ингибированию избыточного фиброгенеза, снижению частоты функциональных гепатобилиарных расстройств. Многогранное многоцелевое действие Орниксила обусловлено оптимально подобранным многокомпонентным составом.
Целью рандомизированного клинического исследования, проведенного на базе городских поликлиник, стало изучение эффективности и безопасности препарата Орниксил в лечении пациентов с неалкогольным и алкогольным стеатогепатитом.
Материал и методы исследования
Основные критерии оценки эффективности терапии:
- у пациентов со стеатогепатитом алкогольного генеза нормализация следующих показателей: активность АСТ, аланинаминотрансферазы (АЛТ), ГГТП, щелочной фосфатазы (ЩФ), соотношение АСT и АЛТ, средний объем эритроцитов, уровень сывороточного железа, общее количество лейкоцитов, содержание холестерина и триглицеридов сыворотки;
- у пациентов со стеатогепатитом неалкогольного генеза нормализация следующих показателей: активность АЛТ, АСT, ГГТП, ЩФ, уровни холестерина и триглицеридов сыворотки;
- улучшение самочувствия пациентов по субъективной оценке.
Дополнительные показатели эффективности:
- положительная динамика денсометрических показателей печени по данным УЗИ;
- положительная динамика сократительной функции желчного пузыря;
- нормализация ультразвуковых показателей внутрипросветной желчи (исчезновение признаков билиарного сладжа).
В исследование были включены 39 пациентов (26 женщин, 13 мужчин) c диагнозом «стеатогепатит неалкогольного и алкогольного генеза».
У всех больных проводились антропометрические исследования, определялись биохимические и общеклинические показатели крови, маркеры вирусных гепатитов, УЗИ органов брюшной полости. Для выявления хронической алкогольной интоксикации использовался опросник GAGE.
- Возникало ли у вас ощущение, что вам следует сократить употребление спиртных напитков?
- Вызывало ли у вас раздражение, если кто-то из окружающих (друзья, родственники) говорили вам о необходимости сократить употребление спиртных напитков?
- Испытывали ли вы чувство вины, связанное с употреблением спиртных напитков?
- Возникало ли у вас желание принять спиртное, как только вы просыпались после употребления алкогольных напитков?
Критерии отбора и включения в исследование:
1) для пациентов с НАСГ (первая группа):
- отсутствие указаний по поводу злоупотребления алкоголем (более 40 г чистого этанола в сутки);
- длительное и необъяснимое повышение активности АСТ и АЛТ;
- ИМТ более 25 кг/м2;
- повышение уровня триглицеридов в сыворотке крови (выше 1,7 ммоль/л);
- уменьшение содержания холестерина липопротеинов высокой плотности (ЛПВП) менее 1,0 ммоль/л;
- отсутствие стигм алкогольной болезни печени, аутоиммунных проявлений, печеночно-клеточной недостаточности и цирроза печени, наследственных метаболических расстройств, вирусных и аутоиммунных гепатитов, болезни Вильсона, гемохроматоза;
- признаки жировой дистрофии печени по данным УЗИ – гепатомегалия, дистальное затухание эхосигнала, диффузная гиперэхогенность паренхимы печени («яркая печень»), увеличение эхогенности печени по сравнению с почками, нечеткость сосудистого рисунка;
2) для пациентов с АСГ (вторая группа):
- указания в анамнезе на злоупотребление алкоголем (более 40 г чистого этанола в сутки) в течение последних трех – шести месяцев;
- положительные ответы на вопросы GAGE;
- повышение активности ГГТП, активности АСТ, превышающей таковую АЛТ;
- увеличение уровня лейкоцитов;
- увеличение содержания триглицеридов в сыворотке крови (выше 1,7 ммоль/л);
- снижение содержания холестерина ЛПВП менее 1,0 ммоль/л;
- признаки жировой дистрофии печени по данным УЗИ – гепатомегалия, дистальное затухание эхосигнала, диффузная гиперэхогенность паренхимы печени («яркая печень»), увеличение эхогенности печени по сравнению с почками, нечеткость сосудистого рисунка;
- отсутствие аутоиммунных заболеваний печени, печеночно-клеточной недостаточности и цирроза печени, наследственных метаболических расстройств, вирусных и аутоиммунных гепатитов, болезни Вильсона, гемохроматоза.
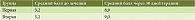
Все пациенты (n = 39), удовлетворявшие критериям включения, были разделены на две группы. Первую составили 28 пациентов с НАСГ (22 женщины, шесть мужчин), средний возраст – 45,5 ± 12,7 года, средний ИМТ – 27,5 кг/м2, соотношение мужчин и женщин – 1:36. Во вторую группу вошли 11 больных АСГ (четыре женщины, семь мужчин), средний возраст – 35,5 ± 12,5 года, ИМТ – 26,4 кг/м2.
Длительность алкогольного анамнеза в обеих группах в среднем составила 4,5–10 лет у мужчин, 1,5–5 лет у женщин. Ежедневная доза употребления алкоголя (этанола) соответствовала дозе Пенквино I (80–160 мл для мужчин, 60–110 мл для женщин). Соотношение больных НАСГ и больных АСГ – 2,5:1.
Пациенты обеих групп получали Орниксил по одной таблетке три раза в сутки наряду с рекомендацией придерживаться режима абстиненции и соблюдать диету. Клинические, биохимические и инструментальные параметры оценивали через четыре недели лечения.
У всех пациентов первой группы отмечалась избыточная масса тела. В общих анализах крови и мочи диагностически значимых изменений не выявлено, в то время как при биохимическом исследовании крови зафиксировано повышение уровней АСТ, АЛТ, ГГТП, ЩФ в пределах не выше трех норм. В липидном спектре крови обнаружено повышение уровня триглицеридов и снижение содержания ЛПВП. Данные трансабдоминального УЗИ показали у 75% пациентов увеличение печени, у 60,7% – снижение сократительной функции желчного пузыря, у 46,4% – формирование билиарного сладжа (табл. 5 и 6).
В отличие от пациентов первой группы (НАСГ) у пациентов второй (АСГ) выявлено более значительное повышение уровня трансаминаз (свыше четырех-пяти норм). При этом cоотношение АСT/АЛТ в среднем по группе составило 1,4. В группе АСТ отмечались и более высокие показатели маркеров холестаза. Отражением воспалительных изменений в печени является лейкоцитоз – среднее значение уровня лейкоцитов 12,7 ± 1,4 × 109. Данные трансабдоминального УЗИ у всех пациентов с АСГ показали увеличение печени, у 45,4% – формирование билиарного сладжа, у 63,7% – снижение сократительной функции желчного пузыря (табл. 5 и 6).
Во время первого визита чувство дискомфорта и/или боли в правом подреберье беспокоило 12 больных НАСГ. Причиной болевого синдрома, видимо, было нарушение сократительной функции желчного пузыря с формированием билиарного сладжа. Нарушение опорожнения кишечника отмечалось у 23 пациентов, у большинства (16 больных) преобладали запоры. По данным УЗИ, у всех пациентов с запорами зафиксировано снижение сократительной способности желчного пузыря при проведении функциональной пробы с желчегонным завтраком. Признаки желудочной диспепсии (тошнота, горечь во рту, чувство тяжести и переполнения в эпигастрии) и метеоризм имели место у большинства пациентов, включенных в исследование. Четыре пациента жаловались на слабость, утомляемость, снижение работоспособности (табл. 7).
Девять (81,2%) больных АСГ до лечения имели астеновегетативные симптомы, проявлявшиеся жалобами на слабость, нарушение настроения и сна. Все пациенты отмечали нарушение опорожнения кишечника (большинство (72,7%) по типу упорного запора), выраженный метеоризм – 81,2% больных, симптомы желудочной диспепсии – 90,9%. На боли в правом подреберье жаловались три пациента (табл. 7).
При сравнении клинических показателей между группами статистически достоверной разницы не установлено.
Результаты исследования и их обсуждение
На фоне терапии Орниксилом в течение 30 дней зарегистрированы достоверное улучшение показателей функционирования печени (АЛТ, АСТ, ГГТП, ЩФ), уменьшение системного воспаления, тенденция к снижению дислипидемии (уменьшение уровня триглицеридов и повышение уровня ЛПВП) (табл. 8 и 9).
100% пациентов с НАСГ и 77,8% больных АСГ, принимавших препарат Орниксил, отметили полное купирование симптомов астенического синдрома: улучшение настроения, нормализацию ночного сна, повышение трудоспособности. Ощущение дискомфорта и несильные эпизодические боли в правом подреберье по завершении зарегистрированы лишь у четырех (26,7%) пациентов. Боль полностью купирована у 73,3% больных. Все пациенты, предъявлявшие жалобы на запор на момент включения в исследование, на завершающем контрольном обследовании через 30 дней отмечали нормализацию частоты актов дефекации с выделением каловых масс нормальной формы без ощущения неполного опорожнения кишечника. Уменьшение вздутий живота имело место у 26 (68,4%) пациентов. Симптомы диспепсии (ощущение тяжести в подложечной области) исчезли у 16 (78,3%) больных. Отрыжка горечью купирована у 11 (52,4%) пациентов (табл. 10).
По окончании лечения улучшилась субъективная оценка самочувствия пациентами по визуальной аналоговой шкале (табл. 11).
Контрольное УЗИ печени не выявило существенного улучшения эхографической картины, а при определении функции желчного пузыря нормализация его моторики зафиксирована у 17 (70,8%) пациентов, исчезновение билиарного сладжа – у 10 (55,6%) (табл. 12).
Переносимость препарата была хорошей. Из побочных эффектов имело место лишь легкое послабление стула у трех больных, но это не помешало им завершить курс лечения. На течении сопутствующих заболеваний прием препарата не отразился.
Заключение
Орниксил, оказывающий комплексное воздействие за счет реализации многогранных лечебных эффектов, полностью отвечает требованиям современного подхода к коррекции проявлений нарушений функций печени, ассоциированных с ЖБП.
Фитофармацевтический препарат Орниксил, применяемый на фоне повышения активности АСТ/АЛТ при ЖБП как алкогольной, так и неалкогольной этиологии, демонстрирует положительный клинический эффект. Речь идет об улучшении самочувствия пациентов, нормализации биохимических показателей сыворотки крови, восстановлении функциональной активности желчного пузыря, отсутствии значимых нежелательных эффектов, предупреждении прогрессирования болезни.
Сказанное позволяет рекомендовать Орниксил как средство многоцелевого патогенетического воздействия при ЖБП любой этиологии.
Привлекательным для клиницистов является возможность длительного использования Орниксила в лечебных и профилактических целях ввиду отсутствия эффектов кумуляции, накопления и побочного действия.
L.I. Butorova, M.A. Kalashnikova, N.G. Kraynikova, M.A. Osadchuk, T.E. Plavnik, G.M. Tokmulina
I.M. Sechenov First Moscow State Medical University
Joint Hospital and Polyclinic of the RF President Administration
Central Clinical Hospital Rehabilitation, Russian Federal Medical and Biological Agency
Moscow City Polyclinic № 195
Contact person: Lyudmila Ivanovna Butorova, ludmilabutorova@mail.ru
Here we discuss pathogenesis and opportunities of medical therapy of fatty liver disease. We present the data from the open non-comparative study with 39 patients suffering from alcoholic and non-alcoholic steatohepatitis, and demonstrate that Orniksil exhibited high efficacy, safety and good tolerability.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.