Гигиена рук в клинической практике
- Аннотация
- Статья
- Ссылки
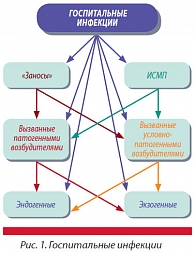




«Госпитальная инфекция» – более емкий термин, который охватывает большое количество разных инфекций, ранжируемых по причине, следствию и механизму возникновения (рис. 1). Основная дифференциация в лечебном учреждении проводится между ИСМП и инфекциями, которые относятся к «заносам», – больной поступает в стационар, будучи инфицированным, например, вирусным гепатитом B или C. Или же в кишечнике у пациента имеется полирезистентная ко всем антимикробным препаратам синегнойная палочка (Pseudomonas aeruginosa), но он не заболевает до тех пор, пока ему не выполнена операция в области брюшной полости. Если же у человека не было неблагоприятного преморбидного фона на момент поступления в стационар, то инфекции, атакующие его в процессе оказания медицинской помощи, относят к ИСМП.
По этиологии все госпитальные инфекции делятся на те, которые вызывают патогенные возбудители, приводящие к развитию у человека традиционных инфекционных заболеваний (сальмонеллез, дизентерия, туберкулез и т.д.; механизмы их развития ничем не отличаются от таковых вне ЛПУ), и вызванные условно-патогенными (оппортунистическими) возбудителями, которые относятся к нормальной микрофлоре кожи и слизистой (стафилококки, клебсиелла, протей, энтерококки и др.) – наибольшую актуальность сейчас приобретают инфекции, вызванные Pseudomonas aeruginosa и Acinetobacter baumannii.
По пути инфицирования инфекции подразделяются на эндогенные и экзогенные. Первые возникают в результате проникновения нормальной микрофлоры с кожи и слизистых в изначально стерильный организм. В основном они связаны с инвазивными медицинскими вмешательствами, когда условно-патогенные микроорганизмы попадают по раневому каналу в различные полости (брюшная, средостение, синусы и т.п.) или сосудистое русло. Экзогенные инфекции – те, которые больной получает от окружающих (пациентов, а также медперсонала в процессе ухода и выполнения тех или иных медицинских вмешательств).
Статистические данные
Считается, что примерно 1,5 млн человек во всем мире страдают ИСМП. В странах Евросоюза этой проблемой ежегодно обусловлено дополнительно 25 млн дней госпитализации. Дополнительные расходы на лечение этой группы больных составляют 13–24 млрд евро. Это большой экономический ущерб. В нашей стране нет статистики, которая бы характеризовала возникающие затраты на ИСМП. В РФ количество официально регистрируемых ИСМП довольно стабильно на протяжении последних 10 лет: 25–27 тыс. случаев на всю страну (приблизительно 0,8 на 1 тыс. пациентов). Однако эксперты считают, что фактическое их число гораздо больше.
Наибольшее количество случаев ИСМП регистрируется в родильных домах – 34%. В хирургических отделениях их 32%, в детских медучреждениях – 11%, в амбулаторных медучреждениях – 6%, 17% приходится на прочие ЛПУ. На первом месте по распространенности – инфекции в области хирургического вмешательства (25%), большой процент составляют гнойно-септические инфекции (ГСИ) новорожденных и родильниц (18 и 14% соответственно), 10% – постинъекционные инфекции. Правда, следует отметить, что эти цифры тоже не совсем соответствуют реальности.
Эпидемиологический процесс
Единицей наблюдения для клинициста является конкретный пациент. А эпидемиолог анализирует в целом ситуацию в каждом отделении, в котором складываются свои индивидуальные микробиологические особенности, характеризующиеся циркуляцией тех или иных укоренившихся патогенов. Достичь абсолютного отсутствия инфекций при оказании медицинской помощи невозможно. Жизнедеятельность паразитарной системы «человек – патоген» в госпитальных условиях определена особенностями лечебно-диагностического процесса, и ее большая часть скрыта от непосредственного наблюдения. Среди микробов встречаются как авирулентные, так и очень вирулентные штаммы, как малоинвазивные представители одного и того же вида и рода, так и чрезвычайно инвазивные, как чувствительные культуры тех или иных представителей, так и панрезистентные. Микроорганизмы, как и все живое, всегда стремятся к самосохранению и размножению, вырабатывая резистентность к антимикробным средствам (антибиотикам, антисептикам, дезинфектантам и т.п.).
Любое инфицирование (нагноившийся шов, перитонит, катетер-ассоциированный сепсис и др.) всегда предполагает какой-либо путь передачи инфекции. Если это случилось, значит, где-то рядом находится источник инфекции. Большую роль при инфицировании играет восприимчивость организма. Путь передачи инфекции, источник инфекции, восприимчивый организм – это звенья любого эпидемиологического процесса. Особенность развития экзогенных ИСМП, вызванных оппортунистическими патогенами, состоит в том, что связующим звеном между источником инфекции и восприимчивым организмом являются руки медицинских работников. Ни клебсиеллы, ни протей, ни кишечная палочка не способны транспортироваться по воздуху. Они из организма – источника инфекции (больного или носителя) попадают на руки медработника и переносятся в другой организм при контакте с ним. Это основа теории госпитальных инфекций, что подтверждено большим количеством различных научных данных.
В 1989 г. вышла монография «Эпидемиология внутрибольничных инфекций» отечественных исследователей Р.Х. Яфаева и Л.П. Зуевой, в которой описано масштабное исследование, наглядно демонстрирующее, как именно инфекция в хирургическом стационаре передается руками медицинских работников. В том числе был проделан простой опыт. Синегнойный бактериофаг (он определяется исключительно там, где обитает синегнойная палочка) был умышленно запущен специалистами в перевязочной в открытую промывную систему (в те годы существовали именно такие конструкции). Спустя 2 часа были взяты смывы в этом помещении: в 7 из 11 случаев в них был обнаружен этот бактериофаг. Он обитал на руках медицинской сестры, на корнцанге, извлеченном из тройного раствора, а через 2 часа уже обнаружился в смывах с различных поверхностей не только в перевязочной, но и в палате, в которой находился пациент. Так осуществляется круговорот микробов между персоналом, окружающей средой и пациентами.
Врач должен придавать особое значение обследованию пациентов при поступлении в стационар и, выявив инфекционное заболевание, немедленно изолировать больного. Антибактериальные препараты должны применяться не только для лечения пациента, но и для эрадикации возбудителей из ран и, соответственно, санации источника инфекции. При грамотном подходе рациональная антимикробная терапия обладает огромным санирующим потенциалом. Такую трудоемкую работу, как дезинфекция и стерилизация, сложно выполнять без ошибок. Одним из наиболее эффективных способов прерывания этой цепи неблагоприятных событий является антисептика рук медперсонала.
Каждого пациента в стационаре мы рассматриваем как потенциальный источник инфекции для других пациентов потому, что любой человек обладает своим уникальным и постоянным набором микрофлоры. И, соответственно, каждый пациент нуждается в защите от нормальной микрофлоры других пациентов. В отделении всегда находится большое количество пациентов на различных этапах оказания медпомощи. Смешение постоянного состава медицинских работников и постоянного поступления «свежих» пациентов всегда формирует потенциальную готовность к развитию эпидемической вспышки.
Основные принципы борьбы с ИСМП
Явление, которое сейчас беспокоит большое количество специалистов, – резистентность к антимикробным препаратам. Дезинфектанты могут потенциально войти в число тех химических структур, к которым тоже может формироваться резистентность. Поэтому антисептики для обработки рук должны использоваться в соответствии с определенными правилами. И если мы хотим получить профилактический эффект, то количество этих процедур должно достигать определенного максимума.
Исследования показали: ожидать качественной профилактики ИСМП можно только тогда, когда правила гигиены рук будут соблюдаться не менее чем в 90% случаев из 100%. Например, если к пациенту в течение суток 100 раз подходят различные медработники – санитарки, медсестры, консультанты и т.п., то в 90 случаях необходимо, чтобы их руки были обработаны правильно. Тогда мы его защитим от передачи инфекции. Если руки будут обрабатываться в 20% случаев, то это будет означать, что профилактики роста инфекции внутри отделения не ведется. Эта закономерность очень хорошо понятна эпидемиологам на примере вакцинации: чтобы вакцины защитили общество, нужно, чтобы было привито 90% населения, относящегося к группам риска. Иначе будут болеть и привитые, и непривитые. Когда врач сталкивается со случаем тяжелой ГСИ (например, перитонит или сепсис) без отклика на антимикробную терапию, вызванную полирезистентной клебсиеллой или псевдомонадой, то неблагоприятный исход зачастую неизбежен. Ведь помочь такому пациенту специалист бессилен.
А почему это происходит? Резистентные микробы появляются путем передачи внутри вида и между родами различных внутриклеточных детерминант, которые несут свойство резистентности. Это может произойти, если ранее микроорганизмы пациента встретились в организме другого больного и обменялись генами резистентности. Инфекции, вызванные микст-возбудителями (несколькими представителями), в плане прогноза роста антибиотикорезистентности очень опасны. Поэтому необходимо блокировать вынос патогенов за пределы территории пребывания одного больного и предотвратить их встречу в организме другого больного.
Врачу важно четко представлять, каким образом должен быть организован инфекционный контроль в отделении в целом. Всех пациентов, имеющих подтвержденную инфекцию, вызванную полирезистентными или панрезистентными возбудителями, следует изолировать. Идеальная ситуация, когда в отделении можно организовать такую модель ухода за тяжелобольным: один бокс – одна медсестра – один пациент. Если это невозможно, следует применять контактную изоляцию. Главное в этом случае – должным образом обрабатывать руки медперсонала и правильно использовать комплекты соответствующей защитной одежды. Если перед тем, как подойти к пациенту, хорошо обработать руки, это защитит его от тех микробов, которые есть на предметах внешней среды и других пациентах. Если не обработать руки после того, как происходил контакт с больным, то патогены попадут за пределы территории, на которой он находится.
В клинической практике существует еще одна проблема: антимикробная терапия без доказательств присутствия инфекции (с целью профилактики). В этом случае, если прием препаратов (цефалоспоринов III поколения) не ограничивается одним днем, происходит селективное подавление чувствительной условно-патогенной микрофлоры. Результат – возникновение панрезистентных патогенов и рост числа инфекций без возможности их медикаментозно контролировать. Таким образом, если не выявлено наличие конкретной инфекции, назначение в наших стационарах антибиотиков вредно. Почему-то нередко врачи забывают, что курсы антимикробной терапии не защищают пациента от инфицирования. Ведь, с одной стороны, мы создаем барьеры на пути микробов, с другой – подавляем чувствительную конкурентную микрофлору, что приводит к росту количества панрезистентных патогенов, которые начинают циркулировать внутри отделения. Это порочный круг.
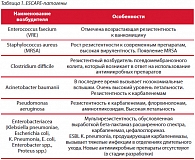
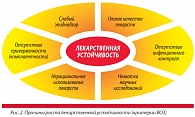
ВОЗ обратила самое серьезное внимание на данную проблему и предложила девиз одного из Дней здоровья: «Если сегодня не принять меры, завтра мы останемся без лекарств» (рис. 2). Прежде всего необходимо прекратить фанатичную борьбу с микробами. Победить их невозможно. Где есть живой человек, там всегда будут микробы. Даже руки хирурга никогда не бывают стерильными, поскольку в глубоких слоях кожи всегда будут обитать стафилококки. Задача состоит не в борьбе с микробами, а в управлении существующими рисками. Самую серьезную опасность, по мнению американских исследователей, сейчас представляют ESCAPE-патогены («ускользающие» от специфической терапии) (табл. 1). Данные микробы приобрели гены резистентности, фиксированные на плазмидах. Эти гены кодируют выработку в микробной клетке бета-лактамаз расширенного действия. Это обстоятельство делает абсолютно бессмысленной терапию бета-лактамными антибиотиками (всеми, кроме карбапенемов).
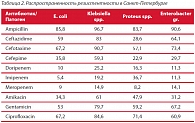
Более того, сейчас возникла другая проблема: большое количество представителей семейства Enterobacteriacea вырабатывает и ферменты, которые разлагают все без исключения бета-лактамы. Микробиологи в последнее время все чаще выделяют патогены, которые в 100% случаев резистентны к карбапенемам. И у нас практически не остается ресурсов в виде антибактериальной терапии для того, чтобы справиться с этой проблемой. Согласно статистике, самое большое количество этих патогенов выявлено в Латинской Америке. Россия до сих пор не провела собственного мониторинга. Среди всех городов только Санкт-Петербург имеет внутригородскую систему контроля за распространением антибиотикорезистентных патогенов (табл. 2).
Что необходимо постоянно отслеживать врачам в отделении? Важно знать частоту ассоциированной устойчивости метициллин-резистентного Staphylococcus aureus (MRSA). Когда она достигает 80%, то препарат стартовой эмпирической терапии – ванкомицин. Если назначить препарат более низкого класса, то в отделении может возникнуть неблагоприятная эпидемиологическая ситуация: пациент станет источником распространения инфекции. Если частота ассоциированной устойчивости MRSA меньше, то можно использовать ресурсы цефалоспоринов III поколения. Следующий критерий, который важно отслеживать, – уровень продукции бета-лактамаз расширенного спектра (ESBL) среди представителей семейства Enterobacteriacea.
Гигиена рук при медицинских вмешательствах
Между благоприятным исходом лечения пациентов и гигиеной рук медицинских работников существует доказанная связь. Чем лучше качество гигиены рук, тем большему количеству пациентов вы можете эффективно помочь. Считается, что 40% случаев инфекции можно предупредить, если в отделении соблюдаются правила гигиены рук. Любопытна статистика относительно числа микроорганизмов на руках/перчатках после выполнения типичных медицинских вмешательств: обработка пролежня – 106–108 КОЕ, смена назогастрального зонда – 103–106 КОЕ, обработка перианальной области – 108–1010 КОЕ, санация трахеи – 106–108 КОЕ, опорожнение емкости с мочой – 106–108 КОЕ, прикосновение к коже во время осмотра – 103–104 КОЕ. Было подсчитано, что при обработке рук в 33% случаев (если в среднем с 12 пациентами в реанимационном отделении происходит 30–40 контактов в сутки) огромное количество микробов (800 тыс. КОЕ – на руках врачей, 1,6 трлн КОЕ – на руках медсестер) ежесуточно перемещается между пациентами.
Необходимо учитывать, что у медицинских работников, как у всех людей, существует большая дистанция между знаниями (убеждениями) и поведением. Испытывая большое психоэмоциональное напряжение, медицинские работники тоже устают и ошибаются. Проведенный в Швейцарии опрос, касающийся гигиены рук, продемонстрировал: 85% опрошенных медработников осознают, что несоблюдение гигиены рук может привести к передаче инфекции; 65% указывают, что гигиена – важная мера безопасности, чтобы защитить себя и других; 74% хотят измениться к лучшему; 77% респондентов могут вспомнить о случаях, когда целенаправленно не выполняли правила гигиены рук; 67% указывают на трудности перехода от знаний к их практическому использованию.
Причинами несоблюдения правил гигиены являются прежде всего высокая нагрузка, дефицит кадров, нежелательное раздражение кожи и упрямство. Целями гигиены рук являются удаление загрязнений и уменьшение числа микробов на коже рук до безопасного количества. Базовые условия:
- • здоровая кожа, отсутствие украшений, длина ногтей – 0,2–0,5 см;
- • показания для гигиенической и хирургической обработки рук (с использованием мыла и воды);
- • соблюдение технологии обработки рук («препарат – объем – время»);
- • совмещение гигиены рук с использованием защитных перчаток;
- • уход за кожей рук – основа здоровой кожи.
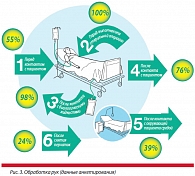
Согласно данным анкетирования нейрохирургов и среднего медперсонала, прибывших в Москву для повышения квалификации из различных регионов РФ, не желают расставаться ни с украшениями (45%), ни с длинными ногтями (53%) в основном медицинские сестры. Врачи в этом отношении более сознательны: 24% и 17% соответственно. По поводу показаний для обработки рук 93 опрошенных хирурга ответили следующим образом: 100% всегда будут обрабатывать руки перед любой стерильной манипуляцией, 98% – после контакта с биологическими жидкостями, 76% – после контакта с больным, 55% – перед контактом с пациентом, только 39% – после контакта с окружающей пациента средой (посещения палаты), и лишь около четверти опрошенных считают, что руки необходимо обрабатывать после снятия перчаток (рис. 3).
Относительно соблюдения технологии обработки рук («препарат – объем – время»): для получения эффективного результата достаточно 30 секунд и 2 мм качественного препарата. Согласно рекомендациям ВОЗ, концентрация изопропилового спирта (если в составе кожного антисептика он используется в качестве основного действующего вещества) должна составлять не менее 60%. Концентрация смесей разных спиртов (этилового, изопропилового, пропилового) в композиционных средствах должна достигать 60–70%. Только это позволяет умертвить патогенные микроорганизмы.
Аналогичные указания имеются и в методических рекомендациях по выбору химических дезинфицирующих и стерилизующих средств для применения в организациях, осуществляющих медицинскую деятельность, которые в виде проекта подготовлены НИИ дезинфектологии в 2011 г. (пока не утвержден). Таким образом, у нас нет законодательно утвержденной нижней границы содержания алкоголя в препарате для антисептики рук. На российском рынке присутствует большое количество препаратов, которые вообще его не содержат и все же разрешены для дезинфекции рук медперсонала. Они, на мой взгляд, могут использоваться – в быту, коммунальном хозяйстве, но не в госпитальной практике.
На сайте Национальной системы здравоохранения Англии указано, что английские медработники должны предпринимать для контроля мультирезистентных патогенов. Предлагается изолировать такого больного и осуществлять гигиену рук до и после каждого контакта с ним. Для того чтобы обеззараживать руки, рекомендуется используют антисептик с 70-процентным содержанием алкоголя. Для дезинфекции окружающей среды используются только препараты хлора. Объем антисептика должен быть небольшим. Что касается высушивания рук, то врачи делают это не очень тщательно из-за спешки. Но если на влажные руки надеть латексные перчатки, то резко возрастает угроза возникновения воспаления кожи.
Когда обрабатывать руки и перчатки и чем именно? В руководстве Центра по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention (CDC)) это четко расписано (табл. 3). До и после контакта с пациентом всегда применяется антисептик на основе алкоголя, а использование перчаток будет зависеть от того, что мы делаем. Если происходит контакт с пациентом, включающий асептическую процедуру, то всегда должны использоваться стерильные перчатки. Постановка мочевого катетера – это асептическая процедура, потому что мы проникаем в стерильную полость организма. Медицинские сестры тоже должны надевать стерильные перчатки и выполнять эту манипуляцию с участием ассистента (одному человеку технически сложно ввести катетер с соблюдением стерильности).
Контакт с кровью и биологическими жидкостями пациента всегда предполагает использование перчаток, чтобы защитить себя. Но при этом перчатки могут быть нестерильными. Контакт с неповрежденной кожей и окружающими больного предметами может осуществляться без перчаток. Но если пациент инфицирован, то мы можем надеть перчатки. К сожалению, по статистике, обрабатывают руки после снятия перчаток только четверть хирургов. 13% хирургов и вовсе считают, что перчатки являются альтернативой гигиены рук. Между тем доказано, что все перчатки проницаемы. Пока нет ни одной модели перчаток, которые не были бы непроницаемыми. Поэтому компании, производящие эту продукцию, делают двойные перчатки, с индикацией прокола и т.п.
Следует помнить, что перчатки никогда не обрабатываются спиртами. Они стерильными надеваются, в них выполняются манипуляции, и их снимают сразу после процедуры. Обрабатывать спиртами их бессмысленно, поскольку их проницаемость от этого лишь увеличится, а защитные свойства не повысятся. Обрабатывать спиртами необходимо руки. В каждом отделении нужно иметь алгоритмы/стандарты (протоколы) всех эпидемиологически значимых лечебных и диагностических манипуляций, включающие в себя средства и способы обработки рук при выполнении соответствующих мероприятий. Многие вмешательства требуют обработки рук от 3 до 4 раз во время одной процедуры (включая смену защитных перчаток).
Уход за кожей рук способствует сохранению ее здоровья, но хирурги уделяют этому мало внимания. Что необходимо для повышения комплаентности медицинских работников? Это легкий способ использования средств гигиены, положительное отношение руководителя к этой системе, контроль за соблюдением этих норм со стороны заведующих отделениями, осознание, что за работой наблюдают (видеомониторинг), желание стать образцом для подражания и пример старших наставников.
По мнению ВОЗ, анализ масштабных образовательных кампаний, касающихся соблюдения гигиены рук, свидетельствует, что эта стратегия будет экономически выгодной, даже если количество ИСМП уменьшится на 0,1%. Можно сделать вывод, что соблюдение правил гигиены спасает жизни, кошельки, а также репутацию врача. Поэтому обработка рук должна быть частью его профессиональной практики. И соблюдать эти правила важно не потому, что может оштрафовать эпидемиолог, а потому, что именно эта тактика гарантирует благоприятный исход лечения пациентов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.