Эффективность применения вагинального геля с маслом чайного дерева после лечения бактериального вагиноза
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В многоцентровом проспективном рандомизированном контролируемом исследовании участвовали 41 пациентка после лечения БВ и 25 здоровых женщин. Все участницы исследования получали рекомендации по интимной гигиене с использованием специальных моющих средств. Кроме того, все здоровые женщины и 20 пациенток с БВ в анамнезе дополнительно ежедневно использовали вагинальный гель (ВГ) восстанавливающий с маслом чайного дерева в течение 4–6 недель. При включении в исследование и через 4–6 недель оценивали жалобы, уровень рН и лактобактериальный профиль (ЛБП).
Результаты. Каждая третья женщина независимо от наличия БВ в анамнезе предъявляла жалобы на сухость в области наружных половых органов, дискомфорт, жжение и/или зуд, боль или дискомфорт во время половой активности, которые были связаны с недостаточным количеством смазки и почти полностью редуцировались в течение недели применения ВГ и специальных моющих средств для интимной гигиены. Интимная гигиена без ВГ оказалась менее эффективной. Применение геля способствовало поддержанию нормального уровня рН во влагалище здоровых женщин и не влияло на его восстановление после лечения БВ, что коррелировало с изменениями ЛБП. После использования геля доля лактобактерий в вагинальной микробиоте здоровых женщин оставалась неизменной, а у пациенток после лечения БВ – значительно увеличилась (р < 0,05). ЛБП изменялся в течение 4–6 недель из дисбиоза с доминированием Lactobacillus iners в промежуточный тип с доминированием L. jensenii и L. gasseri. Рецидивов БВ не наблюдалось.
Заключение. Соблюдение рекомендаций по соответствующей интимной гигиене с применением ВГ с маслом чайного дерева не только создает комфорт в области наружных половых органов, но и препятствует развитию рецидивов БВ. Использование ВГ после лечения БВ способствует увеличению доли лактобактерий в вагинальной микробиоте и изменению их видового состава от характерного для дисбиоза к промежуточному типу.
Материал и методы. В многоцентровом проспективном рандомизированном контролируемом исследовании участвовали 41 пациентка после лечения БВ и 25 здоровых женщин. Все участницы исследования получали рекомендации по интимной гигиене с использованием специальных моющих средств. Кроме того, все здоровые женщины и 20 пациенток с БВ в анамнезе дополнительно ежедневно использовали вагинальный гель (ВГ) восстанавливающий с маслом чайного дерева в течение 4–6 недель. При включении в исследование и через 4–6 недель оценивали жалобы, уровень рН и лактобактериальный профиль (ЛБП).
Результаты. Каждая третья женщина независимо от наличия БВ в анамнезе предъявляла жалобы на сухость в области наружных половых органов, дискомфорт, жжение и/или зуд, боль или дискомфорт во время половой активности, которые были связаны с недостаточным количеством смазки и почти полностью редуцировались в течение недели применения ВГ и специальных моющих средств для интимной гигиены. Интимная гигиена без ВГ оказалась менее эффективной. Применение геля способствовало поддержанию нормального уровня рН во влагалище здоровых женщин и не влияло на его восстановление после лечения БВ, что коррелировало с изменениями ЛБП. После использования геля доля лактобактерий в вагинальной микробиоте здоровых женщин оставалась неизменной, а у пациенток после лечения БВ – значительно увеличилась (р < 0,05). ЛБП изменялся в течение 4–6 недель из дисбиоза с доминированием Lactobacillus iners в промежуточный тип с доминированием L. jensenii и L. gasseri. Рецидивов БВ не наблюдалось.
Заключение. Соблюдение рекомендаций по соответствующей интимной гигиене с применением ВГ с маслом чайного дерева не только создает комфорт в области наружных половых органов, но и препятствует развитию рецидивов БВ. Использование ВГ после лечения БВ способствует увеличению доли лактобактерий в вагинальной микробиоте и изменению их видового состава от характерного для дисбиоза к промежуточному типу.


Актуальность
Бактериальный вагиноз (БВ) является наиболее распространенной причиной патологических вагинальных выделений. Он характеризуется дисбиозом во влагалище – снижением уровня лактобактерий, продуцирующих молочную кислоту, и значительным увеличением количества факультативной и строгой анаэробной микрофлоры [1–3]. Несмотря на многолетнюю историю изучения, этиология и патогенез БВ остаются не до конца понятными. Проводимое лечение ассоциируется с высокой частотой рецидивов.
Хорошо известно, что лактобактерии обеспечивают постоянство среды во влагалище. Они поддерживают низкий уровень рН за счет преобразования гликогена из вагинального эпителия в молочную кислоту, синтезируют перекись водорода и бактериоцины, модулируют иммунную реакцию хозяина (локальный синтез цитокинов, лизоцима, антител) и конкурентно устраняют патогенные микроорганизмы. Но особенности распространения и индивидуальная роль разных видов лактобактерий в поддержании здоровья влагалищной экосистемы остаются предметом исследований. Сравнительный анализ наиболее часто встречающихся Lactobacillus crispatus, L. iners, L. jensenii, L. gasseri в вагинальных мазках выявил четкую тенденцию доминирования L. crispatus у здоровых женщин и L. iners – у пациенток с БВ [3, 4]. Хотя результаты проведенных нами исследований [4, 5] также показали значительное разнообразие в количественном и качественном составе лактобактерий как у здоровых женщин, так и у пациенток с БВ, что подчеркивает сложность и вариабельность реакции вагинальной микробиоты на изменяющиеся внешние и внутренние факторы. Подтверждение тому – большой опыт применения вагинальных пробиотиков при БВ, который, несмотря на обнадеживающие результаты ряда исследований, в целом не привел к снижению рецидивов заболевания [6]. Более того, в последние годы вагинальный эубиоз стал рассматриваться как присутствие во влагалище полезной микробиоты, продуцирующей молочную кислоту, преимущественно, но не исключительно из рода Lactobacillus [7].
В качестве метода снижения частоты рецидивов БВ практиковалось создание кислой среды во влагалище с помощью вагинальных гелей (ВГ) и таблеток с низким уровнем рН [8, 9]. Но результаты оказались противоречивы. Это вполне объяснимо, поскольку нарушает причинно-следственные связи: не кислая среда обеспечивает рост лактобактерий, а лактобактерии создают вокруг себя кислую среду, расщепляя гликоген из клеток вагинального эпителия с образованием молочной кислоты. Следует учитывать и возможность повреждения вагинального эпителия с развитием цитолитического вагиноза при чрезмерном снижении уровня рН [10, 11].
Кроме того, важно понимать, что лактобактерии – это часть слизисто-эпителиального барьера влагалища. Здоровый вагинальный эпителий не только содержит необходимый для питания лактобактерий гликоген, но и создает для них микроокружение – секретом, богатый медиаторами врожденного и приобретенного иммунитета, создающий необходимый защитный барьер от разрушающего воздействия патогенных микроорганизмов [12]. В норме вагинальный секретом содержит компоненты плазмы крови (альбумины, иммуноглобулины, углеводы, жирные кислоты), иммунные клетки, а также лизоцим и муцин, препятствуя адгезии микробов к эпителию влагалища и развитию инфекционно-воспалительного процесса.
Именно с разрушения защитного слоя слизи начинаются адгезия Gardnerella vaginalis, Prevotella bivia, Atopobium vaginae и других микроорганизмов, ассоциированных с БВ, на эпителиальных клетках стенки влагалища, замещение ими лактобактерий и образование полимикробных биопленок [13]. В составе биопленок патогенные бактерии становятся значительно устойчивее к противомикробным препаратам, что способствует рецидивирующему течению БВ [14, 15]. Под влиянием вырабатываемого БВ-ассоциированными бактериями фермента сиалидазы разрушается слизисто-эпителиальный слой и появляются характерные выделения жидкой консистенции [16, 17], а продуцируемые ими биогенные амины становятся причиной неприятного запаха, внося также вклад в повышение уровня рН вагинальной среды [18]. Появление большого количества патогенных микроорганизмов стимулирует иммунную реакцию организма с локальной выработкой цитокинов и альфа-дефензинов, что повышает риск восходящего инфицирования с развитием воспалительных заболеваний органов малого таза (ВЗОМТ), а у беременных является причиной преждевременных родов.
Недооценка роли секретома вагинального эпителия, в составе которого осуществляют свою жизнедеятельность лактобактерии, и сосредоточение исключительно на микробной составляющей с поиском новых, более эффективных антибактериальных и пробиотических средств не только не предотвращают, но иногда провоцируют развитие вагинального дисбиоза.
Одним из факторов риска рецидива БВ может быть чрезмерная или неадекватная гигиена наружных половых органов без использования специальных моющих и увлажняющих средств. Несоблюдение базовых принципов гигиены приводит к повреждению эпителиального покрова вульвы с развитием сухости, зуда и в тяжелых случаях воспаления, а также нарушению ее микробиома – транспортного моста для микробной колонизации влагалища. Кроме того, разрушение слизисто-эпителиального слоя во влагалище при любых вагинальных инфекциях [17, 19] создает дополнительные неблагоприятные условия для заселения вагинальными лактобактериями.
В недавнем исследовании мы показали, что рецидивов БВ можно избежать, следуя рекомендациям по бережному уходу за кожей и слизистой оболочкой половых органов после лечения [5]. Необходимо отметить, что клиническое выздоровление после лечения БВ, оцениваемое нами по отсутствию выделений и неприятного запаха из влагалища, у большинства пациенток не сопровождалось немедленной нормализацией рН вагинальной среды. Снижение показателя рН строго коррелировало с динамикой лактобактериального профиля (ЛБП), который самостоятельно восстанавливался в течение 4–6 недель после лечения, достигая характеристик, сравнимых по видовому составу и количественному соотношению с показателями клинически здоровых женщин. На основании полученных данных был сделан вывод, что при уменьшении количества патогенных микроорганизмов, участвующих в развитии БВ, освободившаяся ниша самостоятельно замещается лактобактериальным сообществом.
Для облегчения и лечения вагинального дискомфорта, а также восстановления и поддержания оптимального уровня рН широко используются вагинальные увлажняющие гели. Однако, устраняя сухость и дискомфорт, некоторые из них в исследованиях in vitro негативно влияли на состав лактобактериальной флоры [20]. Вместе с тем в одном из исследований использование ВГ с эфирным маслом чайного дерева, экстрактом ромашки, бисабололом, пантенолом, молочной кислотой и лактатом натрия ассоциировалось не только с увлажнением и устранением зуда и жжения, но и с увеличением продолжительности ремиссии при рецидивирующем БВ и кандидозном вульвовагините в комплексной терапии с антимикробными средствами [21].
Цель – оценить влияние ВГ с эфирным маслом чайного дерева на количественный и качественный состав лактобактерий, а также частоту рецидивов у пациенток после лечения БВ.
Материал и методы
Проспективное рандомизированное контролируемое исследование проводилось на базе четырех женских консультаций Москвы в период с 20 апреля 2023 г. по 30 ноября 2024 г. в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации и законодательными и нормативными документами РФ. В исследовании участвовало 66 пациенток в возрасте 18–45 лет, подписавших добровольное информированное согласие. Основную группу составила 41 пациентка, завершившая курс лечения БВ вагинальными капсулами, содержащими комбинацию нифуратела и нистатина. После первичного обследования и забора вагинальных мазков для исследования все пациентки получали рекомендации по исключению использования агрессивных и раздражающих веществ для гигиены интимной зоны с заменой их на специально разработанные моющие средства, поддерживающие нормальный уровень рН вульвы, естественный уровень увлажнения и не нарушающие микробиоту в интимной зоне. Соблюдение правильной интимной гигиены является важным звеном профилактики инфекционно-воспалительных заболеваний женской репродуктивной системы [22, 23]. Отобранным методом простой рандомизации 20 пациенткам дополнительно назначали вагинальный гель с эфирным маслом чайного дерева (гель интимный Гинокомфорт® PH баланс (восстанавливающий), АО «ВЕРТЕКС», Россия). Гель в объеме 2 мл рекомендовали наносить на слизистую оболочку влагалища один-два раза в сутки в течение 4–6 недель. Кроме эфирного масла чайного дерева, в качестве действующих компонентов гель содержит бисаболол, пантенол, молочную кислоту и натрия лактат.
Аналогичные рекомендации по соответствующей интимной гигиене и использованию ВГ с эфирным маслом чайного дерева получили 25 клинически здоровых женщин без патологических выделений из половых путей (группа сравнения).
Критерии невключения в исследование: заболевания вульвы, онкологические заболевания, острые ВЗОМТ, инфекции, передаваемые половым путем (ИППП), урогенитальные расстройства, связанные с менопаузой, ВИЧ-инфекция в анамнезе, любые операции за последние три месяца, психиатрические заболевания в анамнезе, тяжелые соматические/гинекологические заболевания или любые факторы, способные, по мнению врача, препятствовать включению пациента в исследование, гиперчувствительность к любому компоненту используемого препарата, прием глюкокортикоидов и иммуномодуляторов в течение месяца до включения в исследование.
Критерии исключения: отказ пациентки от участия в исследовании, появление одного из критериев невключения во время участия в исследовании, нарушение процедур протокола; развитие нежелательного явления, сопряженного с высоким риском для здоровья пациентки.
У всех участниц исследования проводили сбор анамнеза, жалоб, клинических данных, гинекологический осмотр, измерение уровня рН влагалища, аминный тест, забор мазков из влагалища для лабораторного исследования методом полимеразной цепной реакции (ПЦР). На каждом визите выполняли комплексную оценку состояния и нежелательных явлений (в том числе время их возникновения и выраженность).
Исследование ЛБП в вагинальных мазках проводилось в лаборатории ООО «Нанодиагностика» (Москва). Вагинальные мазки забирали в транспортную среду «Прямая ПЦР» для научного применения (ООО «Нанодиагностика»), обеспечивающую сохранность ДНК в течение по крайней мере 30 дней при температуре +4 °С. ДНК из клинического материала выделяли в соответствии со следующим протоколом: к объему биоматериала в транспортной среде добавляли равный объем лизирующего буфера «Прямая ПЦР» для научного применения (ООО «Нанодиагностика»). К смеси добавляли одну единицу протеиназы К, перемешивали на вортексе и термостатировали при температуре 55 °C 15 минут, затем при 95 °C еще 15 минут. После инкубации перемешивали на вортексе, центрифугировали две минуты при 12 500 оборотах в минуту, аликвоты по 5 мкл использовали в реакции ПЦР.
Общее содержание бактерий (общую бактериальную массу (ОБМ)) и лактобактерий определяли методом мультиплексной количественной ПЦР в режиме реального времени в одной ячейке с помощью тест-системы «Лактоиндекс В rplK» для научного применения (ООО «Нанодиагностика»). Относительное содержание лактобактерий оценивали на основании лактобактериального индекса (ЛИ), отражающего отношение общего количества лактобацилл к ОБМ. ЛИ в процентах рассчитывали по формуле:
ЛИ = 100 × 2(K - (Cq2 - Cq1)) при условии, что Cq2 - Cq1 > K, где Cq1 и Cq2 – пороговые значения для лактобактериальной и панбактериальной линий флуоресценции соответственно; К = 3,36 – эмпирически определенный коэффициент, учитывающий поправку на разницу копий генов rplK и 16S рРНК и различий в эффективности амплификации этих генов.
Детекцию и дифференциацию лактобактерий проводили методом ПЦР в режиме реального времени с помощью тест-системы для научного применения «Лактоспектр 4_rplK» (ООО «Нанодиагностика»). Эта система позволяет определять четыре вида лактобактерий, потенциально способных колонизировать вагинальный микробиоценоз: L. crispatus, L. iners, L. jensenii и L. gasseri/L. johnsonii. Два последних вида данная тест-система определяет как один маркер. В предыдущем исследовании распространения различных видов лактобактерий в вагинальных микробиотах российских женщин при тестировании тест-системой «Лактоспектр rplK» все положительные пробы L. gasseri/L. johnsonii были идентифицированы другой системой типирования, «Лактоспектр_tuf», которая дифференцирует эти два вида исключительно как L. gasseri [24]. В связи с этим мы интерпретируем положительные результаты L. gasseri/
L. johnsonii также как наличие только L. gasseri.
ПЦР проводили в объеме 30 мкл с использованием амплификатора BioRad CFX 96. Программа амплификации: 95 °C в течение пяти минут, затем 40 циклов по 15 секунд при 95 °C, 25 секунд при 60 °C, 10 секунд при 72 °C.
Дизайном исследования для всех пациенток было предусмотрено два визита и один телефонный звонок:
- первый визит (1-й день) – скрининг, измерение уровня рН, забор мазков из влагалища для исследований, рандомизация пациенток основной группы для назначения ВГ с маслом чайного дерева;
- звонок (через одну-две недели) – оценка жалоб, клинической эффективности, переносимости, удовлетворенности и безопасности использования ВГ;
- второй визит (через 4–6 недель) – оценка жалоб, измерение уровня рН, забор мазков из влагалища для исследований, оценка клинической эффективности, переносимости, удовлетворенности и безопасности ВГ.
Критерии эффективности:
- первичные конечные точки: доля (%) пациенток с отсутствием рецидивов или первичных эпизодов БВ на визите 2. Отсутствие рецидивов или первичных эпизодов БВ: отсутствие клинических проявлений БВ (отсутствие патологических вагинальных выделений и аминного запаха);
- вторичные конечные точки: динамика ЛБП и показателя рН влагалища на визитах 1–2.
Параметры переносимости, удовлетворенности и безопасности вагинального геля оценивали в популяции пациенток, получивших хотя бы одну дозу геля.
Статистическую обработку результатов исследования проводили методами параметрического и непараметрического анализа. Для накопления, корректировки, систематизации исходной информации и фиксации полученных результатов применяли электронные таблицы Microsoft Office Excel 2016. Статистический анализ выполняли в программе STATISTICA 13.3 (StatSoft. Inc, США). Первоначально оценивали характер распределения данных с помощью критерия Шапиро – Уилка и нормальных вероятностных графиков. Для определения однородности дисперсий по группам использовали критерий Левена. Если распределение подчинялось закону о нормальном распределении, применяли t-критерий Стьюдента, если нет – t-критерий Вилкоксона. Критерием статистической значимости различий служило значение p < 0,05.
Количественные показатели для двух групп сравнивали с помощью t-критериия Стьюдента при нормальном распределении значений. В противном случае использовали критерий Манна – Уитни. Для нормально распределенных показателей полученные результаты представлены в виде среднего значения и стандартного отклонения M (SD), в противном случае – в виде медианы и интерквартильного размаха Me (Q1; Q3).
Результаты и обсуждение
Общая клиническая характеристика пациенток
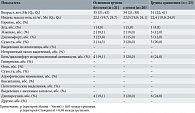
Социальные, анамнестические и клинические характеристики пациенток исследуемых групп не имели клинически значимых отклонений и были сопоставимы. Основные клинические данные представлены в табл. 1.
Клиническая эффективность
Основным критерием включения пациенток в исследование было отсутствие патологических выделений из половых путей и любых других лабораторно-клинических признаков инфекционных и неинфекционных заболеваний вульвы и влагалища. Поэтому на момент включения в исследование у всех пациенток отсутствовали гиперемия или атрофические изменения вульвы и влагалища, патологические вагинальные выделения, выделения с «рыбным» запахом, а также герпетические высыпания и ВПЧ-ассоциированные заболевания в области половых органов. С помощью ПЦР-теста были исключены ИППП. При микроскопическом исследовании в вагинальном содержимом не выявлено лейкоцитарной реакции, деструкции вагинального эпителия, ключевых клеток и элементов грибов. Тем не менее 27,8% пациенток предъявляли жалобы на такие проявления в наружных половых органах, как сухость, дискомфорт, периодическое жжение и/или зуд, боль или дискомфорт во время половой активности, связанные с недостаточным количеством смазки. Все отмеченные симптомы были легкой степени и по частоте встречаемости не отличались между группами (табл. 1).
У пациенток, применявших ВГ с маслом чайного дерева, все симптомы полностью редуцировались в течение недели, за исключением чувства жжения у некоторых пациенток (табл. 2). Кратковременное жжение легкой или умеренной степени появлялось и/или усиливалось после нанесения геля на слизистую оболочку влагалища в первые два дня у 17,8% женщин. По этой причине одна пациентка группы сравнения отказалась от дальнейшего применения геля и выбыла из исследования. В группе пациенток, применявших только специальные моющие средства для интимной гигиены, но без вагинального геля, все вышеперечисленные симптомы также значительно уменьшились, хотя и полностью не купировались.
В течение всего периода наблюдения ни у одной из пациенток, включенных в исследование, рецидивов или первичных эпизодов БВ не выявлено.
Оценка переносимости вагинального геля с маслом чайного дерева и удовлетворенности применения
Оценка субъективных и клинических симптомов при использовании ВГ с маслом чайного дерева в течение 4–6 недель у 45 пациенток (20 – после лечения БВ, 25 – без БВ в анамнезе) показала его хорошую переносимость. Единственной жалобой у 8 (17,8%) пациенток было жжение после нанесения геля. В большинстве (87,5%) случаев оно было легкое или умеренное, возникало в первые один-два дня использования геля и проходило самостоятельно в течение нескольких минут после нанесения. Других субъективных и клинических неблагоприятных симптомов в течение всего периода наблюдения не зафиксировано. По окончании исследования 97,8% пациенток были полностью удовлетворены (80,0%) или дали нейтральный отзыв (17,8%) об использовании геля. Только 1 (2,2%) пациентка отказалась от его дальнейшего применения.
Уровень рН и лактобактериальный профиль при использовании вагинального геля с маслом чайного дерева
Определение вагинального рН и исследование ЛБП проводились у 34 пациенток основной группы при включении в исследование (группа 1) и через 4–6 недель повторно: у 18 пациенток, применявших ВГ с маслом чайного дерева (группа ВГ-1), и у 16, следовавших только рекомендациям по интимной гигиене (группа без ВГ). В группе сравнения вагинальные мазки исследовались у всех 25 женщин при включении в исследование (группа 2) и у 22 из них через 4–6 недель применения ВГ (группа ВГ-2).
Уровень рН
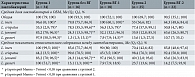
Одним из клинических эффектов ВГ считается поддержание нормального уровня рН, что и наблюдалось у всех пациенток, сделавших тест по окончании исследования (табл. 3). Следует также отметить, что большинство пациенток после лечения БВ (группа 1) при включении в исследование имели повышенный уровень рН, несмотря на клинические признаки выздоровления. Восстановление рН отмечалось через 4–6 недель после окончания лечения (группа ВГ-1 и группа без ВГ) и коррелировало с изменением ЛБП.
Лактобактериальный профиль
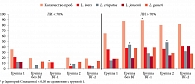
Частота выявления L. iners, L. crispatus, L. jensenii и L. gasseri при использовании вагинального геля с маслом чайного дерева. Всего исследовано 115 вагинальных образцов. Во всех группах были идентифицированы все четыре вида лактобактерий. Не обнаружено проб, в которых не выявлялся хотя бы один из этих видов, что подтверждает высокую распространенность L. iners, L. crispatus, L. jensenii и L. gasseri в популяции российских женщин. В 56,5% образцов содержался один вид лактобактерий, в 40% – два, в 3,5% – три.
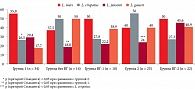
В группе здоровых женщин наиболее часто в вагинальных образцах встречались L. crispatus (56,0%), с одинаковой частотой 40,0% – L. iners и L. gasseri, реже – L. jensenii (р < 0,05) (рис. 1). 52% проб содержали два вида лактобактерий, 44% – один, 4% – три (табл. 4). После применения ВГ с маслом чайного дерева (группа ВГ-2) повысилась выявляемость L. iners и L. jensenii, снизилась – L. crispatus. При этом доминирования одних видов над другими больше не наблюдалось.
В группе пациенток после лечения БВ (группа 1) с большим отрывом доминировали L. iners (55,9%), причем в большинстве из проб – в виде единственного вида. На втором визите у пациенток, не использовавших ВГ, частота выявления L. iners и L. jensenii значительно снизилась, а L. crispatus и L. gasseri увеличилась. При этом большинство проб содержало уже по два вида лактобактерий. В результате через 4–6 недель после лечения БВ видовой состав лактобактерий стал сопоставим с таковым в группе здоровых женщин (группа 2). В группе пациенток, применявших ВГ (группа ВГ-1), по сравнению с визитом 1 увеличилась только выявляемость L. gasseri и сохранилось доминирование L. iners.
Таким образом, на основании полученных результатов можно сделать вывод, что дополнительное использование ВГ увеличивает рост лактофлоры, характерной для переходного состояния между эубиозом и дисбиозом, как у здоровых пациенток, так и у пациенток с БВ в анамнезе. ЛБП без использования геля после лечения БВ приближается в течение 4–6 недель к профилю здоровых женщин.
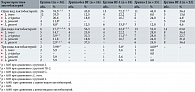
Лактобактериальный индекс при использовании вагинального геля с маслом чайного дерева. Общая доля лактобактерий и доли отдельных видов лактобактерий в ОБМ колебались в широком диапазоне от 0,01 до 100% во всех группах (табл. 5). Значение ЛИ 100% не означало отсутствия других бактерий, а указывало на то, что их количество по сравнению с лактобактериями не превышало 1%. При этом отмечались достоверные различия между группами: средние доли L. iners, L. jensenii и L. gasseri в ОБМ и относительное содержание среди других лактобактерий в группе пациенток после лечения БВ были выше, а L. crispatus – ниже, чем в группе здоровых женщин (p < 0,05). Тем не менее полной корреляции между качественной и количественной оценкой различных видов лактобактерий, в том числе при динамическом анализе через 4–6 недель, не наблюдалось (табл. 5). Обнаружен также широкий диапазон индивидуальных количественных показателей в группах, несмотря на то, что показатель общей доли лактобактерий между группами не отличался. Кроме того, нельзя утверждать, что ОБМ в вагинальных образцах полностью отражает общее количество микрофлоры во влагалище. В результате оценка средних долевых показателей в группах имеет целый ряд ограничений.
Вместе с тем достаточно показательным оказался сравнительный анализ видового состава лактобактерий в зависимости от величины ЛИ (рис. 2). Абсолютное большинство вагинальных проб во всех исследуемых группах имело высокий ЛИ – от 70 до 100%. В группе женщин без БВ в анамнезе соотношение проб с ЛИ > 70% и < 70% составляло 4:1 и оставалось стабильным через 4–6 недель применения ВГ. В группе с БВ первоначально количество проб с ЛИ > 70% было меньше. Соотношение проб с ЛИ > 70% и < 70% составляло 1,8:1, но через 4–6 недель значительно увеличилось: в группе пациенток, следовавших рекомендациям по интимной гигиене, – до 4,7:1, а в группе дополнительно использовавших ВГ – до 8:1.
При высоком ЛИ во всех группах встречались все типируемые виды лактобактерий. Частота выявления L. iners была относительно постоянной (от 35,3 до 40,9%), а у других лактобактерий варьировала. Так, у пациенток с БВ по частоте обнаружения L. crispatus, L. jensenii и L. gasseri существенно уступали L. iners. У здоровых пациенток, наоборот, L. crispatus доминировали над L. iners, но после применения геля количество проб с L. crispatus снизилось, а с L. jensenii – увеличилось. При анализе проб в группе БВ в динамике обнаружилось, что после применения ВГ увеличение частоты L. crispatus было ниже, чем в группе без него, хотя рост L. gasseri в обеих группах был сопоставимым.
Похожая динамика прослеживалась и в вагинальных образцах с низким и умеренным ЛИ (< 70%), несмотря на их малое количество. Так, в группе здоровых женщин независимо от применения геля преобладали L. gasseri, как и у пациенток, не использовавших гель после лечения БВ. Но в группе женщин, применявших ВГ после лечения БВ, доминирование сохраняли L. iners.
Таким образом, согласно результатам, после применения геля с маслом чайного дерева в вагинальных мазках чаще встречались лактобактерии, такие как L. jensenii и L. gasseri, наиболее характерные для промежуточного типа микробиоценоза [22, 23]. При этом частота обнаружения L. crispatus, являющихся маркером нормального микробиоценоза, в группе исходно здоровых пациенток снизилась, а у пациенток с БВ характеризовалась меньшим ростом, чем в группе без использования геля. При этом сохранялась частота выявления L. iners. В результате у пациенток, применявших гель в течение 4–6 недель после лечения БВ, доминировали L. iners и L. gasseri, что больше соответствует переходному состоянию. В то же время в группе пациенток, следовавших рекомендациям по интимной гигиене, но без ВГ доминировали L. crispatus и L. gasseri, что больше характерно для вагинального нормоценоза. Различия между группами могут указывать на умеренно сдерживающий эффект ВГ при длительном применении в отношении восстановления ЛБП у пациенток с БВ в анамнезе. Но в целом, несмотря на видовые различия, доля лактобактерий в ОБМ после применения геля у здоровых женщин не изменилась, а после лечения БВ значительно увеличилась, что может свидетельствовать о безопасности его использования в отношении лактобактериального сообщества.
Обсуждение
Как показано в нашем предыдущем исследовании [5], клиническое выздоровление, достигнутое у всех пациенток после лечения БВ вагинальными антимикробными средствами, первоначально не сопровождается восстановлением ЛБП и уровня рН у большинства женщин. Только через 4–6 недель видовой и количественный состав лактобактерий начинает соответствовать таковому в группе здоровых пациенток, что коррелирует и со снижением уровня рН во влагалище. В настоящем исследовании мы получили данные о влиянии ВГ с маслом чайного дерева и интимной гигиены с использованием специальных моющих средств на ЛБП и частоту рецидивов у пациенток после лечения БВ по сравнению со здоровыми женщинами, следовавшими таким же рекомендациям. Мы обнаружили, что почти каждая третья участница исследования независимо от наличия БВ в анамнезе предъявляла жалобы на сухость в области наружных половых органов, дискомфорт, жжение и/или зуд, боль или дискомфорт во время половой активности, связанные с недостаточным количеством смазки. Почти все симптомы полностью редуцировались в течение недели применения ВГ и специальных моющих средств для интимной гигиены. Интимная гигиена без ВГ оказалась менее эффективной в отношении вышеперечисленных жалоб. Таким образом, на основании достигнутого в кратчайшие сроки положительного эффекта появление подобных жалоб можно отнести к «последствиям» неправильной гигиены до включения в исследование, преимущественно основанной на рекомендациях по очищению наружных половых органов исключительно водой без применения любых увлажняющих и смягчающих средств в интимной зоне.
97,8% пациенток отметили хорошую переносимость восстанавливающего ВГ с маслом чайного дерева и высокую удовлетворенность его использованием. Только одна пациентка из-за усиливавшегося жжения при нанесении геля на слизистую оболочку влагалища отказалась от дальнейшего участия в исследовании.
Применение геля не только способствовало поддержанию нормального уровня рН во влагалище здоровых женщин, но и не влияло на его восстановление после лечения БВ. Динамика изменения рН после лечения БВ коррелировала только с изменениями ЛБП.
Во всех группах ЛБП был представлен всеми четырьмя видами лактобактерий, среди которых у клинически здоровых женщин доминировали L. crispatus, а у пациенток после лечения БВ – L. iners. Через 4–6 недель применения ВГ с маслом чайного дерева у здоровых женщин вместо L. crispatus стали превалировать L. jensenii и L. gasseri, тогда как у пациенток с БВ в анамнезе продолжали доминировать L. iners, хотя количество проб с L. gasseri также возросло. У пациенток с БВ в анамнезе, соблюдавших рекомендации по соответствующей интимной гигиене, но без ВГ видовой состав лактобактерий через 4–6 недель достиг характеристик, сравнимых с показателями здоровых женщин.
Таким образом, полученные результаты показывают, что при использовании ВГ с маслом чайного дерева в течение 4–6 недель как здоровыми пациентками, так и пациентками с БВ в анамнезе видовой состав лактобактерий меняется в сторону более характерного для переходного состояния между эубиозом и дисбиозом [25, 26]. Данная динамика ЛБП может быть полезной у пациенток после лечения БВ, у которых в течение первых двух недель может сохраняться умеренный дисбиоз с частым доминированием L. iners [5]. Применение восстанавливающего ВГ способствует созданию условий для перехода от дисбиоза к промежуточному типу биоценоза. Однако применение геля, по нашему мнению, должно ограничиваться одной-двумя неделями, так как более продолжительное его использование, видимо, может сдерживать последующее восстановление популяции L. crispatus. Достижение подобного эффекта в микробиоте здоровых женщин не всегда благоприятно, поскольку промежуточный тип микробиоценоза способен не только самостоятельно восстанавливаться в нормоценоз, но и при наличии сопутствующих факторов риска, таких, например, как неправильная интимная гигиена, переходить в клинический БВ.
Тем не менее, несмотря на видовые изменения лактобактерий, их доля в ОБМ под влиянием геля с маслом чайного дерева не изменилась, а после лечения БВ значительно увеличилась, что свидетельствует об отсутствии неблагоприятного воздействия на вагинальный биоценоз в целом. Это подтверждает и стабильный уровень рН на фоне использования геля в группе здоровых женщин, и значительное снижение показателя у пациенток после лечения БВ.
В течение всего периода наблюдения ни у одной из пациенток, применявших ВГ, не выявлено рецидивов или первичных эпизодов БВ. Это подтверждает результаты ранее опубликованного исследования [21] о том, что восстанавливающий гель Гинокомфорт® не только устраняет зуд, жжение и раздражение, увлажняет, восполняет недостаток естественной смазки, но и уменьшает частоту рецидивов БВ.
Заключение
Результаты исследования продемонстрировали, что соблюдение рекомендаций по интимной гигиене с применением интимного геля Гинокомфорт® РН баланс с маслом чайного дерева и специальных моющих средств не только создает комфорт в области наружных половых органов, но и препятствует развитию рецидивов БВ. Использование ВГ с маслом чайного дерева после лечения БВ способствует увеличению доли лактобактерий в вагинальной микробиоте и изменению их видового состава от характерного для дисбиоза к промежуточному типу. Отсутствие клинических признаков рецидивов или первичных эпизодов БВ за весь период наблюдения также указывает на безопасность ВГ в отношении вагинального микробиоценоза.
Между тем наше исследование имеет ряд ограничений, среди которых малая выборка пациенток, отсутствие данных о еженедельной динамике состава и количества лактобактерий на фоне применении геля, а также данных о нелактобактериальной микробиоте. Необходимо продолжать изучение видового разнообразия лактобактерий с оценкой ЛИ при использовании негормональных гелей с различным набором компонентов. Это позволит лучше понять, как влияют вагинальные увлажняющие средства на вагинальный микробиоценоз, и, возможно, приведет к более широкому их применению в клинической практике.
Финансирование. Исследование проведено при поддержке АО «ВЕРТЕКС» и Научно-образовательного проекта «Экспертология». При выполнении работы частично использовано оборудование Ресурсного центра клеточных и генных технологий ФГБУ «НИЦ „Курчатовский институт“».
Авторы сообщают об отсутствии финансирования при разработке и проведении исследования, сборе, анализе и интерпретации данных, а также подготовке, рассмотрении или утверждении рукописи.
Конфликт интересов. Авторы сообщают об отсутствии конфликта интересов и гарантируют, что статья является их оригинальной работой.
O.A. Pustotina, PhD, Prof., V.V. Demkin, PhD, M.A. Terekhov, E.B. Gadzhieva, O.Sh. Guskova, D.R. Karaeva, A.A. Kazakov, Ye.A. Vershinina
F.I. Inozemtsev Academy of Medical Education
Nanodiagnostics LLC
National Research Center ‘Kurchatov Institute’
Moscow Multidisciplinary Clinical Center ‘Kommunarka’
Odintsovo Regional Hospital
L.A. Vorokhobov City Clinical Hospital № 67
Contact person: Olga A. Pustonina, pustotina@gmail.com
The aim was to evaluate the effect of a vaginal gel with tea tree oil on the quantitative and qualitative composition of lactobacilli, as well as the frequency of relapses in patients after treatment of bacterial vaginosis (BV).
Material and methods. A multicenter prospective randomized controlled trial involved 41 patients after BV treatment and 25 healthy women. All participants received recommendations on intimate hygiene using special detergents. In addition, all healthy women and 20 patients with BV in the anamnesis additionally used a daily vaginal gel (VG) regenerating with tea tree oil for 4–6 weeks. When included in the study and after 4–6 weeks, complaints, pH level and lactobacillus profile (LBP) were evaluated.
Results. Every third woman, regardless of the presence of BV in the anamnesis, complained of dryness in the genital area, discomfort, burning and/ or itching, pain or discomfort during sexual activity, which were associated with insufficient lubrication and were almost completely reduced during a week of using VG and special detergents for intimate hygiene. Intimate hygiene without VG proved to be less effective. The use of the gel contributed to maintaining a normal pH level in the vagina of healthy women and did not affect its recovery after BV treatment, which correlated with changes in LBP. After using the gel, the proportion of lactobacilli in the vaginal microbiota of healthy women remained unchanged, and in patients after BV treatment it increased significantly (p < 0.05). LBP changed within 4-6 weeks from dysbiosis dominated by Lactobacillus iners to an intermediate type dominated by L. jensseni and L. gasseri. There were no relapses of BV.
Conclusion. Following the recommendations on appropriate intimate hygiene using VG with tea tree oil not only creates comfort in the area of the external genitalia, but also prevents the development of BV relapses. The use of VG after BV treatment contributes to an increase in the proportion of lactobacilli in the vaginal microbiota and a change in their species composition from the characteristic type of dysbiosis to the intermediate type.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.