Персонифицированный подход к выбору вида бариатрического вмешательства у пациента с ожирением и нарушением углеводного обмена: клиническое наблюдение
- Аннотация
- Статья
- Ссылки
- English
Введение
Количество больных сахарным диабетом (СД) 2 типа увеличивается из года в год. Согласно данным Федерального регистра, в России в 2024 г. на учете состояло 4,8 млн больных СД. С учетом незафиксированных случаев реальная цифра может приблизиться к 9 млн [1]. Согласно данным Международной диабетической федерации, в мире в 2021 г. насчитывалось 537 млн пациентов с СД, при этом более 85% из них – с СД 2 типа [2]. Кроме того, у 541 млн был диагностирован предиабет. В 2024 г. в мире расходы систем здравоохранения на лечение СД и связанных с ним заболеваний составили практически 1 трлн долл. США, что на 316% превысило данный показатель в среднем за последние десять лет [3]. Именно поэтому ведется активный поиск новых способов лечения и профилактики развития СД 2 типа.
На сегодняшний день особое внимание уделяется бариатрической хирургии. Данные операции, изначально разработанные для лечения ожирения, оказались эффективными для коррекции не только массы тела, но и нарушений углеводного обмена. При этом по результативности они превосходят все консервативные методы лечения ожирения и СД 2 типа [4–6].
Более успешными в коррекции гликемии у лиц с ожирением традиционно считаются шунтирующие операции. Так, основные виды желудочного шунтирования позволяют добиться нормализации гликемии при полном отказе от медикаментозной терапии у 86–95% больных [7]. Подобные результаты совсем недавно считались недостижимыми. Полагают, что такое воздействие на течение СД 2 типа достигается за счет инкретинового и иных эффектов, связанных с быстрым шунтированием пищевых масс в дистальные отделы тощей кишки. После рестриктивных операций углеводный обмен улучшается, по-видимому, исключительно благодаря снижению массы тела и потери висцерального жирового кластера. Данные клинической практики свидетельствуют о том, что нормализация гликемии после шунтирующих операций происходит уже через несколько суток. Однако выраженность данного эффекта варьируется от пациента к пациенту.
Исследований, в которых течение СД после бариатрических операций оценивалось бы изолированно от процесса похудения, пока не проводилось. В подавляющем большинстве работ ключевые показатели течения СД после бариатрической операции изучались лишь на фоне похудения, при этом через 12 месяцев и более. Лишь единичные исследования были проведены через один-два месяца после оперативного лечения [8, 9]. Однако за данный период времени больной может похудеть на 10 кг и более, что, безусловно, будет оказывать влияние на углеводный обмен.
Таким образом, не до конца ясно, насколько изменения в анатомии желудочно-кишечного тракта после бариатрических операций способны повлиять на углеводный обмен изолированно от процесса снижения массы тела и действительно ли шунтирующие операции превосходят в этом отношении рестриктивные операции.
Согласно актуальным национальным клиническим рекомендациям по лечению ожирения, общим показанием ко всем бариатрическим операциям являются только антропометрические характеристики, исходя из которых рассчитывается индекс массы тела [10]. Как следствие, показания к операции основываются только на значениях индекса массы тела. Очевидно, что этого недостаточно, если учитывать разнообразие бариатрических операций, существенные различия в механизмах их работы, потенциальной пользе и риске от того или иного вида вмешательства, а также то, что результат потери массы тела сопоставим для большинства широко применяемых на сегодняшний день операций. Именно поэтому активно разрабатываются различные прогностические шкалы в отношении ремиссии СД 2 типа после бариатрических операций [11, 12]. Однако конечный результат во всех этих исследованиях оценивается на фоне похудения, что не позволяет установить изолированное влияние бариатрических вмешательств на метаболический статус пациента с ожирением и нарушением углеводного обмена. Для решения этой проблемы мы проанализировали изменения, происходящие в самые кратчайшие сроки после желудочного шунтирования до клинически значимой потери жировой массы. Полученные на третьи сутки после операции данные позволили оценить изолированное влияние желудочного шунтирования на углеводный обмен, а также определить, у каких пациентов оно будет более предпочтительным. Данная информация может способствовать реализации персонифицированного подхода к лечению лиц с ожирением и нарушением углеводного обмена, так как выбор вида бариатрической операции будет осуществляться на основании не только антропометрических показателей и соматического статуса, но и ожидаемого эффекта от такого лечения.
Клиническое наблюдение
Описание
Больная Т. 34 лет обратилась в клинику по поводу невозможности снизить массу тела в течение длительного периода времени и жалоб, ассоциированных с ожирением, таких как быстрая утомляемость и одышка при физической нагрузке, боль в коленных суставах при ходьбе, физический и моральный дискомфорт, испытываемый в связи с ожирением.
На момент обращения в клинику масса тела пациентки составляла 107 кг, рост – 164 см, индекс массы тела – 40 кг/м2. Анамнестически максимальный вес – 112 кг. Наибольший эффект по снижению массы тела с помощью консервативных мероприятий (диетотерапия, физические нагрузки) – -16 кг. Достигнутый результат сохранялся на протяжении восьми месяцев, после чего отмечался повторный набор веса.
При дообследовании у больной выявлена гипергликемия натощак (6,4 ммоль/л) и значимое нарушение чувствительности тканей к инсулину (5,03 Ед по HOMA-IR). Согласно критериям Международной диабетической федерации, у пациентки верифицирован предиабет (уровень гликированного гемоглобина – 6,2%). Из заболеваний, ассоциированных с ожирением, обнаружена неалкогольная жировая болезнь печени, однако без признаков активного стеатогепатита.
Ввиду неоднократных попыток снизить массу телу с помощью консервативных мероприятий, приводивших к рецидиву ожирения, больной, согласно актуальным национальным клиническим рекомендациям по лечению ожирения [10], было показано оперативное лечение бариатрического профиля. При проведении эзофагогастродуоденоскопии у пациентки не было выявлено морфологической патологии верхних отделов желудочно-кишечного тракта, наличие которой могло бы стать весомым аргументом при выборе того или иного вида оперативного вмешательства.
Согласно актуальным клиническим рекомендациям и данным клинической практики, пациентке можно было выполнить либо рукавную резекцию желудка, либо гастропликацию желудка, либо бандажирование желудка, либо желудочное шунтирование в одной из его модификаций.
После исчерпывающего разъяснения всех плюсов и минусов каждой операции больная не смогла определиться с выбором вмешательства. С медицинской точки зрения оптимальный выбор также не был очевиден. Поэтому было принято решение прибегнуть к прогнозированию ожидаемой чувствительности тканей к инсулину (значений HOMA-IR) после предполагаемого оперативного лечения в объеме желудочного шунтирования с помощью методики математического моделирования. Данная методика была специально разработана нами для случаев, когда предполагаемый эффект от различных операций в отношении соматической патологии не ясен.
Результаты и их обсуждение
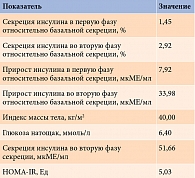
Для прогнозирования проведен комплекс лабораторных и физикальных обследований, включавших определение базальной секреции инсулина, секреции инсулина в первую фазу (через 5 минут после приема углеводосодержащего напитка), секреции инсулина во вторую фазу (через 30 минут после приема углеводосодержащего напитка), гликемии натощак, роста и веса. Исходя из полученных данных были рассчитаны переменные, необходимые для дальнейшего математического моделирования (таблица).
На основании компиляции полученных переменных с помощью специально разработанной формулы с применением алгоритмов машинного обучения был выполнен расчет ожидаемой чувствительности тканей к инсулину через три дня после предполагаемого желудочного шунтирования: 5,03 × -1 : [0,761 × 1,45 - 1,27 × 2,92 - 0,3 × 7,92 + 0,055 × 33,98 + 0,071 × 2,922 + 12,304 : 41 - 5,556 : 6,4 - 21,449 : 51,66 - 0,004 : 1,45 + 5,619 : 5,03] = 5,03 × -1 : [1,1 - 3,7 - 2,38 + 1,87 + 0,6 + 0,3 - 0,87 - 0,42 - 0,003 + 1,12] = 2,11 Ед.
Как видно из полученных результатов, после операции HOMA-IR должен был снизиться с 5,03 до 2,11 Ед, что укладывается в референсное значение для данного показателя (< 2,7 Ед). Следовательно, только за счет изолированного влияния изменений в анатомии желудочно-кишечного тракта после желудочного шунтирования у данной пациентки ожидалось полное восстановление чувствительности тканей к инсулину.
Таким образом, в рассматриваемом клиническом случае желудочное шунтирование представлялось более патогенетически обоснованным, нежели операция рестриктивного характера, воздействие которой на углеводной обмен осуществляется только за счет механизмов, ассоциированных с потерей массы тела.
Пациентке было проведено желудочное шунтирование с одним анастомозом. Суть операции заключается в формировании из малой кривизны желудка узкой трубки, которая анастомозируется с тонкой кишкой на расстоянии 180 см от связки Трейтца. Как следствие, пища минует наибольшую часть желудка, а также двенадцатиперстную кишку и значительную часть тощей кишки.
На третьи сутки после оперативного лечения при повторной оценке HOMA-IR его значение составило 2,88 Ед, что максимально приближено к референсному порогу. Таким образом, чувствительность тканей к инсулину увеличилась на 177%.
Полученный результат позволяет сделать вывод, что выбор вида оперативного вмешательства был патогенетически обоснован. Так, у данной пациентки полное восстановление аффинности тканей к инсулину отмечено уже на третьи сутки после желудочного шунтирования. Следовательно, в данном процессе имели значение механизмы, не связанные с потерей массы тела. При проведении операции рестриктивного типа добиться аналогичных результатов невозможно. В данном случае изменение углеводного обмена происходило бы только на фоне похудения. Если бы при прогнозировании были получены значения, значимо превышающие референсный порог (2,7 Ед), мы бы не стали склоняться в пользу проведения операции шунтирующего типа. Поскольку в такой ситуации изменение чувствительности тканей к инсулину и компенсация углеводного обмена происходили бы с преобладанием механизмов, ассоциированных с похудением, операция рестриктивного типа оказалась бы не менее успешной.
Вывод
Предложенная формула для расчета ожидаемой чувствительности тканей к инсулину после предполагаемого оперативного лечения в объеме желудочного шунтирования позволяет осуществлять персонифицированный и патогенетически обоснованный подход к выбору вида оперативного вмешательства бариатрического профиля у пациентов с ожирением и нарушением углеводного обмена.
A.A. Botov, I.Yu. Yakovenko, MD, PhD, Prof., A.M. Mkrtumyan, MD, PhD, Prof.
Russian University of Medicine
Contact person: Aleksey A. Botov, botov48@gmail.com
A clinical case of gastric bypass surgery in a 34-year-old patient with prolonged unsuccessful attempts to reduce body weight and a complex of complaints associated with morbid obesity is presented. The levels of fasting blood glucose (6.4 mmol/l) and glycated hemoglobin (6.2%) revealed during the follow-up examination made it possible to establish the diagnosis of ‘prediabetes’. In addition, a significant violation of tissue sensitivity to insulin (HOMA-IR – 5.03 units) was found. In addition to obesity, the patient had a metabolically associated fatty liver disease, but without active steatohepatitis. According to current clinical recommendations and approaches to clinical practice, in this situation, either sleeve resection of the stomach, gastric gastroplication, gastric banding, or gastric bypass surgery in one of its modifications can be performed. To determine the potential effect of gastric bypass surgery on carbohydrate metabolism, we predicted the sensitivity of tissues to insulin after the proposed surgical treatment in the volume of gastric bypass surgery using a specially developed mathematical modeling method. This method can be used in cases where the intended effect of various operations on somatic pathology is not clear. According to clinical recommendations and approaches to clinical practice, in this situation, either sleeve resection of the stomach, gastric gastroplication, gastric banding, or gastric bypass surgery in one of its modifications can be performed. To determine the potential effect of gastric bypass surgery, we predicted the sensitivity of tissues to insulin using a specially developed mathematical modeling method. This method can be used in cases where the intended effect of various operations on somatic pathology is unclear.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.