Гипотиреоз у пациентов с терминальной стадией хронической болезни почек на программном гемодиализе: возможности своевременной заместительной терапии левотироксином
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить влияние терапии левотироксином на выживаемость больных гипотиреозом с терминальной стадией хронической болезни почек на программном гемодиализе.
Материал и методы. Обследованы 134 пациента с тсХБП на ПГД. Выделены группа с манифестным гипотиреозом (n = 7), группа с субклиническим гипотиреозом (n = 34) и группа с эутиреозом (n = 53). Больные были рандомизированы для лечения левотироксином. Длительность наблюдения составила четыре года (48 месяцев).
Результаты. Субклинический гипотиреоз выявлен у 25% больных, манифестный – у 5%. У пациентов с гипотиреозом содержание антител к тиреопероксидазе было значимо выше, чем у эутиреоидных лиц.
За период наблюдения умерло 36 (38,3%) больных. Умершие с тсХБП на ПГД по сравнению с выжившими были старше, индекс коморбидности у них был выше, уровень тиреотропного гормона и свободного тироксина также выше, а уровень свободного трийодтиронина ниже. Показатели эффективности гемодиализа, уровень фосфора, натрия, белкового обмена и С-реактивного белка у умерших были значимо хуже, чем у выживших. В группе наблюдения (больные с субклиническим гипотиреозом без терапии левотироксином) умерло 76,5%, в группе лечения – 16,7%, в группе сравнения (пациенты с тсХБП на ПГД без тиреоидной дисфункции) – 34,8%.
Заключение. У пациентов с тсХБП на ПГД и гипотиреозом заместительная терапия левотироксином представляется целесообразной и способствует выживаемости.
Цель исследования – оценить влияние терапии левотироксином на выживаемость больных гипотиреозом с терминальной стадией хронической болезни почек на программном гемодиализе.
Материал и методы. Обследованы 134 пациента с тсХБП на ПГД. Выделены группа с манифестным гипотиреозом (n = 7), группа с субклиническим гипотиреозом (n = 34) и группа с эутиреозом (n = 53). Больные были рандомизированы для лечения левотироксином. Длительность наблюдения составила четыре года (48 месяцев).
Результаты. Субклинический гипотиреоз выявлен у 25% больных, манифестный – у 5%. У пациентов с гипотиреозом содержание антител к тиреопероксидазе было значимо выше, чем у эутиреоидных лиц.
За период наблюдения умерло 36 (38,3%) больных. Умершие с тсХБП на ПГД по сравнению с выжившими были старше, индекс коморбидности у них был выше, уровень тиреотропного гормона и свободного тироксина также выше, а уровень свободного трийодтиронина ниже. Показатели эффективности гемодиализа, уровень фосфора, натрия, белкового обмена и С-реактивного белка у умерших были значимо хуже, чем у выживших. В группе наблюдения (больные с субклиническим гипотиреозом без терапии левотироксином) умерло 76,5%, в группе лечения – 16,7%, в группе сравнения (пациенты с тсХБП на ПГД без тиреоидной дисфункции) – 34,8%.
Заключение. У пациентов с тсХБП на ПГД и гипотиреозом заместительная терапия левотироксином представляется целесообразной и способствует выживаемости.
![Таблица 1. Клинико-лабораторные характеристики пациентов с тсХБП на ПГД в зависимости от уровня ТТГ, Me [Q1; Q3]](/upload/resize_cache/iblock/bd2/195_350_1/Volkova3.jpg)
![Таблица 2. Клинико-лабораторные показатели выживших и умерших пациентов с тсХБП на ПГД, Mе [Q1; Q3]/M (SD)](/upload/resize_cache/iblock/7d6/195_350_1/Volkova4.jpg)

Введение
Дисфункция щитовидной железы у лиц с терминальной стадией хронической болезни почек (тсХБП) на заместительной почечной терапии программным гемодиализом (ПГД) выявляется довольно часто [1–4]. При тсХБП нарушается выведение йода почками. Высокая концентрация неорганического йода способствует формированию эффекта Вольфа – Чайкова. Происходят подавление органификации йода в щитовидной железе, нарушение синтеза и выделения тиреоидных гормонов. Поэтому субклинический гипотиреоз (СГ) встречается у 15–25% пациентов с тсХБП на ПГД, манифестный гипотиреоз (МГ) – у 3–5% [1–7]. Изменяется также периферический метаболизм гормонов щитовидной железы: подавляются активность дейодиназы 1 и периферическая конверсия тироксина (Т4) в трийодтиронин (Т3), формируется так называемый синдром низкого Т3 [8–11].
Клиническая значимость дисфункции щитовидной железы у пациентов с тсХБП на ПГД остается спорной. Так, у 2715 взрослых, находившихся на диализе, изучалась связь между гипотиреозом и смертью от всех причин с учетом исходного уровня тиреотропного гормона (ТТГ) [12]. Уровень ТТГ оценивали в период с апреля 2005 г. по апрель 2011 г. В течение шести лет наблюдения из 350 (12,9%) пациентов с гипотиреозом и 2365 (87,1%) лиц с эутиреозом умерло 917. У пациентов с гипотиреозом риск смерти был выше на 35% по сравнению с больными с нормальной функцией щитовидной железы.
На сегодняшний день рекомендации по выявлению и лечению дисфункции щитовидной железы, в том числе субклинического гипотиреоза, у больных тсХБП на ПГД не разработаны. Однако в некоторых зарубежных работах продемонстрировано положительное влияние заместительной гормональной терапии левотироксином на прогноз у лиц с тсХБП на ПГД. Так, среди пациентов с гипотиреозом, находившихся на заместительной почечной терапии и получавших адекватную заместительную терапию левотироксином, смертность была значимо ниже, чем у больных гипотиреозом, не получавших заместительной терапии (p = 0,007) [12, 13]. Своевременно начатая заместительная гормональная терапия левотироксином и достижение целевых значений ТТГ способствовали сокращению риска смерти в два раза [14]. Отечественных исследований, посвященных оценке дисфункции щитовидной железы у больных с тсХБП на ПГД, немного. Кроме того, представлено мало данных эффективности и безопасности заместительной терапии левотироксином у больных СГ и МГ.
Целью нашего исследования стала оценка влияния терапии левотироксином на выживаемость больных гипотиреозом с терминальной стадией хронической болезни почек на программном гемодиализе.
Материал и методы
В исследование включены 134 пациента с тсХБП на ПГД. Исследование проводилось на базе отделения гемодиализа Научно-исследовательского института нефрологии Научно-клинического исследовательского центра ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Проведение исследования было одобрено локальным этическим комитетом.
Были выделены группа с МГ (n = 7), группа с СГ (n = 34) и группа с эутиреозом (n = 53).
Больные были рандомизированы для лечения левотироксином компании «Берлин-Хеми/А. Менарини». В группу лечения вошли 17 пациентов с СГ и 7 пациентов с МГ, которым был показан левотироксин. Группу наблюдения составили 17 больных СГ, не получавших терапию левотироксином, группу сравнения – 53 пациента с эутиреозом.
Длительность наблюдения составила четыре года (48 месяцев).
В исследование не включали получавших терапию амиодароном, перенесших операции на щитовидной железе или радиойодтерапию в анамнезе, а также пациентов с онкологическими заболеваниями и психическими расстройствами.
Все пациенты подписали информированное согласие на участие в исследовании.
Оценивали уровень ТТГ, свободного Т3 (св. Т3), свободного Т4 (св. Т4) и антител к тиреопероксидазе (АТ-ТПО).
Уровень ТТГ определяли методом иммуноферментного анализа реагентами третьего поколения с использованием анализатора Beckman Coulter (Швейцария). Референтный диапазон – от 0,4 до 3,5 мМЕ/л. Уровень св. Т4 – с помощью Access® Immunoassay Systems. Референтный интервал для св. Т4 составлял от 7,8 до 14,3 пмоль/л. Исследование уровня св. Т3 также проводилось с использованием Access® Immunoassay Systems. Референтный интервал для св. Т3 – от 3,5 до 6,4 пмоль/л. Содержание АТ-ТПО устанавливалось с помощью ORGENTEC TPO ELISA методом иммуноферментного анализа. Референтный диапазон составлял 0,0–10,0 МЕ/мл. Поэтому диагностически значимым повышением АТ-ТПО считали уровень более 10,0 МЕ/мл. Содержание креатинина и мочевины определяли на автоматическом иммунохимическом анализаторе UniCel DxC 800 (Beckman Coulter, Швейцария). Референтный интервал для креатинина составлял от 0,053 до 0,115 ммоль/л, для мочевины – от 2,5 до 7,3 ммоль/л. Эффективность гемодиализа рассчитывали по формуле Даугирдаса, а именно Kt : V, значение должно быть более 1,4, и доли снижения мочевины, или коэффициенту снижения мочевины (urea reduction ratio, URR), определяемому по формуле (Upre - Upost) : Upre)) × 100%, при этом он должен быть не менее 65%. Для оценки тяжести и прогноза заболевания был использован индекс коморбидности, который рассчитывали по шкале Чарлсона.
Статистический анализ полученных данных проводился с использованием программы StatTech v. 2.8.8 (ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка (при количестве исследуемых менее 50) или критерия Колмогорова – Смирнова (при количестве исследуемых более 50). Показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95%-ного доверительного интервала (ДИ). В отсутствие нормального распределения для описания количественных данных использовали медиану (Me), а также нижний и верхний квартили (Q1; Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, проводили с помощью U-критерия Манна – Уитни. Сравнение трех и более групп по количественному показателю, имеющему нормальное распределение, осуществлялось с помощью однофакторного дисперсионного анализа, апостериорные сравнения проводились с помощью критерия Тьюки (при условии равенства дисперсий). Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела – Уоллиса, апостериорные сравнения – с помощью критерия Данна с поправкой Холма. Для сравнения процентных долей при анализе многопольных таблиц сопряженности использовали хи-квадрат Пирсона.
Результаты
В исследование было включено 134 больных, среди них 53 (39,6%) женщины и 81 (60,4%) мужчина. Возраст больных составил от 20 до 94 лет, медиана – 54,50 [39,25; 66,75] года. При этом медиана возраста мужчин была 49,00 [38,00; 65,00] года, женщин – 61,00 [50,00; 68,00] года. Женщины были значимо старше, чем мужчины (р = 0,014).
Длительность гемодиализа обследованных варьировалась от одного до 430 месяцев. Медиана стажа гемодиализа составила 51,50 [24,00; 116,00] месяца, при этом у мужчин – 42,00 [20,00; 107,00] месяца, у женщин – 81,00 [34,00; 129,00] месяца. Стаж гемодиализа у женщин был значимо больше, чем у мужчин (р = 0,023).
Индекс массы тела (ИМТ) больных варьировался от 14,60 до 35,40 кг/м2. Средний ИМТ у мужчин составил 24,08 (3,76) кг/м2, у женщин – 24,28 (4,60) кг/м2. При сопоставлении ИМТ в зависимости от пола значимых различий выявить не удалось (р = 0,676).
Среди 134 больных у 16 (11,9%) имел место сахарный диабет, у 14 (10,4%) из них – сахарный диабет 2 типа длительностью от трех до 12 лет, у двух (1,5%) – сахарный диабет 1 типа длительностью от 30 до 34 лет.
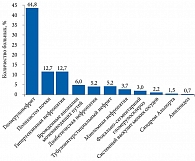
Из 134 пациентов с тсХБП на ПГД у 60 (44,8%) имели место разные формы первичных пролиферативных гломерулопатий. Среди пациентов с непролиферативными первичными гломерулопатиями у четверых (3,0%) отмечен фокально-сегментарный гломерулосклероз, у одного (0,7%) – наследственный вариант нефротического синдрома. У двух (1,5%) – синдром Альпорта, у одного (0,7%) – болезнь Фабри. У 17 (12,5%) больных было вторичное поражение почек: у одного (0,7%) – волчаночный нефрит, у пяти (3,7%) – миеломная нефропатия, у одного (0,7%) – амилоидоз, у семи (5,2%) – диабетическая нефропатия, у трех (2,2%) – системный васкулит мелких сосудов. Были также пациенты с негломерулярной патологией: с тубулоинтерстициальным нефритом – семь (5,2%), с поликистозной болезнью почек – 17 (12,7%), с гипертензивной нефропатией – 17 (12,7%), с врожденными аномалиями мочевыводящих путей – восемь (6,0%) (рис. 1).
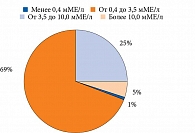
Уровень ТТГ исходно составлял от 0,24 до 16,94 мМЕ/л. Медиана ТТГ – 2,34 [1,49; 3,78] мМЕ/л, у мужчин – 2,15 [1,47; 3,66] мМЕ/л, у женщин – 2,46 [1,59; 3,88] мМЕ/л. Уровень ТТГ у женщин был несколько выше. Однако значимых различий по сравнению с мужчинами выявлено не было (р = 0,218). Со сниженным уровнем ТТГ (< 0,4 мМЕ/л) был один (0,7%) пациент, с нормальным уровнем ТТГ (0,4–3,5 мМЕ/л) – 92 (68,7%), с повышенным уровнем ТТГ (> 3,5 мМЕ/л) – 41 (30,6%) больной (рис. 2).
Медина концентрации АТ-ТПО у лиц с нормальным уровнем ТТГ составляла 0,80 [0,28; 3,70] МЕ/мл, у лиц с СГ – 1,60 [0,70; 6,25] МЕ/мл, у лиц с МГ – 0,70 [0,20; 3,60] МЕ/мл.
У больных тсХБП на ПГД был проведен анализ клинико-лабораторных показателей (табл. 1).
Группа больных с гипотиреозом значимо не различалась по полу, возрасту, ИМТ, стажу гемодиализа, индексу коморбидности, однако уровень АТ-ТПО в ней был выше.
За четырехлетний период наблюдения умерло 36 (38,3%) больных, выжило – 58 (61,7%). В структуре смертности преобладали сердечно-сосудистые причины – 27 (75,0%) случаев, ассоциированная с COVID-19 пневмония – семь (19,4%), кишечная непроходимость/кишечное кровотечение – один (2,8%), онкологическое заболевание – один (2,8%) случай.
В таблице 2 представлены различия клинико-лабораторных показателей у выживших и умерших пациентов.
Умершие с тсХБП на ПГД по сравнению с выжившими были старше, индекс коморбидности, а также уровень ТТГ и св. Т4 у них был выше, а уровень св. Т3 – ниже. Показатели эффективности гемодиализа, уровень фосфора, натрия, белкового обмена и С-реактивного белка (СРБ) у них также были значимо хуже.
Больным тсХБП на ПГД с СГ (n = 17) и МГ (n = 7) после рандомизации была назначена терапия левотироксином компании «Берлин-Хеми/А. Менарини». Начальная доза препарата составила 25 мкг. В дальнейшем проводилась титрация дозы с учетом индивидуальной переносимости и уровня ТТГ. У некоторых пациентов доза левотироксина была повышена до 112,5 мкг.
В группе лечения выживаемость была значимо выше, чем в группе наблюдения (табл. 3).
В группе наблюдения умерло 76,5% больных, в группе лечения – 16,7%, в группе сравнения – 34,8% пациентов.
Очевидно, что СГ вносит определенный вклад в исход у пациентов с тсХБП на ПГД, а терапия левотироксином ассоциируется с лучшей выживаемостью.
Обсуждение
В рассматриваемой когорте в большинстве случаев причиной тсХБП была гломерулярная патология почек.
Количество пациентов с СД было небольшим. Известно, что большинство таких больных умирают на додиализном этапе из-за наступления сердечно-сосудистого события.
В исследовании большую долю участников составили мужчины, что может быть связано с низкой комплаентностью на этапе лечения основного заболевания.
Высокая частота выявляемости гипотиреоза, полученная в нашем исследовании (30%, из которых 25% приходилось на СГ, 5% – на МГ), в целом согласуется с таковой в отечественных и зарубежных исследованиях.
У части пациентов с гипотиреозом был повышен уровень АТ-ТПО, что свидетельствовало о наличии аутоиммунного тиреоидита с исходом в гипотиреоз. В нашем исследовании повышенное содержание ТТГ не зависело от пола и возраста больных, хотя в общей популяции таковое, как правило, ассоциировано со старшим возрастом и женским полом.
В классическом понимании гипотиреоз подразумевает повышение уровня ТТГ и снижение уровня св. Т4. Однако для лиц с тсХБП на ПГД характерно нарушение периферической конверсии Т4 в Т3. В таком случае уровень св. Т4 несколько выше, но эффекты тироксина, по-видимому, не реализуются в полной мере.
Группа лечения получала адекватные дозы левотироксина до достижения нормального уровня ТТГ. Следует отметить, что обследованные пациенты принимали препараты, блокирующие всасывание фосфора в кишечнике, в частности севеламер. Известно, что этот препарат нарушает биодоступность левотироксина в кишечнике [15]. Поэтому в группе лечения дозы левотироксина были довольно высокими.
В настоящем исследовании и в ряде зарубежных работ показано, что лечение левотироксином увеличивает выживаемость лиц с тсХБП на ПГД [12]. Положительный эффект левотироксина может реализовываться за счет воздействия на метаболизм липидов. Установлено, что тиреоидные гормоны увеличивают экспрессию рецепторов аполипопротеина B в гепатоцитах, что способствует элиминации атерогенных липидных частиц. Тиреоидные гормоны способствуют синтезу сократительных белков миокарда, которые обладают наибольшей АТФазной активностью. Они опосредуют NO-зависимую вазодилатацию периферических сосудов, а также снижают уровень гомоцистеина вследствие усиления его катаболизма.
Наши пациенты получали лечение препаратом L-Тироксин компании «Берлин-Хеми/А. Менарини». К его преимуществам следует отнести отсутствие в таблетках маннитола и лактозы, которые влияют на всасываемость левотироксина, а также красителей, которые могут вызывать аллергические реакции, длительный срок годности (до трех лет), режим хранения (до 30 ºC).
Заключение
Полученные нами данные могут быть важны для практикующих врачей, которые занимаются ведением пациентов с тсХБП на ПГД. Очевидно, что у таких больных необходимо своевременно выявлять нарушение тиреоидной функции. Заместительная терапия левотироксином у лиц с тсХБП на ПГД и гипотиреозом представляется целесообразной и способствует повышению выживаемости.
A.R. Volkova, MD, PhD, Prof., Yu.Sh. Khalimov, MD, PhD, Prof., O.D. Dygun, PhD, G.G. Allamova
Pavlov First Saint Petersburg State Medical University
Contact person: Anna R. Volkova, volkovaa@mail.ru
Thyroid dysfunction in patients with end-stage chronic kidney disease (ESKD) on renal replacement therapy with programmed hemodialysis (RRT) is often detected. The clinical significance of thyroid dysfunction in ESKD patients on RRT remains controversial. Recommendations for the identification and treatment of thyroid dysfunction, including subclinical hypothyroidism, in patients with ESKD on RRT have not been developed.
A number of researchers have demonstrated the positive effect of hormone replacement therapy with levothyroxine on the prognosis of ESKD patients on RRT.
Objective – to study the effect of levothyroxine therapy on the survival of patients with hypothyroidism and end-stage chronic kidney disease on program hemodialysis.
Material and methods. 134 patients with ESKD were examined on RRT. A group of patients with manifest hypothyroidism (n = 7), with subclinical hypothyroidism (n = 34) and a group of patients with euthyroidism (n = 53) were identified. Patients were randomized to treatment with levothyroxine, followed up for 4 years (48 months).
Results. Subclinical hypothyroidism was detected in 25% of patients, manifest hypothyroidism – in 5%. In patients with hypothyroidism, the content of antibodies to thyroperoxidase was significantly higher compared to euthyroid patients.
During the observation period, 36 (38.3%) of patients died. Deceased patients with ESKD on RRT were older, comorbidity index was higher, thyroid-stimulating hormone and free thyroxine levels were higher, and free triiodothyronine levels were lower compared to survivors. RRT performance indicators, levels of phosphorus, sodium, protein metabolism and C-reactive protein levels in deceased patients were significantly worse compared to surviving ESKD patients on RRT. In the observation group (patients with subclinical hypothyroidism without levothyroxine therapy), 76.5% of patients died, in the treatment group – 16.7% of patients, and in the comparison group (group of ESKD patients on RRT without thyroid dysfunction) – 34.8% of patients.
Conslusion. Replacement therapy with levothyroxine in patients with ESKD on RRT and hypothyroidism seems appropriate and promotes patient survival.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.