Результаты хирургического лечения глаукомы (непроникающая глубокая склерэктомия и имплантация коллагенового и биорезорбируемого дренажей)
- Аннотация
- Статья
- Ссылки
- English
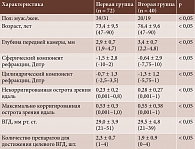
Материал и методы. Всего в рамках открытого проспективного исследования обследовано и прооперировано 109 пациентов (112 глаз). Всем пациентам проведена НГСЭ с имплантацией дренажей Ксенопласт (n = 72, первая группа) и Глаутекс (n = 40, вторая группа). В первой группе в 20,8% случаев определена стадия I глаукомы, в 23,6% – стадия II, в 52,8% – стадия III, в 2,8% – стадия IV. Во второй группе в 17,5% случаев зарегистрирована стадия I, в 20% – стадия II, в 52,5% – стадия III, в 10% – стадия IV.
Результаты. На первые сутки после операции в обеих группах отмечался выраженный гипотензивный эффект. Впоследствии на протяжении всего периода наблюдения в первой группе отмечалась стабилизация внутриглазного давления (ВГД). Во второй группе зафиксирован низкий уровень ВГД в период до семи дней после хирургического вмешательства с дальнейшей тенденцией к увеличению до 16,1 ± 1,9 и 15,7 ± 2,0 мм рт. ст. в период наблюдения от одного до трех месяцев соответственно. Уровень ВГД в первой группе был значимо ниже на сроках наблюдения шесть месяцев (p = 0,027), год (p = 0,046), два года (p = 0,02) и три года (p = 0,043). В обеих группах количество необходимых препаратов было значительно ниже, чем до операции (p < 0,01). Спустя трехлетний период наблюдения в первой группе частота полного успеха достигла 51%, во второй группе – только 35%. При этом частота неуспеха составила 6,9 и 25% соответственно (p < 0,05).
Заключение. В работе представлены данные сравнительного анализа результатов непроникающей глубокой склерэктомии и имплантации коллагенового и биорезорбируемого дренажей. Показаны отсутствие значимых различий в достижении целевого ВГД и критериев абсолютного и относительного успеха хирургического вмешательства в шестимесячный период и преимущество коллагенового дренажа в период наблюдения до трех лет.
Материал и методы. Всего в рамках открытого проспективного исследования обследовано и прооперировано 109 пациентов (112 глаз). Всем пациентам проведена НГСЭ с имплантацией дренажей Ксенопласт (n = 72, первая группа) и Глаутекс (n = 40, вторая группа). В первой группе в 20,8% случаев определена стадия I глаукомы, в 23,6% – стадия II, в 52,8% – стадия III, в 2,8% – стадия IV. Во второй группе в 17,5% случаев зарегистрирована стадия I, в 20% – стадия II, в 52,5% – стадия III, в 10% – стадия IV.
Результаты. На первые сутки после операции в обеих группах отмечался выраженный гипотензивный эффект. Впоследствии на протяжении всего периода наблюдения в первой группе отмечалась стабилизация внутриглазного давления (ВГД). Во второй группе зафиксирован низкий уровень ВГД в период до семи дней после хирургического вмешательства с дальнейшей тенденцией к увеличению до 16,1 ± 1,9 и 15,7 ± 2,0 мм рт. ст. в период наблюдения от одного до трех месяцев соответственно. Уровень ВГД в первой группе был значимо ниже на сроках наблюдения шесть месяцев (p = 0,027), год (p = 0,046), два года (p = 0,02) и три года (p = 0,043). В обеих группах количество необходимых препаратов было значительно ниже, чем до операции (p < 0,01). Спустя трехлетний период наблюдения в первой группе частота полного успеха достигла 51%, во второй группе – только 35%. При этом частота неуспеха составила 6,9 и 25% соответственно (p < 0,05).
Заключение. В работе представлены данные сравнительного анализа результатов непроникающей глубокой склерэктомии и имплантации коллагенового и биорезорбируемого дренажей. Показаны отсутствие значимых различий в достижении целевого ВГД и критериев абсолютного и относительного успеха хирургического вмешательства в шестимесячный период и преимущество коллагенового дренажа в период наблюдения до трех лет.


Актуальность
Глаукома часто становится причиной необратимого снижения зрения в мире. В последние годы наметилась тенденция к увеличению частоты заболеваемости [1]. Несмотря на наличие в арсенале офтальмолога значительного количества антигипертензивных препаратов, хирургическое вмешательство остается основным способом нормализации внутриглазного давления (ВГД) у пациентов с глаукомой [2]. За последние 50 лет хирургические методы коррекции у таких пациентов претерпели существенные изменения – от изолированных вмешательств до комбинированной хирургии на фоне иной сопутствующей патологии, включая возрастную катаракту, и применения различных дренажных устройств для нормализации ВГД при запущенных стадиях глаукомного процесса [3, 4].
На территории Российской Федерации зарегистрирован и разрешен к применению в клинической практике ряд дренажных устройств. Из них наиболее перспективными признаны Ex-PRESS, Ксенопласт и Глаутекс [5]. Ранее нами были представлены данные об эффективности имплантации дренажа Ex-PRESS (Alcon Laboratories Inc., США) в осложненных случаях рефрактерной глаукомы при неэффективности ранее проведенных вмешательств или невозможности компенсации ВГД на фоне максимально переносимой терапии антиглаукомными препаратами. Несмотря на высокие функциональные результаты хирургического вмешательства в течение трех лет после операции, в отдаленном периоде наблюдения эффект от нее снижается [6].
В 2012 г. для клинического применения был предложен новый биорезорбируемый дренаж Глаутекс (ООО «ХайБиТек», Россия). Основная сфера его применения помимо снижения ВГД – предотвращение формирования склеро-конъюнктивальных и склеро-склеральных сращений [7]. В дальнейшем эффективность и безопасность подобного дренажа подтверждены в ряде отечественных работ, в частности многоцентровых когортных исследований [5, 8, 9]. Конструкция дренажа включает муфту размером 5,2 × 2,0 мм из полиактида. Биорезорбция осуществляется через 4–8 месяцев после хирургического вмешательства. При этом отмечаются наличие зоны для оттока внутриглазной жидкости и длительный гипотензивный эффект [5].
С.Ю. Анисимова и соавт. в 2006 г. впервые описали результаты применения нового коллагенового антиглаукоматозного дренажа Ксенопласт (ООО «Трансконтакт», Россия) [10]. Впоследствии были представлены данные отдаленного наблюдения за пациентами и показан стойкий гипотензивный эффект [11]. Оценке эффективности такого дренажа была посвящены и другие работы, в том числе клинические и морфологические исследования [12–16]. Дренаж представляет собой высокоочищенный коллаген 1-го типа животного происхождения, насыщенный сульфатированными гликозаминогликанами [11]. По своей структуре дренаж схож с трабекулярной тканью, что, по мнению его разработчиков, способствует восстановлению максимально приближенного к физиологическому оттока внутриглазной жидкости [11].
Цель – провести сравнительный анализ результатов имплантации коллагенового и биорезорбируемого дренажей после непроникающей глубокой склерэктомии у пациентов с глаукомой.
Материал и методы
Всего в рамках открытого проспективного исследования обследовано и прооперировано 109 пациентов (112 глаз) (51 мужчина и 58 женщин, средний возраст – 74,3 ± 9,1 (47–90) года) с первичной открытоугольной глаукомой. Всем пациентам выполнена непроникающая глубокая склерэктомия с имплантацией дренажей Ксенопласт (n = 72, первая группа) и Глаутекс (n = 40, вторая группа) в клиниках «Эксимер» (Москва, Санкт-Петербург, Новосибирск).
Критерии включения пациентов в исследование: имплантация одного из исследуемых дренажей, наличие первичной открытоугольной глаукомы, о чем свидетельствуют уровень ВГД > 21 мм рт. ст. на фоне максимально переносимой медикаментозной терапии и/или прогрессирование дефектов полей зрения и/или экскавации диска зрительного нерва и истончения перипапиллярной сетчатки по данным оптической когерентной томографии. Критерии исключения предусматривали наличие иных видов глаукомы (вторичной, закрытоугольной, врожденной).
Разделение пациентов на группы проводили в зависимости от вида имплантированного дренажа. Общая характеристика пациентов в дооперационном периоде представлена в табл. 1. Пациенты были сопоставимы по всем исследуемым параметрам.
В первой группе в 15 (20,8%) случаях определена стадия I глаукомы, в 17 (23,6%) – стадия II, в 38 (52,8%) – стадия III, в 2 (2,8%) – стадия IV. Во второй группе в 7 (17,5%) случаях зарегистрирована стадия I, в 8 (20%) – стадия II, в 21 (52,5%) – стадия III, в 4 (10%) – стадия IV. Из сочетанной патологии в первой группе имели место катаракта (44,4%), сухая форма возрастной макулярной дегенерации, ретиношизис и диабетическая ретинопатия (1,4%), во второй группе – катаракта (30%), эпителиально-эндотелиальная дистрофия роговицы и частичная атрофия зрительного нерва (2,5%). В анамнезе в первой группе на 4 (5,5%) глазах ранее была выполнена синустрабекулэктомия, на 19 (26,4%) – факоэмульсификация катаракты с имплантацией интраокулярной линзы (ИОЛ). Во второй группе в большинстве случаев (31 (77,5%)) зарегистрирована артифакия.
Всем пациентам выполняли стандартное плановое офтальмологическое обследование до хирургического вмешательства и после имплантации дренажа на первый, седьмой день, через один, три, шесть, 12, 24 и 36 месяцев. Обследование включало визометрию с определением максимально корригированной остроты зрения (МКОЗ) вдаль, тонометрию по Маклакову и пневмотонометрию, автоматическую периметрию, биомикроскопию, гониоскопию и офтальмоскопию с оценкой состояния диска зрительного нерва. При обследовании в послеоперационном периоде оценивали фильтрационную подушку, глубину передней камеры, наличие клеток и степень помутнения в передней камере и положение шунта по данным гониоскопии.
Все хирургические вмешательства осуществлялись в основном условиях капельной анестезии, иногда применяли ретробульбарную или субконъюнктивальную анестезию. Непроникающую глубокую склерэктомию (НГСЭ) выполняли по описанной ранее методике [6]. В первой группе в 17 случаях проведено комбинированное хирургическое вмешательство (факоэмульсификация катаракты, имплантация ИОЛ и НГСЭ). В первой группе на заключительном этапе хирургического вмешательства перпендикулярно лимбу располагали дренаж Ксенопласт и фиксировали к склере одним узловым швом. Во второй группе дренаж Глаутекс располагали на склеральном лоскуте в виде муфты.
Эффективность хирургического вмешательства оценивали следующим образом:
- полный успех – достижение ВГД > 6 мм рт. ст. и ≤ 18 мм рт. ст. без медикаментозной терапии;
- относительный успех – достижение ВГД > 6 мм рт. ст. и ≤ 18 мм рт. ст. на фоне медикаментозной терапии;
- неуспех – ВГД > 18 мм рт. ст. и/или необходимость последующей антиглаукомной хирургии, а также удаления импланта.
При статистической обработке результатов использовали приложение Microsoft Excel 2010 и статистическую программу Statistica 10.1 (StatSoft, США). Рассчитывали среднее арифметическое значение (М), стандартное отклонение от среднего арифметического значения (m1), минимальные (min) и максимальные (max) значения, размах вариации Rv (разность max - min). Достоверность полученных результатов при сравнении средних показателей оценивали с помощью t-критерия Стьюдента и рангового критерия Вилкоксона. Различия между выборками считали достоверными при p < 0,05, доверительный интервал 95%.
Результаты и их обсуждение
Из интраоперационных осложнений в первой группе отмечали необходимость проведения витрэктомии и установки капсульного кольца при дефекте связок хрусталика у пациента с одномоментной экстракцией катаракты. В одном случае выявлена гифема, в двух – микроперфорация, в одном – витреальный блок. Во второй группе на двух глазах интраоперационно имела место микроперфорация.
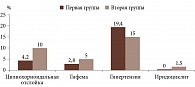
Частота ранних послеоперационных осложнений представлена на рис. 1.
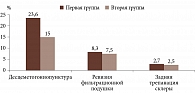
Осложнения в обеих группах, за исключением одного случая иридоциклита в во второй группе, были обычными для хирургии глаукомы. Частота цилиохориоидальной отслойки во второй группе превышала таковую в первой группе более чем в два раза. В позднем послеоперационном периоде отмечался подъем ВГД. Других осложнений не выявлено. В связи с наличием осложнений выполнены дополнительные хирургические вмешательства (рис. 2).
В одном случае из-за стойкой гипертензии проведена дополнительная НГСЭ с заменой дренажа Глаутекс на Ex-Press с благоприятным гипотензивным результатом.
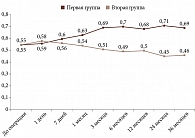
Одним из основных критериев успеха хирургического вмешательства служило достижение целевого уровня ВГД. Динамика ВГД в различные послеоперационные сроки наблюдения представлена на рис. 3.
На первые сутки после операции в обеих группах зафиксирован выраженный гипотензивный эффект с несколько большей гипотонией во второй группе. В дальнейшем в первой группе отмечалась стабилизация ВГД на всех сроках наблюдения с подъемом до 16,5 ± 2,2 мм рт. ст. через семь дней после операции, 17,2 ± 1,8 мм рт. ст. через месяц и незначительными колебаниями в период до 36 месяцев наблюдения (18,6 ± 3,1 мм рт. ст.). Во второй группе зарегистрирован низкий уровень ВГД в срок до семи дней после хирургического вмешательства с дальнейшей тенденцией к росту до 16,1 ± 1,9 и 15,7 ± 2,0 мм рт. ст. в сроки наблюдения один и три месяца соответственно. Данные показатели через месяц и три месяца не отличались в двух исследуемых группах. После шестимесячного наблюдения во второй группе уровень среднего ВГД увеличился до 23,2 ± 1,7 мм рт. ст., после чего оставался стабильным и не превышал 24 мм рт. ст. на протяжении всего периода наблюдения. Уровень ВГД в первой группе был значимо ниже на сроке наблюдения шесть месяцев (p = 0,027), год (p = 0,046), два года (p = 0,02) и три года (p = 0,043).
Среднее количество используемых в виде инстилляций препаратов для достижения целевого уровня ВГД составило 0,89 ± 0,27 в первой и 0,81 ± 0,34 во второй группе (p > 0,05). В обеих группах количество применяемых препаратов было значимо ниже, чем до операции (p < 0,01).
В первой группе отмечалось постепенное улучшение некорригированной остроты зрения (НКОЗ) в различные сроки наблюдения с достижением максимального показателя 0,49 ± 0,12 через два года после операции. Во второй группе зафиксирована стабилизация НКОЗ с некоторыми локальными максимумами (0,35 ± 0,09 после шестимесячного наблюдения) (рис. 4). Необходимо отметить, что во второй группе у большинства пациентов выявлена артифакия, в то время как в первой группе после экстракции катаракты и имплантации ИОЛ на 17 глазах НКОЗ резко улучшилась.
Схожая тенденция отмечалась и в отношении МКОЗ (рис. 5), что также могло быть обусловлено большей частотой комбинированных вмешательств в первой группе.
В отдаленном периоде наблюдения имели место небольшие изменения сферического и цилиндрического компонента рефракции как в сторону миопии, так и в сторону гиперметропии в обеих группах, однако во всех случаях различия не были статистически значимыми (p > 0,05).
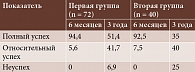
При анализе частоты достижения целевых показателей (полный и относительный успех) за шестимесячный период наблюдения установлено, что в обеих группах достигнуты высокие значения полного успеха (94,4 и 92,5% соответственно). В то же время через три года наблюдений в первой группе частота полного успеха составила 51%, а во второй – только 35%. При этом частота неуспеха была 6,9 и 25% соответственно (p < 0,05) (табл. 2).
Лечение пациентов с первичной открытоугольной глаукомой остается сложной задачей для офтальмологов, несмотря на наличие целого спектра препаратов и видов хирургического вмешательства, включая дренажную хирургию. В последние годы пациентам данной группы активно имплантируют дренажи отечественного производства Ксенопласт и Глаутекс. И.Б. Алексеев и соавт. оценивали результаты 239 оперативных вмешательств с применением дренажа Глаутекс. Авторы отметили полную резорбцию дренажа в 4–5-месячный срок, незначительное количество осложнений в послеоперационном периоде. Однако в 5% в ранние и 6,3% в поздние сроки после операции имела место декомпенсация ВГД. В 26,8% случаев была выполнена лазерная десцеметогониопунктура [8]. Схожие результаты описаны и в работе А.Ю. Слонимского и соавт. Исследователи отмечали стойкую компенсацию ВГД в срок от шести месяцев до двух лет [7]. В нашей работе на протяжении шестимесячного периода наблюдения имел место благоприятный гипотензивный эффект после имплантации дренажа Глаутекс, который снижался при более длительном наблюдении.
Согласно данным М.М. Бикбова и И.И. Хуснитдинова, гипотензивный эффект после имплантации дренажа Глаутекс зависит от вида глаукомы [9]. В нашей работе пациенты с закрытоугольной, неоваскулярной и увеальной глаукомой были исключены из исследования.
Впервые описание особенностей имплантации нового коллагенового дренажа Ксенопласт было представлено в работе С.Ю. Анисимовой и соавт. в 2006 г. Авторы, проанализировав результаты хирургического лечения десяти больных и наблюдения за ними в течение 18 месяцев, сделали вывод о безопасности и эффективности используемого импланта. Среди осложнений исследователи отметили три случая отслойки сосудистой оболочки [10]. Впоследствии те же авторы представили результаты шестилетнего наблюдения за 30 пациентами с далекозашедшей и терминальной глаукомой, указав на длительный и стойкий гипотензивный эффект [11]. Аналогичные данные были получены Н.Г. Завгородней и Т.П. Гайраджи после анализа результатов хирургического лечения 49 пациентов [13]. Данные об эффективности имплантации дренажа Ксенопласт подтверждены и в нашей работе при трехлетнем динамическом наблюдении.
Сравнительный анализ имплантации трех дренажей представлен в работе Т.В. Гавриловой и соавт. (2020). Авторы наблюдали большую группу пациентов (249 человек, 253 глаза), разделив их на три подгруппы – с имплантацией дренажей Ex-Press, Ксенопласт и Глаутекс. Выполнялись как проникающие, так и непроникающие хирургические вмешательства. По мнению авторов, абсолютный успех после операций во всех группах (96,3–98,4%) был нестойкий и при 24-месячном наблюдении имел тенденцию не только к снижению, но и к исчезновению. Более длительным он был при использовании дренажа Глаутекс при синустрабекулэктомии и шунта Ex-PRESS [5]. В нашем исследовании выполнен сравнительный анализ двух дренажей (Ксенопласт и Глаутекс) после НГСЭ. Показано преимущество дренажа Ксенопласт при длительном (три года) наблюдении за пациентами.
Заключение
В работе представлены данные сравнительного анализа результатов непроникающей глубокой склерэктомии и имплантации коллагенового и биорезорбируемого дренажей. Показаны отсутствие значимых различий в достижении целевого ВГД и критериев абсолютного и относительного успеха хирургического вмешательства в шестимесячный период и преимущество коллагенового дренажа в период наблюдения до трех лет.
Авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
K.B. Pershin, N.F. Pashinova, A.Yu. Tsygankov, Ye.А. Korneeva, G.М. Solovyova, Ye.P. Gurmizov, I.А. Likh, V.V. Kashnikov
Excimer Eye Clinic, Moscow
Academy of Postgraduate Education of the Federal Medical Biological Agency
Excimer Eye Clinic, St.-Petersburg
Excimer Eye Clinic, Novosibirsk
Contact person: Aleksandr Yu. Tsygankov, alextsygankov1986@yandex.ru
Aim – сomparative analysis of the results of collagen and bioresorbable drainage implantation after non-penetrating deep sclerectomy (NPDS) in patients with glaucoma.
Material and methods. Total 109 patients (112 eyes) were examined and operated within open prospective study. All patients underwent NPDS with Xenoplast drainage implantation (n = 72, group I) and Glautex (n = 40, group II). Group I had stage I glaucoma in 20.8%, stage II in 23.6%, stage III in 52.8%, and stage IV in 2.8%. Among group II patients 17,5% had stage I, 20% – stage II, 52,5% – stage III and 10% – stage IV.
Results. On the first day after the operation both groups demonstrated a significant hypotensive effect. IOP stabilization in all follow-up periods was registered in group I. Low IOP level in group II was registered up to 7 days after the surgery, with a further tendency to increase up to 16,1 ± 1,9 and 15,7 ± 2,0 mm Hg during follow-up of 1 and 3 months, respectively. IOP in group I was significantly lower at follow-up periods of 6 months (p = 0.027), 1 year (p = 0.046), 2 years (p = 0.02), and 3 years (p = 0.043). In both groups, the number of medications needed was significantly lower than before surgery (p < 0.01). After 3 years of follow-up, group I had a complete success rate of 51% and group II only 35%, with a failure rate of 6.9% and 25%, respectively (p < 0.05).
Conclusion. The paper presents the results of a comparative analysis of the results of NPDS and implantation of collagen and bioresorbable drainages. It was shown that there were no significant differences in the achievement of the target IOP and criteria for the absolute and relative success of surgical intervention in the period of 6 months and the advantage of collagen drainage in the observation period up to 3 years.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.