II Евразийский конгресс ревматологов. Современные возможности выбора терапии при остеоартрозе
- Аннотация
- Статья
- Ссылки



Остеоартроз или остеоартрит? Современное представление о болезни и ее лечении
Доктор медицинских наук, профессор Людмила Ивановна АЛЕКСЕЕВА (Научно-исследовательский институт ревматологии им. В.А. Насоновой РАМН) посвятила свое выступление современным представлениям о патогенезе и фармакотерапии остеоартроза.
Остеоартроз – распространенное хроническое заболевание суставов, которое влечет за собой утрату работоспособности, частое обращение за медицинской помощью и значительные экономические затраты на лечение.
Патогенез заболевания сложен и до конца не изучен. Сегодня российские ученые рассматривают вопрос о принятии терминологии заболевания в соответствии с международной классификацией и переименовании остеоартроза в остеоартрит. Дело в том, что согласно результатам последних исследований в патогенезе заболевания существенная роль принадлежит персистирующему воспалению с прогрессированием морфологических дегенеративных изменений в тканях.
Остеоартроз характеризуется фокальным разрушением суставного хряща, изменениями в субхондральной кости, синовиальной оболочке, образованием остеофитов.
Новые данные о развитии остеоартроза способствовали появлению гипотезы нарушенного равновесия в его патогенезе. Раньше считалось, что нормальный метаболизм хрящевой ткани изменяется с преобладанием катаболических процессов над анаболическими. Теперь есть основания утверждать, что нарушается равновесие между провоспалительными (интерлейкинами (ИЛ) 1-бета, 6, 11, 17, 18, фактором некроза опухоли (ФНО) альфа) и антивоспалительными (ИЛ-4, -10, -13, тканевыми ингибиторами маталлопротеиназ, факторами роста) цитокинами. Роль провоспалительных цитокинов в патофизиологии остеоартроза активно изучается. Известно, что повышенная экспрессия провоспалительных цитокинов, таких как ИЛ-1, ИЛ-6, ФНО-альфа, является основным звеном в развитии остеоартроза и вызывает дегенеративные процессы в хрящевой ткани, воспаление в синовиальной оболочке и патологические процессы в субхондральной кости.
Повреждение сустава начинается с воспаления синовиальной оболочки (синовита). Продукты деградации хряща фагоцитируются синовиальными клетками, провоцируя синовиальное воспаление. В свою очередь активированные синовиальные клетки продуцируют катаболические и провоспалительные медиаторы, инициирующие избыточную продукцию протеолитических ферментов. Воспаление усиливается активированными синовиальными Т- и В-клетками, инфильтрованными макрофагами.
Синовит рассматривается как один из признаков остеоартроза, который встречается почти у половины больных. Наличие синовита определяется по ряду диагностических признаков: припухлости суставов, локальным признакам воспаления, внезапному усилению боли, ночной и утренней скованности. При инструментальных методах диагностики (магнитно-резонансной томографии, ультразвуковом исследовании, артроскопии) у больных определяется увеличение объема синовиальной жидкости. При гистологическом исследовании наблюдаются гипертрофия и гиперплазия синовиальной оболочки, инфильтрация мононуклеарными клетками (моноцитами, макрофагами, активированными Т- и В-лимфоцитами), усиление ангиогенеза, адаптивный иммунный ответ Т- и В-лимфоцитов в отношении фрагментов внеклеточного матрикса. Исследования на молекулярном уровне отражают синтез провоспалительных цитокинов, образование простагландина Е2 и оксида азота, увеличение экспрессии молекул адгезии синовиальной ткани, усиление активности матриксных металлопротеиназ (ММП) 1, 3, 9, 13, синтез адипокинов.
Наличие синовита при остеоартрозе подтверждают биохимические маркеры. Как известно, повышенный уровень C-реактивного белка в анализах крови – признак воспаления. Увеличение уровня ММП-3 и -9 в синовиальной ткани отмечается при быстром прогрессировании коксартрита. Следует отметить, что основными мишенями ММП становятся структурные компоненты экстрацеллюлярного матрикса (протеогликаны и коллаген 2-го типа).
В ходе однолетнего артроскопического исследования 422 пациентов с остеоартрозом показано, что больные синовитом исходно имели в три раза более высокую вероятность прогрессирования повреждения хряща. Это подтверждает, что воспаление – фактор прогрессирования остеоартроза1.
В возникновении воспаления при остеоартрозе особую роль играют процессы в субхондральной кости. Докладчик подчеркнула, что согласно результатам исследований патологические изменения в субхондральной кости опережают изменения в хряще. Изменения в субхондральной кости свидетельствуют о ее воспалении, которое предшествует манифестации заболевания.
В настоящее время в мире активно изучают связь ожирения с остеоартрозом. Увеличение массы тела не только способствует возрастанию механической нагрузки на сустав, но и сопровождается воспалением с увеличенной продукцией адипокинов и провоспалительных цитокинов, вызывающих поражение хряща, кости и синовиальной оболочки.
Как правило, остеоартроз сопровождается взаимосвязанными компонентами метаболического синдрома – гипертонией, дислипидемией, гипергликемией, ожирением. Гипертония вызывает ишемию субхондральной кости, то есть активацию ремоделирования всех процессов. Дислипидемия приводит к нарушению метаболизма липидов, что в свою очередь провоцирует патологические изменения в суставе. Ожирение инициирует выброс адипокинов, участвующих в процессе воспаления. С увеличением числа компонентов метаболического синдрома остеоартроз приобретает более стремительное и тяжелое течение.
Лечение остеоартроза направлено прежде всего на уменьшение боли, улучшение функции суставов, ограничение прогрессирования заболевания. Применяются нефармакологические, фармакологические и хирургические методы лечения. Чтобы назначить адекватную терапию, необходимо не только провести тщательную диагностику, но и оценить распространенность и тяжесть суставного процесса, общий статус больного и наличие сопутствующих заболеваний.
Известен ряд фармакологических средств для лечения больных остеоартрозом, воздействующих на разные звенья хронической боли. Это препараты быстрого (анальгетики, миорелаксанты, нестероидные противовоспалительные препараты (НПВП)) и замедленного (антиостеопоретические препараты, глюкозамин, хондроитина сульфат, диацереин) действия.
Гетерогенность остеоартроза способна влиять на эффективность фармакотерапии. При выборе терапии следует учитывать фенотип заболевания – локализацию поражения, происхождение боли, структурное или симптоматическое состояние. Кроме того, определяют наличие отека костного мозга, синовита, интенсивность боли, ограничение подвижности. Коморбидность при различных нозологиях (ожирение, сердечно-сосудистые заболевания, остеопороз, депрессия) увеличивает степень тяжести остеоартроза. Необходимо также учитывать индивидуальные факторы риска развития остеоартроза – пол, возраст, психосоциальные факторы.
Профессор Л.И. Алексеева отметила, что в этом году Международным обществом по изучению остеоартроза (Osteoarthritis Research Society International – OARSI) предложены рекомендации для лечения больных остеоартрозом в зависимости от фенотипа и наличия коморбидности2.
Докладчик подчеркнула, что рекомендовать препараты больным необходимо в соответствии с их индивидуальными особенностями.
Препарат диацереин относится к симптоматическим средствам замедленного действия. Эффективность и безопасность диацереина при гонартрозе и коксартрозе оценена в метаанализе контролируемых клинических исследований. Проанализированы результаты лечения 2637 пациентов, период лечения и длительность последействия препарата (один –три месяца). Данные метаанализа показали, что диацереин активно купирует болевой синдром по сравнению с плацебо и НПВП, обладает выраженным эффектом последействия, как все хондропротекторы. Структурно-модифицирующий эффект препарата доказан в лечении остеоартроза тазобедренных суставов3.
Диацереин не только влияет на анаболизм или катаболизм хряща. Препарат ингибирует деструкцию кости, уменьшает экспрессию RANKL (tumor necrosis factor ligand superfamily member – лиганд рецептора активатора ядерного фактора каппа B), снижает уровень глюкозы натощак при сахарном диабете 2-го типа, массу тела у пациентов с ожирением.
Таким образом, препарат диацереин можно рекомендовать пациентам, страдающим остеоартрозом при наличии коморбидных состояний.
В заключение профессор Л.И. Алексеева еще раз акцентировала внимание собравшихся на том, что определение «остеоартроз» устарело. Новый взгляд на патогенез заболевания позволяет называть его остеоартритом, при котором происходит системное высвобождение провоспалительных медиаторов, обусловливающих дегенеративные изменения тканей.
Периартикулярная терапия: новая жизнь препаратов гиалуроновой кислоты
Профессор кафедры ревматологии Российской медицинской академии последипломного образования, заведующий Московским городским ревматологическим центром ГБУЗ «ГКБ № 1 им. Н.И. Пирогова», главный ревматолог Департамента здравоохранения г. Москвы Евгений Валерьевич ЖИЛЯЕВ рассказал о применении препаратов гиалуроновой кислоты при повреждениях сухожильно-мышечного аппарата.
Гиалуроновая кислота (ГК) содержится в соединительной ткани млекопитающих и представляет собой длинноцепочечный полисахарид, состоящий из чередующихся единиц N-ацетилглюкозамина и глюкуроната. Молекулярная масса ГК – 4–5 млн Дальтон (Да). ГК в высоких концентрациях содержится в синовиальных полостях и отличается высокой скоростью обмена –
3–5 г/сут.
В последнее десятилетие представления о роли ГК в лечении заболеваний суставов изменились. ГК, будучи высокоактивным биологическим соединением, участвует в регуляции ряда процессов. Она выступает как воспалительный или противовоспалительный агент в зависимости от состояния, регулирует процессы репарации, то есть является первичным заполнителем дефектов тканей и проводником мигрирующих клеток. Воздействуя на окружающие и мигрирующие клетки, ГК способствует восстановлению соединительно-тканного матрикса, стимуляции роста и размножению клеток. ГК управляет поведением стволовых клеток различных тканей, обеспечивая морфогенез в период эмбрионального развития.
ГК имеет собственные специфические рецепторы для проведения сигнала. Классический рецептор, который связывается только с ГК, – CD44. Он имеет характерный тирозинкиназный привод, может выступать как ко-рецептор и молекула адгезии. Рецептор CD44 представлен на иммунных клетках, лейкоцитах, фибробластах, гладкомышечных, эпителиальных, стволовых клетках. Еще один специфический рецептор ГК – CD168, молекула которого задействована в ряде репаративных реакций. Этот рецептор взаимодействует с другими цитокинами и рецепторами фактора роста, функционально экспрессируется на многих клетках (эндотелиальных, гладкомышечных, макрофагах). Рецептору CD168 принадлежит особая роль в процессе заживления повреждений. Еще один специфический рецептор ГК – ФНО-индуцированный белок 6, появляющийся на поверхности иммунных клеток при воспалении. Он подавляет миграцию нейтрофилов совместно с CD44. Известны и другие молекулы, взаимодействующие с высокомолекулярной ГК и запускающие различные внутриклеточные процессы.
Еще один путь взаимодействия ГК с клетками – Toll-подобные рецепторы (Toll-like receptors – TLR). В связи с тем что ГК входит в состав клеточной стенки ряда бактерий, в первую очередь стрептококков, она может распознаваться как признак инфекции через TLR2 и TLR4 макрофагами и дендритными клетками.
При взаимодействии с клеткой высокомолекулярная ГК демонстрирует три важных свойства. Во-первых, взаимодействует с Т-регуляторами – особой группой Т-лимфоцитов (CD4 и CD25), функция которых заключается в подавлении и торможении воспалительных реакций. Во-вторых, ГК способна блокировать острый воспалительный ответ и предотвращать миграцию лейкоцитов. В-третьих, ГК взаимодействует с мезенхимальными стволовыми клетками. Это свойство ГК открывает широкие перспективы для ее использования.
В ходе последних исследований продемонстрированы противовоспалительные эффекты ГК в суставах. Она подавляет продукцию ядерного фактора каппа В и ИЛ-6 макрофагами в условиях стимуляции их микробными липополисахаридами, снижает активность и продукцию ММП в клетках субхондральной кости, хондроцитах и фибробластоподобных синовиоцитах. ГК подавляет продукцию наиболее важных провоспалительных цитокинов (ИЛ-1-бета, ИЛ-8, ФНО-альфа), снижает концентрацию ИЛ-6 в синовиальной жидкости у пациентов с остеоартрозом.
Синовиоциты человека под действием препаратов ГК значительно наращивают экспрессию факторов роста – соединительно-тканного, трансформирующего, васкулярно-эндотелиального.
Высокомолекулярная ГК через CD44-рецептор обеспечивает хемотаксис мезенхимальных стволовых клеток в зону повреждения/репарации.
Сегодня благодаря уникальным свойствам ГК появились новые направления в ее применении. Это разработка средств для заживления язв и ран, блокирования образования рубцов, спаек после хирургических вмешательств на брюшной полости и в малом тазу, а также использование ГК в качестве каркаса для конструирования тканей, который впоследствии заполняется клетками-прекурсорами. ГК можно использовать в качестве носителя различных веществ (факторов роста, антибиотиков, ингибиторов металлопротеиназ) для активации репаративных процессов.
Докладчик остановился на одном из методов лечения остеоартроза – периартикулярной терапии, направленной на устранение боли.
Мишенями периартикулярной терапии являются энтезы, сухожилия, скандинозы, связки, мышцы.
Энтезы – места прикрепления к кости сухожилий, связок, суставных капсул. Энтезы являются источником боли при остеоартрозе и спондилоартрите, посттравматических и идиопатических энтезопатиях, миофасциальных синдромах. Поскольку энтезопатии сопровождаются спазмами, цель периартикулярной терапии – миорелаксация (расслабление мышц). Кроме того, такая терапия направлена на восстановление структуры поврежденного энтеза, что особенно важно при посттравматических осложнениях.
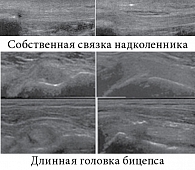
Технология периартикулярной терапии заключается в проведении иглы до кости или вдоль костной поверхности. При введении препаратов ГК желательно использовать путевой шприц или вводить иглу под ультразвуковым контролем (рис. 1).
В настоящее время ГК широко используют для периартикулярного введения. Первым опытом стало введение ГК при повреждениях дельтовидной связки подворачивания стопы, показавшее хороший эффект. В открытом рандомизированном исследовании, в ходе которого ГК вводили в места крепления задней группы вращающей манжеты, продемонстрирована высокая эффективность метода. Два двойных слепых рандомизированных исследования по введению ГК в субакромиальную сумку при синдроме вращающей манжеты также показали положительные результаты4.
Интересные данные были получены при введении натрия гиалуроната в область наружных надмыщелков плеча. Отмечен длительный эффект – до шести месяцев, несмотря на однократное введение относительно низкомолекулярного препарата5.
В целом введение ГК больным остеоартрозом сопровождается выраженным уменьшением тяжести патологического процесса.
Другими перспективными локализациями для проведения периартикулярной терапии могут быть сухожилия длинной головки бицепса, собственная связка надколенника, сухожилие разгибателя большого пальца при болезни де Кервена (de Quervain), пяточные шпоры, энтезы большого вертела и др.
В настоящее время для периартикулярной терапии в основном используются глюкокортикостероиды, характеризующиеся быстрым началом действия. Однако гиалуроновую кислоту отличают свойства, которых нет у глюкокортикостероидов. ГК обладает длительным эффектом, не является допингом, при ее введении отсутствует риск разрыва сухожилия. В ближайшей перспективе препараты ГК будут активно использоваться для периартикулярной терапии.
На фармацевтическом рынке появился новый швейцарский препарат, показанный при боли и ограничении подвижности при поражениях сухожилий, – Ост Тендон (OST® TENDON) (натрия гиалуронат 2% + маннитол) в дозировке 40 мг/2 мл в шприце, в состав которого входит нативная химически немодифицированная гиалуроновая кислота, полученная методом бактериальной ферментации и последующей очистки. Предполагается двукратное введение препарата с интервалом одна неделя.
Постоянное длительное перенапряжение может привести к микротравматизации сухожилий, что сопровождается повреждением волокон и клеток. Это приводит к повреждению сухожилия, его перестройке, замещению упорядоченных коллагеновых волокон грубой рубцовой тканью. Поверхность сухожилия становится шероховатой, что повышает трение при движениях и еще больше способствует травматизации и развитию воспаления. Как следствие – боль и ограничение подвижности сухожилий.
Ведение препарата Ост Тендон (OST® TENDON) высокой молекулярной массы и высокой концентрации (2%, 1,6 мДа) способствует более длительному терапевтическому эффекту6.
Повторная инъекция препарата Ост Тендон (OST® TENDON) позволяет поддерживать высокую концентрацию ГК в зоне поражения. Возможно одновременное введение препарата в несколько сухожилий. Эффективность данной терапевтической схемы лечения подтверждена в клиническом исследовании препарата Ост Тендон (OST® TENDON)7.
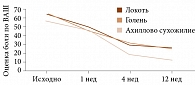
В открытом неконтролируемом исследовании участвовало 35 пациентов. Пациенты с тендинопатией средней части ахиллова сухожилия (n = 19), латеральным эпикондилитом (n = 14) и тендинопатией малоберцовых мышц (n = 2) в течение шести недель получали по две инъекции OST® TENDON с интервалом одна неделя между инъекциями (рис. 2 и 3).
Терапевтический эффект наблюдался уже через неделю, достигалось быстрое купирование боли, которое сохранялось до конца исследования, а также спустя три месяца после окончания лечения.
Клиническая эффективность диацереина при лечении остеоартроза коленных и тазобедренных суставов
В своем докладе д.м.н., профессор Римма Михайловна БАЛАБАНОВА (Научно-исследовательский институт ревматологии им. В.А. Насоновой РАМН) подробно рассказала о результатах лечения остеоартроза препаратом диацереин.
При остеоартрозе поражаются практически все части сустава – от синовиальной оболочки до связочного аппарата и околосуставных мышц. В патогенезе заболевания важную роль играют ИЛ-1 и ФНО-альфа. Катаболическое действие ИЛ-1 проявляется в его способности стимулировать выработку хондроцитами и синовиоцитами оксида азота, который повреждает внеклеточный матрикс. Кроме того, оксид азота, снижая концентрацию антагониста рецептора ИЛ-1, активирует последний. Действие оксида азота также проявляется в процессах апоптоза хондроцитов. ИЛ-1-бета наиболее агрессивный, конституционально не экспрессируется, вырабатывается только при воспалении. Выявлена определенная корреляция между ИЛ-1-бета и активностью течения остеоартроза.
Препарат диацереин известен ревматологам с начала 2000-х гг. Диацереин является ацетилированной формой реина. Сырьем для препарата служит эмодин, получаемый из алоэ.
При остеоартрозе диацереин влияет на ИЛ-1, трансформирующий фактор роста (ТФР), активные формы кислорода (АФК). Диацереин подавляет индуцированную ИЛ-1 экспрессию ферментов, вызывающих деградацию хряща, таких как аггреканаза, ММП, глюкозидаза.
Еще один механизм действия препарата – усиление экспрессии ТФР-бета-1 и -бета-2. Как следствие, активируется синтез протеогликанов и коллагена, снижается уровень ферментов, разрушающих хрящ, активация простагландинов. АФК стимулируют апоптоз хондроцитов и ингибируют синтез матрикса, а диацереин блокирует эти механизмы. В результате воздействия диацереина происходит стимуляция пролиферации хондроцитов, увеличивается объем матрикса и восстанавливаются свойства синовиальной жидкости и синтез гиалуроновой кислоты. Профессор Р.М. Балабанова привела результаты ряда исследований, посвященных изучению эффективности и безопасности диацереина.
В многоцентровом исследовании определяли оптимальную терапевтическую дозу диацереина. 484 пациента с гонартрозом получали препарат в трех дозах – 50, 100 и 150 мг/сут в течение 16 недель. Применение всех трех доз имело преимущество перед плацебо по всем клиническим параметрам (боль, индекс WOMAC), но побочные явления (послабление стула) развивались чаще при приеме дозы 150 мг/сут8. Таким образом, наиболее эффективная доза диацереина – 100 мг/сут. Дозу препарата увеличивать не следует.
Профессор Р.М. Балабанова отметила, что купирование боли у пациентов с артрозом, принимающих диацереин, достигается при дозе 100 мг/сут. Побочный эффект препарата в виде послабления стула в большинстве случаев носит временный характер (в первые две недели) и впоследствии нивелируется. Под действием препарата изменяется цвет мочи. Об этом надо обязательно предупреждать пациентов.
Результаты клинического исследования структурно-модифицирующего эффекта диацереина при коксартрозе показали (кривая Каплана – Мейера) более высокую долю пациентов без выявленного рентгенологического прогрессирования остеоартроза в группе диацереина по сравнению с группой плацебо.
Особое внимание докладчик обратила на результаты рандомизированного исследования с участием 507 пациентов с первичным коксартрозом. Способность диацереина замедлять прогрессирующее сужение суставной щели в тазобедренном суставе оценивали на протяжении трех лет. Рентгенографию суставов для оценки ширины суставной щели проводили до начала исследования, а затем ежегодно. Средняя прогрессия сужения суставной щели была стабильной в группе плацебо (0,19 мм/год) в отличие от группы диацереина. У пациентов, принимавших диацереин, по мере увеличения длительности приема препарата отмечалось замедление сужения суставной щели: в первый год – на 0,18 мм, во второй – на 0,14 мм, в третий – на 0,13 мм. В группе диацереина протективное действие на хрящ составило 32%, снизилась также необходимость в тотальном протезировании тазобедренного сустава9.
В пятимесячном наблюдении за 168 пациентами с остеоартрозом коленных суставов отмечался выраженный период (два месяца) последействия диацереина по окончании терапии (по сравнению с эффектом плацебо). Переносимость препарата была хорошей, статистически значимых нежелательных явлений не наблюдалось10.
В сравнительном исследовании 171 больной гонартрозом получал диацереин 100 мг/сут или пироксикам 20 мг/сут в течение 16 недель. В последующие восемь недель терапию отменяли. Анальгетический эффект, достигнутый к моменту окончания лечения, сохранялся в течение еще двух месяцев у больных, принимавших диацереин, и отсутствовал у тех, кто получал пироксикам11.
В кохрановском обзоре (2006) обобщены данные семи рандомизированных контролируемых исследований с участием свыше 2000 пациентов. Метаанализ продемонстрировал невысокую, но постоянную эффективность диацереина при остеоартрозе (остеоартрите). Диацереин достоверно значимо уменьшал боль по сравнению с плацебо при остеоартрозе (остеоартрите) коленных и тазобедренных суставов. Структурно-модифицирующий эффект доказан при остеоартрозе тазобедренных суставов.
Таким образом, согласно результатам клинических исследований диацереин является перспективным препаратом для лечения различных форм остеоартроза. Препарат улучшает функции опорно-двигательного аппарата как в период активного приема, так и в период последующего наблюдения за больными. В отношении уменьшения боли диацереин так же эффективен, как НПВП, но не вызывает побочных эффектов, характерных для НПВП. Большинство больных остеоартрозом относятся к старшей возрастной группе с высоким процентом коморбидных заболеваний, в том числе сердечно-сосудистых. Поэтому при лечении таких пациентов необходимо учитывать возможные осложнения. Обезболивающий и структурно-модифицирующий эффект препарата диацереин, его эффективность и безопасность способствуют повышению качества жизни пациентов с остеоартрозом.
Заключение
Препарат диацереин, представляющий собой ацетилированную форму реина, характеризуется симптом-модифицирующими и структурно-модифицирующими свойствами. Механизм его действия связан с ингибицией синтеза и блокированием активности ИЛ-1. После приема внутрь диацереин быстро абсорбируется из желудочно-кишечного тракта и полностью деацетилируется до реина. Прием препарата одновременно с пищей увеличивает биодоступность на 25%.
В клинических исследованиях продемонстрирована эффективность диацереина в отношении влияния на боль и функциональное состояние суставов. Клинический эффект препарата, проявляющийся уменьшением боли и улучшением функции суставов, развивается со второй – четвертой недели лечения и сохраняется после прекращения приема препарата в течение одного – трех месяцев.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.