Безопасная симптом-модифицирующая терапия остеоартрита у коморбидных пациентов с высоким кардиоваскулярным риском
- Аннотация
- Статья
- Ссылки
- English
Основное патогенетическое действие диацереина при ОА заключается в ингибировании синтеза интерлейкина 1, стимуляции синтеза протеогликанов суставного хряща, а также в замедлении аномального ремоделирования субхондральной кости.
В статье представлены преимущества диацереина у коморбидных пациентов с ОА, в частности пролонгированный противовоспалительный и анальгетический эффект в сочетании с хорошей переносимостью. Это обеспечивает контроль симптомов ОА и повышение качества жизни больных.
Структурно-модифицирующее действие диацереина способствует снижению риска прогрессирования ОА и отсрочке тотального эндопротезирования суставов. Диацереин также оказывает положительное метаболическое воздействие у лиц с сахарным диабетом 2 типа и ожирением. Так, он снижает уровень гликированного гемоглобина и индекс массы тела. Отсутствие сердечно-сосудистых осложнений на фоне терапии диацереином позволяет рекомендовать его больным ОА с кардиоваскулярной коморбидностью, особенно при наличии противопоказаний для применения нестероидных противовоспалительных препаратов.
Основное патогенетическое действие диацереина при ОА заключается в ингибировании синтеза интерлейкина 1, стимуляции синтеза протеогликанов суставного хряща, а также в замедлении аномального ремоделирования субхондральной кости.
В статье представлены преимущества диацереина у коморбидных пациентов с ОА, в частности пролонгированный противовоспалительный и анальгетический эффект в сочетании с хорошей переносимостью. Это обеспечивает контроль симптомов ОА и повышение качества жизни больных.
Структурно-модифицирующее действие диацереина способствует снижению риска прогрессирования ОА и отсрочке тотального эндопротезирования суставов. Диацереин также оказывает положительное метаболическое воздействие у лиц с сахарным диабетом 2 типа и ожирением. Так, он снижает уровень гликированного гемоглобина и индекс массы тела. Отсутствие сердечно-сосудистых осложнений на фоне терапии диацереином позволяет рекомендовать его больным ОА с кардиоваскулярной коморбидностью, особенно при наличии противопоказаний для применения нестероидных противовоспалительных препаратов.
Введение
Остеоартрит (ОА) является одной из наиболее часто встречающихся патологий опорно-двигательного аппарата [1]. Количество пациентов с ОА постоянно растет, что связано с увеличением продолжительности жизни населения и накоплением факторов риска развития заболевания [2]. Данные эпидемиологических исследований превышают данные официальной статистики Минздрава России. Согласно результатам эпидемиологических исследований, распространенность ОА коленного и (или) тазобедренного суставов среди лиц старше 18 лет достигает 13% [3]. Официальное число больных в Российской Федерации составляет более 4 млн, реальное – может достигать 15 млн [4].
Остеоартрит относится к болезням с высоким уровнем коморбидности [5, 6]. Наиболее часто ему сопутствуют артериальная гипертензия, атеросклероз, ишемическая болезнь сердца, ожирение, сахарный диабет (СД), заболевания желудочно-кишечного тракта, хроническая обструктивная болезнь легких [7, 8].
К общим факторам повышенного риска смерти при первичном ОА и кардиоваскулярных заболеваниях относят возраст, избыточный вес, наследственность, метаболические нарушения (гиперхолестеринемия, нарушение толерантности к глюкозе, сахарный диабет), а также применение нестероидных противовоспалительных препаратов (НПВП) [9, 10]. В патогенезе кардиоваскулярных осложнений при ОА также нельзя исключать роль хронического болевого синдрома. Важным фактором, усугубляющим течение кардиоваскулярных заболеваний у страдающих ОА, является ограничение физической активности. В то же время возникновение ОА и его прогрессирование могут быть следствием атеросклеротических изменений в кровеносных сосудах субходральной кости [11, 12]. Ишемия субхондральной кости способна приводить к апоптозу остеоцитов в субхондральной кости, что вызывает резорбцию остеокластов [13]. Ожирение, метаболический синдром и сахарный диабет ассоциируются с формированием инсулинорезистентности вследствие уменьшения содержания инсулина в крови и снижения чувствительности тканей к нему [14]. Воздействие на хондроциты высокой концентрации внеклеточной глюкозы приводит к катаболическим изменениям в хряще и, следовательно, развитию или прогрессированию ОА [15].
В связи со сказанным ранее проблема курации коморбидных пациентов с ОА является сложной задачей и требует индивидуального подхода [16].
За последние годы в зарубежных и отечественных клинических рекомендациях по лечению ОА акцент делается на раннем применении нефармакологических методов и симптоматических медленно действующих лекарственных средств (Symptomatic Slow-Acting Drugs in Osteoarthritis – SYSADOAs). Использование НПВП у пациентов с коморбидностью ограниченно [17].
На сегодняшний день установлено, что SYSADOAs способны уменьшить выраженность основных симптомов заболевания и потребность в анальгетической терапии [18].
Диацереин и его плейотропные эффекты
Опыт применения диацереина насчитывает более 20 лет. Препарат включен в клинические рекомендации по лечению ОА Ассоциации ревматологов России 2021 г. и Европейского общества по клиническим и экономическим аспектам остеоартрита и остеопороза 2019 г.
Диацереин рекомендован при ОА коленного и тазобедренного суставов в качестве симптоматического средства замедленного действия для уменьшения боли и альтернативы НПВП или парацетамолу [19].
Основной механизм действия диацереина направлен на блокирование экспрессии интерлейкинов (ИЛ) 1β и 6, а также фактора некроза опухоли (ФНО) α [20]. Реин, являющийся активным метаболитом диацереина, блокирует активацию и транслокацию транскрипционного фактора kB (NF-kB) в ядро, снижая экспрессию NF-kB-зависимых генов, включая гены, ответственные за продукцию ИЛ-1, ИЛ-6, ФНО-α, оксида азота (NO), которые способствуют деградации компонентов хрящевого матрикса [21]. Диацереин блокирует продукцию металлопротеиназ (коллагеназы и стромелизина), угнетает высвобождение лизосомальных ферментов (β-глюкуронидазы, эластазы, миелопероксидазы), а также стимулирует синтез протеогликанов, гликозаминогликанов и гиалуроновой кислоты [21].
Основное патогенетическое действие диацереина при ОА – блокирование синтеза ИЛ-1 было подтверждено в исследованиях на культуре мышиных макрофагов брюшины, культуре клеток синовии и хондроцитов больных ОА [22]. Кроме того, диацереин и реин уменьшают число ИЛ-1-рецепторов на поверхности хондроцитов, что способствует снижению чувствительности клеток к ИЛ-1. Диацереин и его метаболит опосредованно повышают концентрацию антагонистов рецепторов ИЛ-1, как следствие, блокируется нисходящий сигнальный путь. Реин блокирует и восходящий путь сигналинга киназ – МЕК/ERК, особенно в условиях гипоксии хондроцитов [23]. Диацереин и реин снижают образование NO более чем на 80% в эксплантатах хряща больных ОА и культуре клеток хондроцитов, а также ИЛ-1-индуцированную выработку индуцибельной NO-синтазы.
Доказано, что диацереин стимулирует синтез протеогликанов суставного хряща при длительном применении, а также предупреждает аномальное ремоделирование субхондральной кости за счет снижения синтеза резорбтивных ферментов (катепсина К), блокирования дифференцировки и пролиферации преостеокластов в зрелые остеокласты [21].
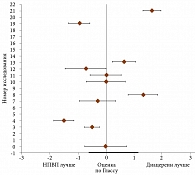
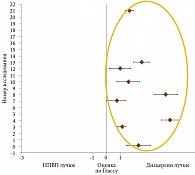
Результаты метаанализа 19 рандомизированных клинических исследований эффективности и безопасности диацереина у пациентов с ОА тазобедренного и коленного суставов подтверждают его выраженный обезболивающий эффект, сравнимый с эффектом НПВП в конце лечения (рис. 1) и превосходящий таковой через три месяца после его отмены (рис. 2) [24].
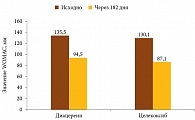
Результаты международного многоцентрового двойного слепого рандомизированного исследования DISSCO [25], в котором оценивалась динамика болевого синдрома по индексу остеоартрита Университетов Западного Онтарио и Макмастера (Western Ontario and McMaster University Osteoarthritis Index – WOMAC) у пациентов с ОА коленного сустава второй и третьей стадий по Келлгрену – Лоуренсу и выраженностью боли по визуальной аналоговой шкале (ВАШ) 4 и более, получавших целекоксиб в дозе 200 мг/сут (n = 193) или диацереин в дозе 100 мг/сут (n = 187) в течение шести месяцев, свидетельствовали об отсутствии достоверных различий в исследуемых группах по завершении лечения (рис. 3). На основании полученных данных были сделаны следующие выводы: при ОА коленного сустава, сопровождающемся умеренной и сильной болью, диацереин так же эффективен, как целекоксиб, помимо этого он обладает хорошим профилем безопасности и переносимости, соотношение пользы и риска позволяет рассматривать диацереин в качестве альтернативы ингибиторам циклооксигеназы 2.
Заслуживают внимания результаты открытого рандомизированного контролируемого трехмесячного исследования эффективности и переносимости диацереина у больных ОА коленного сустава с вторичным рецидивирующим синовитом [26]. Основная группа (n = 68) получала диацереин в дозе 100 мг/сут, группа сравнения (n = 65) – хондроитина сульфат в сочетании с глюкозамина сульфатом по 1000 мг/сут в дополнение к мелоксикаму в дозе 7,5 мг/сут. Через три месяца терапии в обеих группах выявлено снижение боли по ВАШ и повышение функциональной активности по индексу Лекена. По окончании лечения в основной группе увеличения выпота в полость пораженного сустава не обнаружено (с 5,86 ± 3,10 до 6,12 ± 1,09 мл; р > 0,05). В группе сравнения выявлено существенное скопление экссудата (с 21,70 ± 6,29 до 29,16 ± 3,63 мл; р < 0,05).
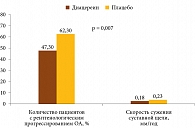
Структурно-модифицирующее действие диацереина подтверждено в трехлетнем наблюдательном плацебо-контролируемом исследовании ECHODIAH [27]. В нем приняли участие 507 пациентов с ОА тазобедренного сустава. К концу наблюдения в группе диацереина по сравнению с группой плацебо были достоверно меньше количество больных с рентгенологическим прогрессированием ОА и скорость сужения суставной щели (рис. 4). Прогрессивное уменьшение суставной щели (не менее чем на 0,5 мм) на фоне терапии диацереином наблюдалось реже и в более поздние сроки, чем при приеме плацебо. В группе плацебо средняя прогрессия сужения суставной щели была стабильной. В группе диацереина в первый год скорость сужения суставной щели составила 0,18 мм/год, во второй – 0,14 мм/год, в конце третьего – 0,13 мм/год. Таким образом, было зафиксировано замедление сужения суставной щели по мере увеличения длительности приема препарата. Тотальное протезирование тазобедренного сустава в период лечения и через три месяца по его завершении в группе диацереина проведено у 14,5%, в группе плацебо – у 19,8%.
Л.Н. Елисеева и соавт. провели наблюдательное исследование эффективности и безопасности диацереина (препарата Диартрин) в условиях реальной клинической практики [28]. Эффективность и безопасность диацереина (Диартрина) у пациентов с ОА оценивались ретроспективно. В исследовании приняли участие 28 больных гонартритом и 25 больных коксартритом третьей и четвертой стадий, включенных в лист ожидания для тотального эндопротезирования со сроком предполагаемого хирургического вмешательства более чем через три-четыре месяца. Диартрин назначался в дозе 50 мг/сут в течение первых трех-четырех недель с последующим увеличением дозы до 50 мг два раза в день. Анальгетическая эффективность препарата оценивалась с помощью ВАШ (0–100 мм), безопасность – по наличию побочных эффектов, в том числе со стороны желудочно-кишечного тракта, а также по изменению лабораторных показателей. Средний возраст пациентов с коксартритом составил 62,2 ± 3,4 года, с гонартритом – 60,0 ± 4,6 года. Интенсивность болевого синдрома, оцениваемая по ВАШ, исходно составляла 68,3 ± 11,3 мм у пациентов с коксартритом и 70,6 ± 8,8 мм у больных гонартритом. На фоне проводимой терапии выраженность боли снизилась до 56,0 ± 10,2 и 42,1 ± 9,3 мм соответственно. При этом потребность в НПВП сократилась с 92,0 до 64,0% у пациентов с коксартритом и с 92,86 до 85,71% у пациентов с гонартритом. В пред- и послеоперационный период побочных эффектов диацереина (препарата Диартрин) не отмечено. При оценке гликемии и уровня креатинина с расчетом скорости клубочковой фильтрации изменений на фоне терапии не зафиксировано. Полученные данные позволили сделать вывод о том, что включение в комплексную терапию диацереина (препарата Диартрин) позволяет отказаться от НПВП или значительно снизить их дозы при сохранении анальгетического и противовоспалительного эффектов. Отсутствие значимых побочных и нежелательных явлений свидетельствовало о безопасности диацереина у лиц с ОА и коморбидными состояниями. Таким образом, Диартрин является безопасным средством у коморбидных пациентов, особенно при наличии противопоказаний для назначения НПВП.
В настоящее время опубликовано достаточное количество работ о положительном влиянии диацереина на углеводный и липидный обмены. Кроме того, представлены доказательства его гепатопротективных и противоопухолевых эффектов. Установлено также положительное влияние препарата на регуляцию функции щитовидной железы, снижение риска развития язвенного колита, язвы желудка, почечной недостаточности, при буллезном эпидермолизе и заболеваниях пародонта [29].
Наибольший практический интерес представляют результаты исследований метаболического действия диацереина у коморбидных пациентов с СД 2 типа и ожирением [30].
У мышей, вскармливаемых пищей с высоким содержанием насыщенных жиров, диацереин улучшал состояние эндоплазматического ретикулума и уровень глюкозы натощак, способствовал снижению инфильтрации макрофагами жировой ткани, а также экспрессии и активности провоспалительных медиаторов. Указанные изменения сопровождались повышением чувствительности тканей к инсулину, преимущественно в печени и жировой ткани. Таким образом, терапия диацереином уменьшала инсулинорезистентность при ожирении за счет подавления субклинического воспаления. Авторы исследования предположили, что препарат может стать альтернативной при коррекции инсулинорезистентности [31].
Исследовалось также влияние диацереина на секрецию инсулина и метаболический контроль у пациентов с СД 2 типа [30]. В частности, было проведено рандомизированное двойное слепое плацебо-контролируемое клиническое исследование в отношении 40 взрослых пациентов с СД 2 типа, не получавших медикаментозного лечения. В нем оценивалось влияние диацереина на метаболический профиль, включая уровень ИЛ-1β, ФНО-α, ИЛ-6, глюкозы натощак, исходно и через два месяца по окончании исследования. После рандомизации 20 пациентов в течение первых 15 дней получали диацереин в дозе 50 мг/сут, далее в течение 45 дней – в дозе 50 мг два раза в сутки. Другие 20 пациентов принимали плацебо. После приема диацереина наблюдался значительный рост начальной (102 ± 63 против 130 ± 75 пмоль/л; р < 0,01) и общей секреции (178 ± 91 против 216 ± 99 пмоль/л) инсулина. Отмечено также значительное снижение гликемии натощак (7,9 ± 1,4 против 6,8 ± 1,0 ммоль/л) и уровня гликированного гемоглобина (HbA1c) (8,3 ± 1,0 против 7,0 ± 0,8%; р ≤ 0,001).
Аналогичные данные были получены в систематическом обзоре и метаанализах результатов пяти [32], а также семи рандомизированных клинических исследований [33], в которых оценивалось влияние диацереина на кардиометаболический профиль у пациентов с СД 2 типа. Установлено, что лечение диацереином лиц с ОА и сопутствующим СД 2 типа позволило достичь снижения уровня HbA1c (средняя взвешенная разница -0,73 при 95%-ном доверительном интервале (ДИ) -1,25– -0,21; р = 0,006) и индекса массы тела (средняя взвешенная разница -0,55 (95% ДИ -1,03– -0,07; р = 0,026)).
Согласно данным, представленным К.Ю. Широковой, трехмесячный курс диацереина у больных ОА коленного сустава, страдавших также СД 2 типа, не влиял на жировую массу тела и показатели липидного обмена. Однако у лиц с СД 2 типа наблюдалось снижение препрандиальной гликемии, улучшение функции β-клеток поджелудочной железы и чувствительности к инсулину по метаболическому индексу [34].
Положительное влияние диацереина на эндотелиальную функцию у пациентов с ОА и артериальной гипертензией продемонстрировано в работе Ю.П. Успенского и соавт. [35]. В открытом проспективном когортном исследовании приняли участие 47 пациентов в возрасте от 44 до 69 лет, страдавших ОА коленного сустава первой и второй стадий. Предшествующая анальгетическая и симптоматическая терапия ОА была сопоставимой. У всех включенных в исследование диагностирована артериальная гипертензия первой и второй степени. Все пациенты получали гипотензивные препараты (ингибиторы ангиотензинпревращающего фермента, антагонисты кальция и др.). В течение всего периода наблюдения гипотензивная терапия продолжалась теми же препаратами в стабильных дозах. В исследование включали пациентов с ранее выявленным гонартритом первой и второй стадий, который сопровождался болевым синдромом не менее 40 мм по ВАШ. В исследование не включали лиц с тяжелой коморбидной патологией, такой как ишемическая болезнь сердца, сердечная недостаточность, сахарный диабет, выраженные нарушения функции печени и почек. Участники исследования были рандомизированы блочным методом на две группы. Основная группа получала диацереин в дозе 50 мг два раза в день и парацетамол, контрольная группа – парацетамол. Период наблюдения составил 45 дней. Оценивали выраженность болевого синдрома по ВАШ и значения индекса Лекена. Оценка проводилась дважды – на момент включения в исследование и через 45 дней от начала терапии. Для определения степени эндотелиальной дисфункции использовался метод J. Hladoveс, который заключается в изоляции клеток эндотелия. После 45-дневного периода наблюдения у пациентов обеих групп снизились значения индекса Лекена и ВАШ. Потребность в парацетамоле и количество циркулирующих эндотелиоцитов уменьшились только в основной группе.
С учетом способности диацереина блокировать синтез и активность провоспалительных цитокинов, таких как ИЛ-1β, ИЛ-6, ФНО-α, и гипотезы вовлечения воспалительного ответа в патогенез ремоделирования левого желудочка после инфаркта миокарда на экспериментальной модели индуцированного инфаркта миокарда у крыс была предпринята попытка изучить влияние диацереина на желудочковое ремоделирование [36]. Основная группа получала диацереин в дозе 80 мг/кг/сут, группа контроля – физиологический раствор. In vivo установлено, что лечение диацереином один раз в день в течение четырех недель после инфаркта миокарда по сравнению с контролем снижало конечные диастолический и систолический объемы и фиброз левого желудочка. Исходя из полученных данных был сделан вывод об улучшении желудочкового ремоделирования при приеме диацереина за счет частичного блокирования пути ядерного фактора транскрипции.
Заключение
Многочисленные проспективные когортные исследования, посвященные эффективности диацереина при ОА, дают основание полагать, что преимуществом препарата является пролонгированное противовоспалительное и анальгетическое действие, а также хорошая переносимость, что обеспечивает контроль симптомов ОА и повышение качества жизни пациентов. Структурно-модифицирующий эффект препарата связан со стимуляцией синтеза протеогликанов суставного хряща и предупреждением аномального ремоделирования субхондральной кости, что способствует снижению риска прогрессирования ОА и отсрочке тотального эндопротезирования суставов.
Важно отметить, что диацереин может использоваться в качестве анальгетика для улучшения функционального состояния суставов у больных ОА с ожирением и СД 2 типа. Для достижения развернутого клинического эффекта у таких пациентов требуется как минимум трехмесячный курс диацереина в дозе 100 мг/сут. Кроме того, диацереин у лиц с ОА с сопутствующим СД 2 типа может применяться в составе комплексной терапии для достижения более значимой компенсации гипергликемии.
Согласно клиническим рекомендациям Российского научного медицинского общества терапевтов по ведению больных ОА с коморбидностью, ряд пациентов с кардиоваскулярными заболеваниями имеют существенные ограничения для назначения НПВП при болевом синдроме [37]. В связи с этим представляется значимым тот факт, что на протяжении более чем 20 лет применения диацереина не зарегистрировано ни одного сообщения о развитии острого коронарного синдрома. Отсутствие данных в отношении развития кардиоваскулярных осложнений на фоне применения диацереина позволяет рекомендовать его больным ОА с кардиоваскулярной коморбидностью, особенно при наличии противопоказаний для приема НПВП.
I.B. Belyayeva, MD, PhD, Prof., V.I. Mazurov, Academician of the RASci., MD, PhD, Prof.
North-Western State Medical University named after I.I. Mechnikov
Clinical Rheumatology Hospital No. 25, St. Petersburg
Contact person: Irina B. Belyayeva, belib@mail.ru
The review presents an analysis of the therapeutic effect of the drug diacerein in osteoarthritis (OA). The experience of using diacerein has more than 20 years. This drug is included in the clinical recommendations for the treatment of osteoarthritis (OA) of the Association of Rheumatologists of Russia 2021 and the European Society of Clinical and Economic Aspects of Osteoarthritis and Osteoporosis 2019.
The main pathogenetic effect of diacerein in OA is to inhibit the synthesis of interleukin 1, stimulate the synthesis of proteoglycans of articular cartilage, as well as slow down the abnormal remodeling of the subchondral bone.
The article presents the advantages of diacerein in the treatment of comorbid patients with OA, which are associated with its prolonged anti-inflammatory and analgesic effects, as well as with good tolerability, which allows controlling symptoms and improving the quality of life of patients with OA.
The structural-modifying effect of diacerein helps to reduce the risk of progression of OA and delay total joint replacement. Diacerein also has a positive metabolic effect in patients with type 2 diabetes and obesity, which is associated with its ability to reduce the level of glycated hemoglobin and body mass index. The absence of cardiovascular complications on the background of diacerein therapy allows us to recommend it in patients with OA with cardiovascular comorbidity and in the presence of contraindications for nonsteroidal anti-inflammatory drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.