Информативность лейкоцитарных индексов и скорости оседания эритроцитов как показателей хронической эндогенной интоксикации в динамике стационарного лечения пациентов с хроническим риносинуситом и хроническим тонзиллитом
- Аннотация
- Статья
- Ссылки
- English
Эндогенная интоксикация (ЭИ) – полиэтиологичный и полипатогенетичный синдром, характеризующийся накоплением в тканях и биологических жидкостях эндогенных токсических субстанций – избытка продуктов нормального или извращенного обмена веществ или клеточного реагирования [1].
В литературе интоксикационный синдром интерпретируется как головная боль, слабость, гипертермия [2]. При острых заболеваниях ЛОР-органов клиническая картина интоксикации проявляется достаточно ярко и подтверждается изменениями в общеклиническом анализе крови (лейкоцитоз, сдвиг лейкоцитарной формулы влево, повышение скорости оседания эритроцитов (СОЭ), острофазовых белков крови) [1, 2]. В основном в специальной литературе по оториноларингологии рассматриваются вопросы лабораторной диагностики при острых заболеваниях небных миндалин (ангины) и остром риносинусите [3, 4]. Но интоксикационному синдрому, а именно ЭИ, при хронических заболеваниях ЛОР-органов и лабораторным методам исследования не уделяется должного внимания.
Общеклинические анализы крови при хронических заболеваниях зачастую неинформативны, хотя ЭИ при длительном и вялотекущем хроническом воспалении ЛОР-органов присутствует [2, 5]. Подтверждение тому – название классификации хронического тонзиллита (токсико-аллергическая форма) [2]. При установлении клинического диагноза врач-клиницист основывается на жалобах пациента, анамнезе, клинических симптомах заболевания и результатах объективных методов исследования, в том числе лабораторной диагностики. Изучению ЭИ посвящен ряд работ, в частности, по гнойной хирургии, инфекционным заболеваниям, терапии (при недостаточности функции внутренних органов), разработаны лабораторные методы диагностики (лейкоцитарные индексы интоксикации, анализ молекул средней массы в крови, альбуминовые тесты, оценка состояния эритрона, оценка острофазовых белков крови) [6–12].
Цель настоящей работы – изучить динамику лейкоцитарных индексов и СОЭ, проанализировать их информативность как показателей хронической ЭИ при стационарном лечении пациентов с хроническим риносинуситом и хроническим тонзиллитом.
Материал и методы
Проведено клинико-лабораторное обследование и лечение пациентов, находившихся на стационарном лечении в оториноларингологическом отделении Городской клинической больницы № 3 г. Тамбова. Всем пациентам выполнено хирургическое и медикаментозное лечение. Группы исследования представляли 56 пациентов с хроническим тонзиллитом (ХТ) декомпенсированной формы, 67 больных хроническим полипозным риносинуситом (ХПР), 82 пациента с хроническим риносинуситом, сопровождавшимся гнойным процессом в околоносовых пазухах (ХГР). В контрольную группу вошли 120 практически здоровых лиц без существенных отклонений показателей лабораторных исследований. Возраст пациентов составил от 18 до 60 лет. В каждой группе пациенты были разделены на подгруппы по гендерному признаку, в каждой из которых были выделены три возрастные подгруппы: 18–31, 32–45 и 46–60 лет. Исключение составила группа ХТ (пациенты 46–60 лет не принимали участие в исследовании).
Критериями исключения из исследования были бронхиальная астма, сахарный диабет, установленные заболевания крови, вирусные гепатиты (В, С) и ВИЧ-инфекция, системные заболевания соединительной ткани, указанные в анамнезе почечная и печеночная недостаточность, беременность.
В исследовании оценивали количество лейкоцитов, СОЭ, лейкоцитарный индекс интоксикации (ЛИИ) по формуле Я.Я. Кальф-Калифа (1941 г.) (ЛИИ = (4Ми + 3ЮН + 2П + С) × (Пл + 1) / (Л + Мо) × (Э + 1), где Ми – миелоциты, ЮН – юные нейтрофилы, П – палочкоядерные нейтрофилы, С – сегментоядерные нейтрофилы, Пл – плазматические клетки, Л – лимфоциты, Мо – моноциты, Э – эозинофилы), а также индекс сдвига (ИС) (соотношение показателей: (миелоциты + метамиелоциты + палочкоядерные нейтрофилы)/сегментоядерные нейтрофилы); индекс инфицированности (ИИ) (соотношение показателей: лимфоциты / (миелоциты + юные нейтрофилы + палочкоядерные нейтрофилы + сегментоядерные нейтрофилы) по данным общеклинического анализа крови. В группах с патологией забор анализов крови проводили дважды: до операции (д/о) и на седьмые сутки после операции (п/о).
Нормальные значения ЛИИ варьируются в пределах 0,3–1,5, ИС – в пределах 0,05–0,08, ИИ у взрослых составляет 0,3.
Статистическую обработку данных при оценке результатов лабораторного обследования выполняли с помощью пакета программ STATISTICA 6.0. Уровни всех показателей описывались с помощью медианы и интерквартильного размаха (Me [25%; 75%]). Достоверность различий показателей между группами оценивали непараметрическими методами статистического анализа в зависимости от вида распределения исследуемого признака. За норму принимали предлагаемые нормативы для соответствующих наборов, методов и используемых анализаторов. Статистически значимыми считали различия при p < 0,05. При выявлении связей между исследуемыми тестами применяли корреляционный анализ по методу Спирмена. Оценка чувствительности и специфичности изменений уровней тестов проведена с помощью многофакторного и ROC-анализа.
Результаты
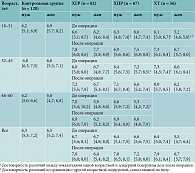
Лейкоциты
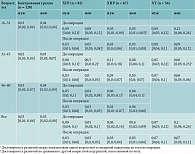
При сравнении количества лейкоцитов в общем анализе крови ни в одной из групп с патологией и контрольной группе, различных по половозрастным характеристикам, достоверной разницы показателей не обнаружено (табл. 1).
В группе ХГР до и после лечения ни в одной возрастной подгруппе (мужчины и женщины) не зафиксировано разницы в количестве лейкоцитов. В некоторых возрастных подгруппах пациентов с ХПР и ХТ отмечалась достоверная разница между показателями до и после лечения. Но показатели оставались в пределах референсных значений (независимо от пола ХПР р18–31 = 0,002 (до лечения – 6,6 [4,8; 7,4] × 109/л, после лечения – 7,4 [6,2; 8,4] × 109/л); независимо от пола ХТ р18–31 = 0,000 (до операции – 5,4 [4,7; 6,1] × 109/л; после операции – 6,8 [5,7; 8,1] × 109/л); ХТ р32–45 (мужчины) = 0,005 (до операции – 7,3 [4,5; 7,4] × 109/л; после операции – 8,0 [5,7; 8,5] × 109/л).
При сравнении количества лейкоцитов в группах с патологией и контрольной группе выявлена достоверная разница в младшей возрастной подгруппе независимо от пола у больных ХПР, ХГР и ХТ. Но показатели оставались в пределах референсных значений (ХГРп/о р18–31 = 0,02 (контроль18–31 – 6,3 [5,6; 7,6] × 109/л; ХГРп/о p18–31 – 7,8 [6,0; 8,6] × 109/л); ХПРп/о р = 0,002 (контроль – 6,3 [5,3; 7,3] × 109/л; ХПРп/о – 7,0 [6,0; 8,0] × 109/л); ХТ р18–31 = 0,007 (контроль18–31 – 6,3 [5,6; 7,6] × 109/л; ХТ18–31 д/о – 5,4 [4,7; 6,1] × 109/л). В других возрастных группах достоверной разницы показателей не выявлено.
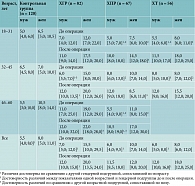
Скорость оседания эритроцитов
В группе ХГР при сравнении СОЭ внутри гендерных подгрупп выявлена достоверная разница у пациентов всех возрастов до и после лечения (до лечения р = 0,000 (мужчины – 7,0 [5,0; 12,0] мм/ч; женщины – 15,5 [10,0; 29,50] мм/ч); после лечения р = 0,002 (мужчины – 12,0 [10,0; 15,0] мм/ч; женщины – 20,0 [13,5; 24,0] мм/ч) (табл. 2).
При сравнении в возрастных подгруппах обнаружена достоверная разница у мужчин до лечения между группами 32–45 и 46–60 лет (р = 0,02 (мужчины32–45 – 6,0 [5,5; 7,0] мм/ч; мужчины46–60 – 11,0 [7,0; 25,0] мм/ч), у женщин после лечения между группами 18–31 и 46–60 лет (р = 0,01 (женщины32–45 – 17,5 [12,0; 20,0] мм/ч; женщины46–60 – 22,0 [18,0; 28,0] мм/ч). При анализе уровней показателей до и после лечения установлена разница у мужчин (р32–45 = 0,002 (мужчины32–45д/о – 6,0 [5,5; 7,0] мм/ч; мужчины32–45п/о – 12,0 [10,0; 13,5] мм/ч). При сравнении с контрольной группой (6,0 [5,0; 10,0] мм/ч) зафиксирована достоверная разница во всех возрастных группах независимо от пола (р = 0,000 (до операции – 12,0 [7,0; 22,0] мм/ч; после операции – 14,0 [10,0; 23,0] мм/ч).
Группа ХПР: зарегистрирована достоверная разница при сравнении всех возрастных групп по полу до операции (р = 0,003 (мужчиныд/о – 6,35 [5,7; 7,35] мм/ч; женщиныд/о – 6,6 [5,1; 7,5] мм/ч). При этом показатели были в пределах референсных значений. При анализе по возрасту выявлена достоверная разница у женщин после операции при сравнении попарно всех возрастных групп (р18–31 и 32–45 = 0,03, р32–45 и 46–60 = 0,003, р18–31 и 46–60 = 0,003 (женщины18–31 – 14,5 [12,0; 18,0] мм/ч; женщины32–45 – 8,5 [6,0; 11,0] мм/ч, женщины46–60 – 17,0 [12,0; 30,0] мм/ч). При анализе до и после лечения независимо от пола в младшей и старшей возрастных подгруппах установлена достоверная разница значений (р18–31 = 0,000 (до операции – 6,0 [5,0; 10,0] мм/ч; после операции – 12,0 [9,0; 18,0] мм/ч) и р46–60 = 0,000 (до операции – 8,0 [5,0; 12,0] мм/ч; после операции – 14,0 [10,0; 20,0] мм/ч). При сравнении с показателями контрольной группы до операции отмечалась достоверная разница в возрастной подгруппе 32–45 лет (р = 0,04 (контроль32–45 – 7,0 [5,0; 8,5] мм/ч; ХПРд/о 32–45 – 8,0 [7,0; 13,0] мм/ч), а после операции – во всех возрастных подгруппах (р = 0,000 (контроль – 6,0 [5,0; 10,0] мм/ч; ХПРп/о – 12,0 [9,0; 18,0] мм/ч).
При анализе групп ХГР и ХПР наблюдалась достоверная разница данного показателя во всех возрастных подгруппах до операции (р = 0,000 (ХГРд/о – 12,0 [7,0; 22,0] мм/ч; ХПРд/о – 8,0 [5,0; 11,0] мм/ч) и после операции (р = 0,01 (ХГРп/о – 14,0 [10,0; 23,0] мм/ч; ХПРп/о – 12,0 [9,0; 18,0] мм/ч).
Группа ХТ: при сравнении по полу достоверная разница выявлена до операции (р = 0,01 (мужчиныд/о – 6,0 [5,0; 8,0] мм/ч; женщиныд/о – 8,0 [6,0; 12,0] мм/ч) и после операции (р = 0,0148 (мужчинып/о – 12,0 [10,0; 16,0] мм/ч; женщинып/о – 18,0 [12,0; 25,0] мм/ч) во всех возрастных подгруппах. При анализе по возрасту достоверной разницы не зафиксировано.
При сравнении групп до и после лечения достоверная разница имела место во всех возрастных подгруппах (независимо от пола р18–31 = 0,000 (до операции – 7,0 [5,0; 10,0] мм/ч; после операции – 17,0 [10,0; 24,0] мм/ч);
р32–45 = 0,000 (до операции – 8,0 [6,0; 10,0] мм/ч; после операции – 15,0 [10,0; 18,0] мм/ч). При сравнении с контрольной группой выявлена достоверная разница до операции независимо от пола в младшей возрастной подгруппе (р18–31 = 0,04 (контрольная18–31 – 5,5 [4,0; 9,0] мм/ч; ХТ18–31д/о – 7,0 [5,0; 10,0] мм/ч), а после операции во всех возрастных группах (независимо от пола р = 0,000 (контроль – 6,0 [5,0; 10,0] мм/ч; ХТп/о – 15,50 [10,0; 22,0] мм/ч).
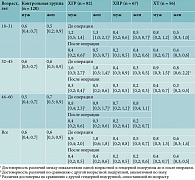
Лейкоцитарный индекс
При сравнении групп по полу достоверной разницы значений ЛИИ не выявлено в контрольной группе, группах ХПР и ХТ (табл. 3).
В группе с ХГР прослеживалась достоверная разница при сравнении показателей внутри группы по полу и возрасту, но все показатели оставались в пределах нормы. При анализе группы ХГР по полу установлена достоверная разница только после операции в подгруппе 32–45 лет (р = 0,008 (мужчины32–45 – 0,25 [0,2; 0,35]; женщины32–45 0,5 [0,23; 0,61]). При сравнении по возрасту достоверная разница отмечалась лишь у мужчин после операции между подгруппами 18–31 и 32–45 лет (р = 0,02 (мужчины18–31 – 0,4 [0,21; 0,6]; мужчины32–45 – 0,25 [0,2; 0,35]). При анализе в этой группе до и после лечения зафиксирована достоверная разница во всех возрастных подгруппах независимо от пола (р18–31 = 0,001 (до операции – 1,18 [0,82; 1,6]; после операции – 0,5 [0,30; 0,6]), р32–45 = 0,000 (до операции – 1,0 [0,4; 2,05]; после операции – 0,4 [0,21; 0,6]), р46–60 = 0,000 (до операции – 0,84 [0,40; 1,8]; после операции – 0,38 [0,2; 0,6]), медианы уменьшились почти в два раза. При сравнении группы ХГР и контрольной группы зарегистрирована разница до лечения (р = 0,000) и после лечения (р = 0,001) во всех возрастных подгруппах мужчин и женщин (контроль – 0,6 [0,34; 0,74]; ХГРд/о – 1,0 [0,5; 1,8]; ХГРп/о – 0,4 [0,2; 0,6]).
Анализ значений ЛИИ в группе ХПР показал, что при сравнении до и после лечения выявлена достоверная разница у мужчин 46–60 лет – р = 0,028 (до операции – 0,65 [0,2; 1,2]; после операции – 0,21 [0,2; 0,4]) и женщин 18–31 года – р = 0,04 (до операции – 0,5 [0,3; 0,7]; после операции – 0,35 [0,2; 0,6]), у мужчин медиана уменьшилась почти в три раза. При сравнении с контрольной группой выявлена достоверная разница только после лечения во всех возрастных подгруппах (р = 0,000 (контроль – 0,6 [0,34; 0,74]; после операции – 0,22 [0,19; 0,45]). При этом показатели оставались в пределах нормы.
При сравнении ЛИИ в группах ХГР и ХПР установлена достоверная разница (р = 0,000 (ХГРд/о – 1,0 [0,5; 1,8]; ХПРд/о – 0,42 [0,4; 0,89]) и после операции
(р = 0,02 (ХГРп/о – 0,4 [0,2; 0,6]; ХПРп/о – 0,22 [0,19; 0,45]) во всех возрастных подгруппах.
При анализе группы с ХТ достоверная разница показателей выявлена только в возрастной подгруппе 32–45 лет (до и после лечения разница у мужчин –
p = 0,01 (мужчины32–45д/o – 0,9 [0,28; 1,5]; мужчины32–45п/о – 0,41 [0,19; 0,7]) и женщин – р = 0,007 (женщины32–45д/о – 0,78 [0,55; 2,2]; женщины32–45п/о – 0,31 [0,2; 0,5]). По сравнению с контрольной группой достоверная разница независимо от пола отмечалась также в возрастной подгруппе 32–45 лет
(р = 0,02 (контроль32–45 – 0,6 [0,34; 0,78]; ХТ32–45д/о – 0,84 [0,55; 1,5]). При сравнении по возрасту выявлена достоверная разница у мужчин после операции между подгруппами 18–31 и 32–45 лет (р = 0,003 (мужчины18–31п/о – 0,91 [0,55; 1,2], мужчины32–45п/о – 0,35 [0,2; 0,54]).
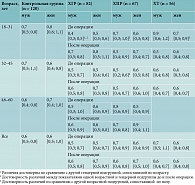
Индекс инфицированности
При сравнении значения ИИ в группах по полу достоверной разницы не выявлено в контрольной группе, группах ХПР и ХТ. В группе ХГР зафиксирована достоверная разница до операции в подгруппе 18–31 года (р = 0,04 (мужчины18–31 – 0,4 [0,3; 0,5]; женщины18–31 – 0,5 [0,5; 0,6]), но показатели были в пределах нормы (табл. 4).
В группе ХГР при сравнении по возрасту ни у мужчин, ни у женщин при анализе всех возрастных подгрупп между собой достоверной разницы не выявлено. При сравнении до и после лечения достоверная разница отмечалась только у мужчин 18–31 года (р = 0,03 (до операции – 0,4 [0,3; 0,5]; после операции – 0,7 [0,5; 0,8]). При сравнении с контрольной группой зафиксирована достоверная разница во всех возрастных подгруппах только до лечения (р = 0,000 (контроль – 0,6 [0,4; 0,84]; ИИ ХГР до операции – 0,5 [0,4; 0,7]).
В группе ХПР при сравнении значений ИИ у мужчин до лечения между собой в возрастных подгруппах 32–45 и 46–60 лет зарегистрирована достоверная разница (р = 0,01) и 18–31 и 46–60 лет (р = 0,01) (мужчины18–31 – 0,7 [0,3; 1,0]; мужчины32–45 – 0,5 [0,2; 0,6]; мужчины46–60 – 0,8 [0,6; 0,9]. При сравнении до и после лечения у мужчин и женщин всех возрастных подгрупп достоверных отличий между показателями не выявлено. При сравнении с контрольной группой также достоверной разницы не зарегистрировано. Достоверной разницы значений между группами ХГР и ХПР не установлено.
В группе ХТ при сравнительном анализе по возрасту обнаружена достоверная разница значений ИИ до операции у женщин возрастных подгрупп 18–31 и 32–45 лет (р = 0,03 (женщины18–31д/о – 0,7 [0,5; 0,9]; женщины32–45д/о – 0,4 [0,3; 0,6]). При сравнении ИИ до и после лечения достоверной разницы ни в одной возрастной и гендерной подгруппах не установлено. При сравнении с контрольной группой достоверная разница наблюдалась только после операции в возрастной подгруппе 18–31 года независимо от пола (р = 0,02 (контроль18–31 – 0,7 [0,5; 0,9]; ХТ18–31п/о – 0,6 [0,4; 0,8]).
Индекс сдвига
При сравнении показателей ИС в различных гендерных подгруппах достоверной разницы не выявлено ни в одной группе с патологией ЛОР-органов, в том числе в контрольной (табл. 5).
Возрастные достоверные отличия установлены у женщин младшей и средней возрастных групп ХГР и ХПР: ХГР – только после операции (р = 0,006 (женщины18–31 – 0,05 [0,03; 0,08]; женщины32–45 – 0,0 [0,0; 0,03]); ХПР – до операции (р = 0,004 (женщины18–31 – 0,03 [0,01; 0,05]; женщины32–45 – 0,08 [0,06; 0,1]).
В группе ХГР при сравнении до и после лечения выявлена достоверная разница во всех возрастных подгруппах (независимо от пола р18–31 = 0,004 (ХГРд/о – 0,08 [0,06; 0,19]; ХГРп/о – 0,03 [0,02; 0,06]), р32–45 = 0,000 (ХГРд/о – 0,05 [0,01; 0,1]; ХГРп/о – 0,02 [0,0; 0,04]), р46–60 = 0,03 (до операции – 0,05 [0,02; 0,09]; после операции – 0,03 [0,01; 0,06]). При анализе показателей контрольной группы отмечалась достоверная разница во всех возрастных подгруппах независимо от пола только до лечения (р = 0,000 (контроль – 0,03 [0,01; 0,06]; ИС ХГРд/о – 0,06 [0,03; 0,1]). Но показатели не выходили за пределы нормальных значений.
Группа ХПР: при сравнении до и после лечения зафиксирована разница показателей ИС в возрастной подгруппе 46–60 лет у мужчин (р = 0,009 (мужчины46–60д/о – 0,06 [0,05; 0,2]; мужчины46–60п/о – 0,02 [0,01; 0,07]) и женщин (р = 0,04 (женщины46–60д/о – 0,08 [0,04; 0,1]; женщины46–60п/о – 0,06 [0,03; 0,06]). При сравнительном анализе ХГР и ХПР выявлена достоверная разница только в подгруппе 18–31 года до лечения (р = 0,003 (ХГРд/о – 0,08 [0,06; 0,19]; ХПРд/о – 0,04 [0,01; 0,06]).
Группа ХТ: до и после лечения установлена достоверная разница ИС только у женщин 32–45 лет (р = 0,04 (женщины3245д/о – 0,06 [0,03; 0,23]; женщины32–45п/о – 0,06 [0,03; 0,06]). При анализе результатов ИС во всех гендерных подгруппах в целом достоверной разницы до и после лечения не наблюдалось. При сравнении с контрольной группой установлена достоверная разница до лечения (р = 0,000 (контроль – 0,03 [0,01; 0,06]; ХТд/о – 0,09 [0,04; 0,23]) и после лечения (р = 0,000 (ХТп/о – 0,07 [0,03; 0,1]) независимо от пола и возраста.
При корреляционном анализе выявлена положительная корреляционная связь средней силы между отдельными показателями до лечения: в группе ХГС между лейкоцитами и СОЭ (r = 0,311; р = 0,004), в группе с ХТ между лейкоцитами и ЛИИ (r = 0,468; р = 0,000), между СОЭ и ИС (r = 0,373; р = 0,005).
Многофакторный анализ результатов показателей выявил в группе ХГР среднюю положительную корреляционную связь только между показателем ЛИИ и кодом группы (r = 0,361; р = 0,000). При этом ROC-анализ продемонстрировал чувствительность этого показателя, равную 62,2%, специфичность – 75,8%.
В группе ХПС установлена слабая корреляционная связь только между ИС и кодом группы (r = 0,229; р = 0,002); чувствительность – 61,7%, специфичность – 64,2%.
В группе ХТ ИС имел среднюю корреляционную связь с кодом группы (r = 0,423; р = 0,000); чувствительность показателя при проведении ROC-анализа – 60,7%, специфичность – 76,7%.
Обсуждение
Результаты анализа динамики эритроцитарных показателей, альбумина и острофазовых белков при хронических заболеваниях небных миндалин и околоносовых пазух как показателей эндогенной интоксикации при хронических заболеваниях ЛОР-органов опубликованы в наших предыдущих работах [5, 13]. Изучение динамики концентраций молекул средней массы не входило в задачи настоящего исследования, поскольку этот метод предполагает использование токсичного продукта (раствора трихлоруксусной кислоты) и специального оборудования (в лаборатории обычного городского стационара не применяется).
На основании анализа полученных нами данных можно сделать вывод, что количество лейкоцитов и значения лейкоцитарных индексов интоксикации не зависят от пола и возраста пациентов. Уровни лейкоцитов в исследовании достоверно отличались в динамике в группе пациентов с хронической патологией ЛОР-органов до и после лечения и от показателей контрольной группы. Однако, несмотря на наличие хронического очага инфекции, в том числе гнойного, при хронических заболеваниях ЛОР-органов, их уровни оставались в пределах референсных значений.
СОЭ служила более информативным показателем наличия воспалительного процесса в группах с патологией, достоверно различалась в возрастных и гендерных подгруппах и заметно менялась на протяжении госпитального лечения больных.
Повышение ЛИИ до 4–9 свидетельствует о значительном бактериальном компоненте, умеренное повышение 2–3 – о значительных некробиотических изменениях ткани [8, 9, 12]. ЛИИ при ХГР был умеренно повышен до лечения в отдельных возрастных и гендерных группах, в остальных группах находился в пределах нормы. После лечения его значения уменьшились почти в два раза и были в пределах нормы. При ХПР динамика показателя до и после лечения была положительной, поскольку его значения после лечения уменьшились почти в три раза. При этом все показатели оставались в пределах нормы. В группе с ХТ ЛИИ был умеренно повышен только до операции у женщин средней возрастной подгруппы. В остальных подгруппах ЛИИ хотя и менялся в динамике, его значения оставались в пределах нормы.
Снижение ИИ (Шаган, 1960 г.) коррелирует со степенью выраженности острофазового ответа при инфекции. На фоне инфекции он снижается до 0,1, в период реконвалесценции нормализуется (или возрастает) [8, 9, 12].
Значения ИИ достоверно различались только между группой ХГР и контрольной группой, но границы значений оставались выше значений инфицированности. В группе ХПР разницы показателей не выявлено ни до, ни после лечения. Существенной разницы между показателями контрольной группы не зафиксировано. Значения ИИ также оставались выше значений инфицированности и были близки к значениям практически здоровых людей.
Тяжесть степени заболевания по ИС: тяжелая – индекс от 1,0 и выше; средняя – индекс 0,3–1,0; легкая – индекс не более 0,3.
ИС был незначительно повышен в группе ХГР до операции, а у больных ХПР – до операции только в старшей возрастной подгруппе у мужчин и женщин. После лечения динамика показателей была положительной и значения соответствовали нормальным. В группе ХТ ИС был умерено повышен только у женщин средней возрастной подгруппы до лечения и динамика его после лечения также была положительной (в пределах нормы).
В исследовании выявлена низкая информативность значений лейкоцитов крови и лейкоцитарных индексов интоксикации, недостаточная для диагностики и подтверждения лабораторными методами хронической ЭИ у больных оториноларингологического профиля, поскольку эти показатели либо оставались в пределах нормы, либо умеренно повышались в отдельно взятых возрастных и гендерных подгруппах. Но эти показатели могут использоваться в качестве критериев мониторинга терапии, так как их динамика прослеживалась в процессе лечения.
Выводы
На основании изложенного указанные методы не могут широко применяться в клинической практике, поскольку при ЭИ у больных хроническими заболеваниями небных миндалин и околоносовых пазух на фоне лечения, в том числе оперативного, значимого практического применения не имеют, затрудняют своевременную и адекватную оценку состояния пациентов по степени выраженности тяжести ЭИ.
У пациентов с распространенными хроническими заболеваниями ЛОР-органов, находящихся на стационарном лечении, должны применяться наиболее чувствительные методы с высокой специфичностью и чувствительностью в отношении диагностики ЭИ.
M.V. Bychkova, D.V. Trusov, Ye.R. Kulyutsina, PhD, N.K. Pochinina, PhD
Tambov City Clinical Hospital № 3
PIFTPh – Branch Campus of the FSBEI FPE RМАСРЕ МОН Russia
Contact person: Marina V. Bychkova, bichcova_lor@mail.ru
In the study conducted on the basis of the otorhinolaryngology City Clinical Hospital No 3 in Tambov, in order to diagnose endogenous intoxication, the indicators of clinical blood analysis were compared: leukocytes, leukocyte intoxication indices (leukocyte intoxication index according to the formula Kalf-Kalifa, shift index, infection index), and their informative value was evaluated in chronic diseases, in particular in chronic rhinosinusitis (n = 149); and chronic tonsillitis (n = 56); equal to the control group (n = 120). The results of the study revealed a low specificity and low informativeness of these methods in assessing the indicators of blood analysis in the diagnosis of chronic endogenous intoxication, which makes it difficult to interpret and the degree of severity of endogenous intoxication.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.