Иммуноферментные методы в диагностике хронического синусита и хронического тонзиллита
- Аннотация
- Статья
- Ссылки
- English



Актуальность
Среди всех нозологических форм в структуре заболеваемости поликлинического и стационарного звена основную долю составляют заболевания околоносовых пазух [1–3] и небных миндалин [4]. Обращаемость по поводу хронического полипозного синусита составляет 3,7–5,8 на 10 тыс. человек [1]. На хронический тонзиллит (ХТ) приходится 23,7% всех заболеваний глотки [4]. Среди ургентных патологий глотки паратонзиллярные абсцессы (ПА) занимают первое место [5].
В настоящее время в отношении патогенеза хронического синусита (ХС) и ХТ остается много спорных и неясных вопросов. Поскольку существуют лимфогенные связи небных миндалин с другими органами, не исключено распространение токсических, метаболических, иммунореактивных, аллергических факторов с небных миндалин [4, 6]. Классификация ХТ Б.С. Преображенского и В.Т. Пальчуна объясняет токсико-аллергический характер заболевания, обусловленный в основном наиболее изученным этиологическим фактором данного заболевания – бета-гемолитическим стрептококком группы А [4, 6]. С этим возбудителем связано большинство описанных и доказанных метатонзиллярных осложнений: ревматизм, миокардит и заболевания клапанного аппарата сердца, нефропатия, обусловленная иммуноглобулином (Ig) А [4, 6, 7].
В патогенезе ХС, особенно полипозной формы, также много неясных моментов. Существует несколько теорий образования полипов в полости носа: инфекционная, в том числе грибковая, аллергическая. До сих пор не понятно, полипозный синусит – самостоятельное заболевание или проявление атопических системных заболеваний [4]. У каждой теории есть сторонники. В ряде исследований изучали роль гуморального и клеточного иммунитета при этом заболевании.
ХС и ХТ не являются очаговой патологией [8]. В литературе по оториноларингологии, касающейся лабораторной диагностики, в основном освещены вопросы определения уровней Ig, цитокинов в секрете слизистой оболочки и крови, показателей общеклинического анализа крови, антистрептолизина-О, ревматоидного фактора, С-реактивного белка (СРБ) (пентамера) [2, 4, 6].
Анализ крови на цитокины выполняет далеко не каждая лаборатория городской или районной больницы. Показатели общего анализа крови информативны лишь при явном гнойном процессе. При вялотекущем хроническом воспалении в околоносовых пазухах или небных миндалинах такой анализ неинформативен [9]. Например, уровень антистрептолизина-О повышается в ответ на перенесенную инфекцию, реакция проявляется только на 7–9-й день заболевания [10]. Что касается острофазовых показателей воспаления, обычно подтверждающих бактериальную инфекцию, часто ориентируются на уровни фибриногена, СРБ (пентамера) [10, 11]. Но методика определения данных показателей не совсем точна по сравнению с иммуноферментными методами исследования, например, высокочувствительного СРБ (мономера). Уровень высокочувствительного СРБ в крови увеличивается через 6–8 часов от начала заболевания и достаточно быстро снижается, что свидетельствует об эффективности назначенного лечения и может способствовать ранней диагностике, дифференциальной диагностике при указанных нозологических формах [12].
Активация свертывания крови тесно связана с воспалением и необходима для ограничения очага инфекции или инфекционных агентов путем окружения их фибриновыми микросгустками [13–15].
Нарушение гемостаза при гнойно-септическом процессе сопровождается усилением фибринообразования, снижением активности естественных антикоагулянтов, а также подавлением системы фибринолитического потенциала [13–15]. При этом имеет место и определенная динамика медиаторов и маркеров воспалительных реакций – цитокинов. Провоспалительные цитокины среди прочих функций стимулируют активацию гемостаза за счет экспрессии тканевого фактора, угнетения антикоагулянтных и фибринолитических систем крови [13–15].
Особенности течения гемостатических реакций при хронических патологиях околоносовых пазух и небных миндалин недостаточно освещены в литературе, отсутствуют ориентиры, позволяющие прогнозировать тяжесть течения данной патологии. Отсутствуют работы, посвященные ранней и чувствительной диагностике, прогнозированию течения ХС, в том числе хронического гнойного синусита (ГС), ХТ, ПА одновременно по показателям СРБ и Д-димера.
Проблема лечения больных ХС, ХТ и ПА остается крайне актуальной в оториноларингологии [3–8]. Это обусловлено общей тенденцией роста заболеваемости ХТ и ХС, неэффективностью лечения, высокой частотой рецидивирования, а также незначительным количеством исследований роли сопряжения гемостатических реакций и воспаления в генезе заболевания [3–8, 15–18].
Целью исследования стала оценка показателей и связи между Д-димером и С-реактивным белком при хроническом полисинусите (ХП), ГС, ХТ и ПА.
Материал и методы
Проведено клинико-лабораторное обследование 156 пациентов (67 (42,9%) мужчин, 89 (57,1%) женщин) с хроническим синуситом и хроническим тонзиллитом декомпенсированной формы и паратонзиллярным абсцессом, находившихся на стационарном лечении в Тамбовской городской клинической больнице № 3. Больные были разделены на четыре группы. Первую составил 41 больной ХП (средний возраст – 44,9 ± 3,2 года), вторую – 34 пациента с ХТ (средний возраст – 40,3 ± 3,2 года), третью – 38 больных ГС (средний возраст – 25,6 ± 1,4 года), четвертую – 43 пациента с ПА (средний возраст – 33,6 ± 1,9 года). В контрольную группу вошли 20 здоровых добровольцев (средний возраст – 26,5 ± 2,01 года).
Критериями исключения из исследования послужили:
- наличие бронхиальной астмы, сахарного диабета, заболеваний крови и системных заболеваний;
- применение любых препаратов, влияющих на гемостаз;
- наличие вирусных гепатитов (В, С) и ВИЧ-инфекции;
- установленная в анамнезе почечная и печеночная недостаточность;
- беременность.
Всем участникам исследования выполнен забор крови из локтевой вены в две вакуумные системы (для получения сыворотки и плазмы) в первые сутки поступления в стационар. Определение уровней СРБ и Д-димера проводилось иммуноферментным методом с использованием тест-систем ЗАО «Вектор-Бест» (Россия) на иммуноферментном микропланшетном анализаторе INFINITE F50 (Tecan, Австрия).
Статистическую обработку данных при оценке результатов лабораторного исследования проводили с помощью пакета программ Statistica 6.0. Частоту встречаемости рассчитывали прямым подсчетом и выражали в процентах. Уровни определяемых показателей описывали с помощью медианы и интерквартильного размаха (Me [25%; 75%]). Достоверность различий показателей между группами оценивали по непараметрическому U-критерию Манна – Уитни. За норму принимали предлагаемые нормативы для соответствующих наборов и методов. Статистически значимыми считали различия при 0,05 уровне вероятности безошибочного суждения (p < 0,05). При р более 0,1 и менее 0,05 определяли тенденцию к изменению.
Результаты и обсуждение
СРБ и фибриноген относятся к белкам острой фазы, роль которых заключается в ограничении очага повреждения, удалении повреждающих факторов, восстановлении нарушенной структуры. СРБ – «главный белок» острой фазы, уровень которого при повреждении возрастает в первые 6–8 часов, причем весьма значительно (в 20–100 раз и больше) [12, 14–16].
Для определения роли воспаления в генезе гнойно-септических осложнений при ХС и ХТ изучались концентрации СРБ в сыворотке крови пациентов с данными патологиями.
СРБ – центральный компонент двух типов воспалительных процессов. Первый тип – воспалительный процесс, связанный с системными инфекционными процессами, некрозом тканей, опухолевыми заболеваниями. При этом уровень СРБ находится в так называемом воспалительном диапазоне ≥ 10 мг/л. Уровень СРБ, достигший указанного значения, свидетельствует о тяжести системного воспаления. Второй тип воспалительной реакции, которую отражает вялотекущий воспалительный процесс, происходящий в эндотелии и обусловленный атерогенезом, как правило, не связан с инфекциями. Высокочувствительный диапазон СРБ – от 0,05 до 10,0 мг/л. В настоящем исследовании данный показатель использовали в качестве раннего маркера – предиктора острого воспалительного процесса [12].
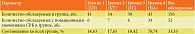
Частота встречаемости высоких значений СРБ в воспалительном диапазоне представлена в табл. 1. Как видим, частота встречаемости острофазовых концентраций СРБ в группах ХП, ХТ и ГС практически не отличалась. Вместе с тем у пациентов с ПА (четвертая группа) высокие уровни СРБ регистрировались в 4,1–5,2 раза чаще, чем в группах 1–3. В целом среди всех обследованных пациентов частота встречаемости острофазовых значений СРБ составила 33,3% (каждый третий пациент). Подобная динамика уровней СРБ в сыворотке крови свидетельствует об острофазовом ответе у ряда пациентов, особенно при ПА, на фоне гнойного процесса и некроза тканей.
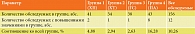
Анализ концентраций СРБ показал значительные различия между группами (табл. 2).
При хронических процессах у пациентов с ХП (первая группа) имели место более высокие концентрации СРБ по сравнению с пациентами контрольной группы (рис. 1).
У пациентов с ХТ (вторая группа) не выявлено достоверных отличий ни с пациентами контрольной группы, ни с пациентами первой группы. Высокие концентрации СРБ при ПА в четвертой группе достоверно отличались от таковых у обследуемых контрольной группы, пациентов с ХП, ХТ, ГС (табл. 2, рис. 1). Это еще раз доказывает информативность данного показателя как наиболее чувствительного клинико-лабораторного индикатора воспаления, бактериального инфекционного процесса и некроза. СРБ, как и большинство белков острой фазы, характеризуется неспецифичностью по отношению к первопричине воспаления и высокой корреляцией их концентрации в крови с тяжестью заболевания и его стадией. Сказанное означает, что СРБ более точный и надежный маркер воспаления, чем, например, скорость оседания эритроцитов, подсчет относительного количества лейкоцитов и сдвиг лейкоцитарной формулы. Ранее нами было показано, что лейкоцитарные показатели общего анализа крови (количество лейкоцитов, относительное количество лейкоцитов, входящее в лейкоцитарную формулу) имели патологически высокие значения при выраженных гнойно-септических осложнениях в виде ПА [9]. Таким образом, ценность определения концентрации в динамике гнойно-септических осложнений для мониторирования течения заболевания и контроля эффективности лечения переоценить сложно.
Ко второй группе белков острой фазы воспаления относится, в частности, фибриноген. Концентрация этих белков увеличивается в 2–5 раз. Одновременная активация фибринолиза сопровождается увеличением Д-димеров как продуктов деградации фибрина. Не случайно Д-димер отражает не только нарастание предтромботической готовности, но и степень острофазового ответа [13–15]. В более ранних наших работах показатели рутинной коагулограммы (протромбиновое и тромбиновое время, фибриноген, активированное частичное тромбопластиновое время) у больных с ХС и ХТ находились в пределах референсных значений и не различались между группами [9]. Наиболее информативным показателем служило повышение уровней растворимых фибринмономерных комплексов, что наглядно отражало развитие предтромботической готовности при гнойно-септических осложнениях [13–15].
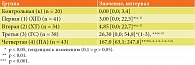
В настоящем исследовании выявлена низкая частота встречаемости высоких концентраций Д-димера в группах пациентов с ХП, ХТ и ГС (табл. 3). Однако в группе с гнойно-септическими осложнениями и некрозом тканей – ПА высокие концентрации Д-димера регистрировались в 8 раз чаще. Это указывает на активацию процессов фибриногенеза, а следовательно, и фибринолиза, сопутствующих острой фазе воспалительного процесса.
Анализ результатов определения Д-димера в плазме крови показал значительные различия между группами пациентов с ХП, ГС, ХТ и ПА (табл. 4).
Установлено, что, несмотря на низкую частоту встречаемости высоких концентраций Д-димера при ХТ (2,94%) и ГС (2,63%) по сравнению с ХП (4,88%), медианы данного показателя увеличились и составили 3,0 нг/мл у пациентов с ХП (первая группа) и 4,85 нг/мл у пациентов с ХТ (вторая группа) (рис. 2). У пациентов в группах с гнойно-септическими осложнениями (третья и четвертая группы) уровни Д-димера возрастали в десятки раз и достоверно превышали медианы данного показателя в контрольной группе и других группах соответственно (табл. 4, рис. 2), что адекватно отражало острофазовый ответ и предтромботическую готовность в группах ГС и ПА.
При межгрупповом анализе мы выявили обратную корреляцию слабой степени концентраций СРБ (r = -0,285) и умеренной степени концентраций Д-димера (r = -0,36). Между изучаемыми показателями имела место достоверная прямая корреляционная связь умеренной степени (r = 0,548).
Выводы
На основании полученных данных были сделаны следующие выводы.
Во-первых, повышение в крови уровней СРБ адекватно отражает наличие воспалительной реакции у пациентов с ХП, ХТ, ГС и играет важную роль в ранней диагностике ПА, сопровождающегося некрозом и выраженной острофазовой реакцией, и предупреждении тяжелых гнойно-септических осложнений.
Во-вторых, при оценке динамики уровней Д-димера выявлена тенденция к низкой частоте встречаемости повышенных уровней показателя в группах ХП, ХТ. Но, несмотря на это, уровень Д-димера имеет важное диагностическое значение при развитии острофазового ответа и активации гемостаза при ГС и ПА и отражает активность процесса ограничения очага гнойно-септического расплавления тканей.
В-третьих, аналогичная динамика взаимосвязанных между собой показателей СРБ и Д-димера свидетельствует о взаимосвязанных процессах воспаления и гемостаза у больных ХС и ХТ.
Заключение
Выявленные в работе закономерности изменения показателей СРБ и Д-димера при ХП, ХТ, ГС, ПА, отражающих реакции и взаимодействие двух важнейших систем (воспаления и гемостаза), можно отнести к общепатологическим реакциям организма человека. Своевременное исследование уровня СРБ и Д-димера в крови пациентов с ХС и ХТ позволит проводить раннюю и чувствительную диагностику, прогнозировать течение заболевания и в конечном итоге – повышать эффективность лечения пациентов с данными нозологиями.
D.V. Trusov1, M.V. Bychkova, Ye.R. Kulyutsina, PhD, N.K. Pochinina, PhD
Tambov City Clinical Hospital № 3
Penza Institute for Advanced Medical Training – the Branch of FSBEI SPE ῾Russian Medical Academy of Continuing Professional Education’ of Ministry of Health of Russia
Contact person: Dmitry V. Trusov, trudoc747@rambler.ru
The present study included 156 patients presenting with chronic sinusitis and chronic tonsillitis. Of these, four groups were distinguished: group 1 – 41 patients with chronic polysinusitis, group 2 – 34 with chronic tonsillitis, group 3 – 38 patients with chronic purulent sinusitis, group 4 – 43 patients with paratonsillar abscess. All patients were examined according to the standards of medical care in accordance with the relevant nosologies and additionally studies were conducted on CRP with a highly sensitive method and the study of D-dimer. The article shows the dynamics of interconnected highly sensitive and modern indicators (CRP and D-dimer), which are a reflection of the interrelated processes of inflammation and hemostasis in patients with chronic rhinosinusitis and chronic tonsillitis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.