Исследование эквивалентности воспроизведенного препарата ривароксабана Зинакорен in vitro и in vivo
- Аннотация
- Статья
- Ссылки
- English
Цель – представить ключевые результаты программы фармацевтической разработки воспроизведенного препарата Зинакорен, таблетки, покрытые пленочной оболочкой (МНН – ривароксабан), производства «Польфарма» АО (Польша) и АО «АКРИХИН» (РФ).
Исследование ТCКР (in vitro)
Материал и методы. Тест сравнительной кинетики растворения проведен в трех средах на 12 единицах каждого лекарственного средства отдельно для каждой из трех сред растворения. Исследуемый препарат – Зинакорен, таблетки, покрытые пленочной оболочкой (АО «АКРИХИН»), в дозировках 2,5; 10; 15 и 20 мг, референтный препарат – Ксарелто®, таблетки, покрытые пленочной оболочкой(«Байер Фарма» АГ, Германия), в дозировках 2,5; 10; 15 и 20 мг. Количественное определение высвободившегося ривароксабана проводили с помощью валидированной методики ВЭЖХ-УФ.
Результаты. Профили высвобождения действующего вещества ривароксабан из исследуемого препарата Зинакорен и референтного препарата ривароксабана эквивалентны в трех средах: в среде растворения ацетатный буферный раствор рН 4,5 (среда контроля качества) все дозировки – на основании высвобождения действующего вещества более 85% за 15 минут; в средах растворения 0,1 М раствор хлористоводородной кислоты и фосфатный буферный раствор рН 6,8 – на основании рассчитанных значений фактора подобия f2, которые составили более 50.
Заключение. Воспроизведенный препарат Зинакорен (МНН – ривароксабан), полностью эквивалентен по профилю высвобождения (растворения) in vitro оригинальному препарату ривароксабана.
Исследование сравнительной фармакокинетики (in vivo)
Цель – изучение сравнительной фармакокинетики и доказательство биоэквивалентности препаратов ривароксабана – Зинакорен (МНН – ривароксабан), таблетки, покрытые пленочной оболочкой(«Польфарма» АО, Польша), и Ксарелто®, таблетки, покрытые пленочной оболочкой («Байер Фарма» АГ, Германия), с участием здоровых добровольцев мужского пола, при однократном приеме 10 мг натощак (исследование № 1) и 20 мг после приема пищи (исследование № 2).
Материал и методы. Проведено два исследования по дизайну: открытое,
рандомизированное, перекрестное двухэтапное исследование однократного приема исследуемого препарата и препарата сравнения, с периодом между приемами не менее семи дней и длительностью забора крови в течение 48 часов. В исследование дозировки 10 мг было включено 56 здоровых добровольцев, в исследование дозировки 20 мг – 30 здоровых добровольцев. Количественное определение концентрации ривароксабана в плазме проводили с помощью валидированного ВЭЖХ-МС/МС аналитического метода. Фармакокинетические параметры определяли для обоих препаратов. Исследование проводилось в соответствии со стандартами Надлежащей клинической практики (GCP) и законодательством РФ.
Результаты. Границы оцененных 90%-ных доверительных интервалов для отношений Ln-преобразованных AUC0-48 и Сmax находятся в пределах 80–125%, согласно существующим руководствам.
Заключение. Препарат Зинакорен, таблетки, покрытые пленочной оболочкой, 10 и 20 мг («Польфарма» АО, Польша) биоэквивалентен препарату Ксарелто®, таблетки, покрытые пленочной оболочкой, 10 и 20 мг соответственно («Байер Фарма» АГ, Германия).
Цель – представить ключевые результаты программы фармацевтической разработки воспроизведенного препарата Зинакорен, таблетки, покрытые пленочной оболочкой (МНН – ривароксабан), производства «Польфарма» АО (Польша) и АО «АКРИХИН» (РФ).
Исследование ТCКР (in vitro)
Материал и методы. Тест сравнительной кинетики растворения проведен в трех средах на 12 единицах каждого лекарственного средства отдельно для каждой из трех сред растворения. Исследуемый препарат – Зинакорен, таблетки, покрытые пленочной оболочкой (АО «АКРИХИН»), в дозировках 2,5; 10; 15 и 20 мг, референтный препарат – Ксарелто®, таблетки, покрытые пленочной оболочкой(«Байер Фарма» АГ, Германия), в дозировках 2,5; 10; 15 и 20 мг. Количественное определение высвободившегося ривароксабана проводили с помощью валидированной методики ВЭЖХ-УФ.
Результаты. Профили высвобождения действующего вещества ривароксабан из исследуемого препарата Зинакорен и референтного препарата ривароксабана эквивалентны в трех средах: в среде растворения ацетатный буферный раствор рН 4,5 (среда контроля качества) все дозировки – на основании высвобождения действующего вещества более 85% за 15 минут; в средах растворения 0,1 М раствор хлористоводородной кислоты и фосфатный буферный раствор рН 6,8 – на основании рассчитанных значений фактора подобия f2, которые составили более 50.
Заключение. Воспроизведенный препарат Зинакорен (МНН – ривароксабан), полностью эквивалентен по профилю высвобождения (растворения) in vitro оригинальному препарату ривароксабана.
Исследование сравнительной фармакокинетики (in vivo)
Цель – изучение сравнительной фармакокинетики и доказательство биоэквивалентности препаратов ривароксабана – Зинакорен (МНН – ривароксабан), таблетки, покрытые пленочной оболочкой(«Польфарма» АО, Польша), и Ксарелто®, таблетки, покрытые пленочной оболочкой («Байер Фарма» АГ, Германия), с участием здоровых добровольцев мужского пола, при однократном приеме 10 мг натощак (исследование № 1) и 20 мг после приема пищи (исследование № 2).
Материал и методы. Проведено два исследования по дизайну: открытое,
рандомизированное, перекрестное двухэтапное исследование однократного приема исследуемого препарата и препарата сравнения, с периодом между приемами не менее семи дней и длительностью забора крови в течение 48 часов. В исследование дозировки 10 мг было включено 56 здоровых добровольцев, в исследование дозировки 20 мг – 30 здоровых добровольцев. Количественное определение концентрации ривароксабана в плазме проводили с помощью валидированного ВЭЖХ-МС/МС аналитического метода. Фармакокинетические параметры определяли для обоих препаратов. Исследование проводилось в соответствии со стандартами Надлежащей клинической практики (GCP) и законодательством РФ.
Результаты. Границы оцененных 90%-ных доверительных интервалов для отношений Ln-преобразованных AUC0-48 и Сmax находятся в пределах 80–125%, согласно существующим руководствам.
Заключение. Препарат Зинакорен, таблетки, покрытые пленочной оболочкой, 10 и 20 мг («Польфарма» АО, Польша) биоэквивалентен препарату Ксарелто®, таблетки, покрытые пленочной оболочкой, 10 и 20 мг соответственно («Байер Фарма» АГ, Германия).



Введение
Вопросы применения антикоагулянтов актуальны в свете показателей статистики заболеваемости и смертности от сердечно-сосудистой патологии, в основе которой – атеросклеротическое поражение сосудов, нарушение свертывания крови и нарушение ритма [1, 2]. Заболевания сердца и сосудов составляют в развитых странах, и в частности в РФ, большую долю в структуре смертности – от 45 до 65%, по данным разных авторов [2, 3]. Проблема усугубляется в связи со старением населения и нарастанием коморбидной патологии, что требует от врача понимания общих механизмов развития, казалось бы, несвязанных между собой заболеваний и назначения патогенетически обоснованных средств, влияющих на единые механизмы развития и прогрессирования сердечно-сосудистых заболеваний [2, 4].
Проблема тромботических осложнений выходит за рамки исключительно венозной патологии (тромбофлебит поверхностных и глубоких вен), вовлекая и проблемы патологии процессов свертывания крови, нарушений сердечного ритма (фибрилляция предсердий), что также требует назначения препаратов, регулирующих и контролирующих сложные процессы гемокоагуляции [5–7]. Понимание этих проблем привело к созданию группы пероральных антикоагулянтов (ПОАК), лишенных недостатков прежних подходов, воздействующих на ключевые звенья каскада свертывания крови и совершивших революцию в плане оказания помощи больным с сердечно-сосудистой патологией [8].
Одним из лидеров ПОАК является ривароксабан – первый пероральный ингибитор активности фактора свертываемости крови Ха (фактор Стюарта – Прауэра). Селективное и обратимое снижение активности фактора Ха приводит к снижению риска тромбозов и тромбоэмболий у пациентов с высоким тромботическим риском [9]. Эффективность ривароксабана доказана в большом числе качественных исследований, проанализирована в дальнейших метаанализах и систематических обзорах, проверена многолетней клинической практикой, в том числе с использованием регистров пациентов [9–12].
Внедрение в клиническую практику воспроизведенных препаратов ривароксабана, как и других воспроизведенных лекарственных средств, предусматривает программу фармацевтической разработки воспроизведенного препарата [13–15]. Важнейшими этапами фармацевтической разработки воспроизведенного лекарственного средства являются исследование сравнительной кинетики растворения (in vitro) и изучение сравнительной фармакокинетики препаратов на здоровых добровольцах (in vivo). Эти исследования позволяют доказать, что растворение препаратов в различных средах и всасывание их в кровь эквивалентно у воспроизведенного и оригинального препаратов, что позволяет экстраполировать результаты ранее проведенных исследований по эффективности и безопасности (показания, режимы дозирования) на новый воспроизведенный препарат. Целью данной публикации является представление результатов исследования нового препарата, содержащего ривораксабан, – Зинакорен, таблетки, покрытые пленочной оболочкой (МНН – ривароксабан), производства «Польфарма» АО (Польша) и АО «АКРИХИН» (РФ).
Материал и методы исследования ТСКР
Тест сравнительной кинетики растворения (ТСКР) проводили, согласно Фармакопее ЕАЭС ОФС.2.1.9.3 «Испытание на растворение для твердых дозированных лекарственных форм» и государственной фармакопее ОФС.1.4.2.0014.15 «Растворение для твердых дозированных лекарственных форм», на аппарате «Лопастная мешалка» при скорости вращения 75 об/мин при температуре 37,0 ± 0,5 °С в трех средах растворения: 0,1 М раствор хлористоводородной кислоты, содержащий 0,2% натрия лаурилсульфата (для дозировок 2,5 и 10 мг), или 0,1 М раствор хлористоводородной кислоты, содержащий 0,4% натрия лаурилсульфата (для дозировок 15 и 20 мг); ацетатный буферный раствор рН 4,5, содержащий 0,2% натрия лаурилсульфата (для дозировок 2,5 и 10 мг), или ацетатный буферный раствор рН 4,5, содержащий 0,4% натрия лаурилсульфата (для дозировок 15 и 20 мг) (среда контроля качества); фосфатный буферный раствор рН 6,8, содержащий 0,2% натрия лаурилсульфата (для дозировок 2,5 и 10 мг), или фосфатный буферный раствор рН 6,8, содержащий 0,4% натрия лаурилсульфата (для дозировок 15 и 20 мг).
Объем сред растворения составил 1000 мл. Временные точки отбора проб: 5, 10, 15, 20, 30, 45 и 60 минут. В каждый из 12 сосудов для растворения помещали 1000 мл предварительно дегазированной среды растворения, термостатировали при 37 ± 0,5 °С, в каждый стакан вносили по одной таблетке. Спустя указанные промежутки времени проводили отбор 10 мл. Все пробы фильтровали через мембранный фильтр ChromafilXtraPET 120/25 с размером пор 1,2 мкм, отбрасывая первые 2–3 мл фильтрата. Количественное определение высвободившегося ривароксабана проводили с помощью валидированной методики ВЭЖХ-УФ. Испытание проводили на 12 единицах каждого лекарственного средства отдельно для каждой из трех сред растворения. Исследуемый препарат Зинакорен, таблетки, покрытые пленочной оболочкой (АО «АКРИХИН»), в дозировках 2,5; 10; 15 и 20 мг (промышленные серии), референтный препарат Ксарелто®, таблетки, покрытые пленочной оболочкой («Байер Фарма» АГ, Германия), в дозировках 2,5; 10; 15 и 20 мг.
Результаты исследования ТСКР
Ривароксабан относится к веществам II класса биофармацевтической классификационной системы, обладающим низкой растворимостью в воде и высокой проницаемостью, при этом вещество относят к подклассу С (неионизируемые вещества), это говорит о том, что рН не влияет на растворимость вещества на всем протяжении желудочно-кишечного тракта [16].
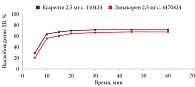
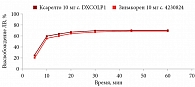
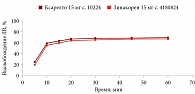
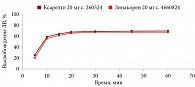
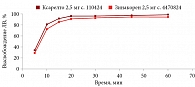
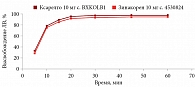
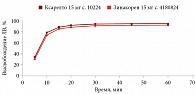
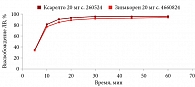
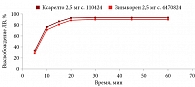
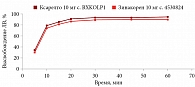
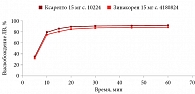
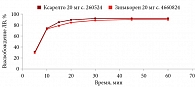
В среде растворения 0,1 М раствор хлористоводородной кислоты для всех дозировок исследуемого препарата Зинакорен проводили расчет фактора подобия f2 на основании высвобождения менее 85% за 15 минут относительно референтного лекарственного препарата Ксарелто® (рис. 1–4). Во всех дозировках исследуемого препарата значения f2 составили более 50: для дозировки 2,5 мг – 54,4, для дозировки 10 мг – 57,1, для дозировки 15 мг – 56,2 и для дозировки 20 мг – 59,2. Не было отмечено значений относительного стандартного отклонения для среднего значения, превышающих 10%.
В среде растворения ацетатный буферный раствор рН 4,5 (среда контроля качества) для всех дозировок референтного препарата Ксарелто® и исследуемого препарата Зинакорен высвобождение действующего вещества составило более 85% за 15 минут (рис. 5–8), значения относительного стандартного отклонения для 15 минут составили не более 10%, следовательно, профили высвобождения можно признать эквивалентными без дальнейшего математического анализа и расчета фактора подобия.
В среде растворения фосфатный буферный раствор рН 6,8 для всех дозировок исследуемого препарата Зинакорен проводили расчет фактора подобия f2 на основании высвобождения менее 85% за 15 минут относительно референтного лекарственного препарата Ксарелто® (рис. 9–12). Во всех дозировках исследуемого препарата значения f2 составили более 50: для дозировки 2,5 мг – 66,5, для дозировки 10 мг – 71,5, для дозировки 15 мг – 68,7 и для дозировки 20 мг – 68,0. Не было отмечено значений относительного стандартного отклонения для среднего значения, превышающих 10%.
Заключение по исследованию ТСКР
В соответствии с регуляторными требованиями [13, 14], кинетика растворения лекарственного вещества считается эквивалентной в случае выполнения следующих условий:
- более 85% лекарственного вещества переходит в раствор в течение 15 минут, кинетика растворения считается эквивалентной без дальнейшего математического анализа данных;
- величина стандартного отклонения для среднего значения для первой временной точки не превышает 20% для остальных точек – 10%;
- значение фактора подобия f2 принадлежит интервалу от 50 до 100.
Таким образом, воспроизведенный препарат Зинакорен (МНН – ривароксабан) полностью эквивалентен по профилю растворения in vitro оригинальному препарату ривароксабана.
Исследования сравнительной фармакокинетики (in vivo)
Материал и методы
Для проведения сравнительной фармакокинетики и биоэквивалентности был проанализирован международный опыт исследования биоэквивалентности препаратов, содержащих ривароксабан в качестве активного вещества [17, 18]. Все ранее проведенные исследования биоэквивалентности ривароксабана выполнялись с участием здоровых добровольцев, это также нашло подтверждение в рекомендациях FDA [18]. Исследуемым препаратом был Зинакорен (ривароксабан), таблетки, покрытые пленочной оболочкой, 10 и 20 мг («Польфарма» АО, Польша), препаратом сравнения – Ксарелто®, таблетки, покрытые пленочной оболочкой, 10 и 20 мг («Байер Фарма» АГ, Германия) [19, 20]. Препарат Ксарелто®, таблетки, покрытые пленочной оболочкой, 10 и 20 мг («Байер Фарма» АГ, Германия) является оригинальным препаратом ривароксабана и зарегистрирован на территории РФ, что соответствует требованиям к выбору препарата регуляторных документов ЕАЭС и РФ [13, 14]. Сравниваемые препараты производятся в одинаковой лекарственной форме – таблетки, покрытые пленочной оболочкой. Вспомогательные вещества, входящие в состав сравниваемых препаратов, хорошо изучены и не должны оказывать влияния на фармакокинетику сравниваемых препаратов.
Дозировка и способ применения препарата соответствовали утвержденной инструкции по применению оригинального препарата Ксарелто®, таблетки, покрытые пленочной оболочкой («Байер Фарма» АГ, Германия): 10 мг – натощак, 20 мг – после приема пищи.
Исследования до еды и после еды были построены по единым требованиям. Дизайн исследований – одноцентровое открытое рандомизированное перекрестное двухэтапное исследование сравнительной фармакокинетики и биоэквивалентности двух препаратов на основе ривароксабана. Популяция пациентов: добровольцы в возрасте 18–45 лет с верифицированным диагнозом «здоров» по данным стандартных клинических, лабораторных, инструментальных методов исследования, с индексом массы тела 18,5–30,0 кг/м2, готовых придерживаться адекватных методов контрацепции на протяжении всего исследования. Исследования были одобрены Министерством здравоохранения РФ (для дозировки 10 мг – Разрешение на проведение клинических исследований № 337 от 16.07.2018; для дозировки 20 мг – Разрешение на проведение клинических исследований № 416 от 14.08.2018) и локальным этическим комитетом. Перед включением в исследование все добровольцы подписали информированное согласие на участие в исследовании. На этапе скрининга и в ходе исследования клиническое обследование добровольцев включало в себя врачебный осмотр, сбор анамнеза, данные физикального обследования по основным органам и системам (дыхательная, сердечно-сосудистая, пищеварительная, мочевыделительная, нервная), измерение роста, массы тела, оценку жизненно важных показателей (АД, ЧСС, температура), проведение ЭКГ в 12 отведениях. Всем добровольцам были выполнены лабораторные исследования, такие как общий анализ крови, мочи, биохимический анализ крови, анализ на серологические маркеры вируса иммунодефицита человека, гепатитов В и С, сифилиса, тесты мочи на беременность и следы наркотиков, тест на алкоголь в выдыхаемом воздухе.
Исследования включали: период скрининга (до 14 дней), два периода госпитализации, «отмывочный» период семь суток (≥ 6Т1/2) и визит завершения исследования.
После отбора, согласно критериям включения/невключения, здоровые добровольцы были приглашены в исследовательский центр и госпитализированы не позднее чем за десять часов до запланированного приема препарата. Добровольцы были рандомизированы в группы по последовательностям TR (группа А) и RT (группа В) в соответствии со схемой рандомизации, где Т – исследуемый препарат Зинакорен (ривароксабан), R – препарат сравнения Ксарелто®. Добровольцы получали 10 мг препарата после 10-часового голодания.Всего в каждом периоде было взято 20 образцов крови: до приема препарата и через 15, 30, 45 минут, 1 час, 1 час 30 минут, 2 часа, 2 часа 30 минут, 3 часа, 3 часа 30 минут, через 4, 5, 6, 8, 10, 12, 16, 24, 36 и 48 часов от момента приема препарата в каждом периоде исследования. Взятые в вакуумные пробирки объемом 6 мл с К2 ЭДТА в качестве антикоагулянта образцы центрифугировали при 1500 g в течение 10 минут при температуре 4 ± 4 °С не позднее чем через 30 минут после забора. Плазму незамедлительно замораживали и хранили при температуре ≤ 20 ± 10 °С.
Для обеспечения безопасности проводился мониторинг клинических и лабораторных показателей с целью выявления нежелательных явлений (НЯ).
Измерения проводили в соответствии с принципами надлежащей клинической и лабораторной практик. Был использован валидированный метод определения ривароксабана в плазме крови человека с K2-ЭДТА в качестве антикоагулянта с применением ВЭЖХ-МС/МС системы. Верхний и нижний пределы количественного определения составили соответственно от 1,00 до 600,00 нг/мл.
Применялись методы описательной статистики, дисперсионного анализа и другие, согласно руководствам. Вывод о биоэквивалентности сравниваемых препаратов был сделан с использованием подхода, основанного на оценке 90%-ных доверительных интервалов (90% ДИ) для отношений (исследуемого препарата и препарата сравнения – T/R) геометрических средних значений (или LeastSquareMeans) фармакокинетического параметра AUC. Препараты считаются биоэквивалентными для AUC, так как значения оцененных доверительных интервалов находятся в пределах 80,00–125,00% [13, 14].Данный препарат не является высоковариабельным, поскольку по результатам данного исследования, внутрииндивидуальная вариабельность Cmax составила менее 30%, в связи с чем границы 90% ДИ для отношений геометрических средних значений фармакокинетического параметра Cmax не были увеличены. Препараты считаются биоэквивалентными для Cmax, так как границы оцененных доверительных интервалов находятся в пределах 80,00–125,00%.
Результаты исследования № 1
Исследование биоэквивалентности (10 мг препарата до еды). На этапе скрининга было обследовано 69 здоровых добровольцев, из которых отобрано 56 человек в возрасте от 18 до 45 лет (средний возраст – 30,77 ± 7,26 года) с индексом массы тела 23,931 ± 3,01 кг/м2. Добровольцы были рандомизированы в две группы по 28 человек. Один доброволец выбыл из исследования в связи с развитием нежелательного явления (ОРВИ), 55 человек завершили участие в соответствии с протоколом исследования.
Усредненные фармакокинетические профили концентрации ривароксабана в плазме крови добровольцев после однократного приема исследуемых препаратов в линейных и полулогарифмических координатах представлены на графиках (рис. 13).
На основании полученных фармакокинетических данных были рассчитаны также параметры относительной биодоступности и относительной степени всасывания ривароксабана после приема исследуемых препаратов, суммарные результаты оценки биоэквивалентности препаратов представлены в таблице.
При анализе данных концентрации ривароксабана 90% ДИ для отношения скорректированных геометрических средних исследуемого препарата и препарата сравнения составили 96,67–107,33% для AUC0–t и 97,52–111,28% для Cmax, то есть находились в пределах стандартного диапазона 80–125%. Соответственно, препарат Зинакорен, таблетки, покрытые пленочной оболочкой, 10 мг («Польфарма» АО, Польша) можно признать биоэквивалентным препарату Ксарелто®, таблетки, покрытые пленочной оболочкой, 10 мг («Байер Фарма» АГ, Германия).
В ходе исследования зарегистрировано 14 НЯ у 10 (18,18%) добровольцев, из них в двух (3,63%) случаях отмечались изжога (в первом периоде исследования) и ОРВИ (во втором периоде исследования), а в остальных 12 (21,81%) случаях наблюдались отклонения от референсных значений по результатам биохимического анализа крови в конце первого периода или при завершении исследования. В группе исследуемого препарата (Зинакорен) зарегистрировано пять НЯ: повышение уровня АСТ, изжога, гипербилирубинемия, гиперкалиемия, гиперхолестеринемия. В группе препарата сравнения (Ксарелто®) зарегистрировано девять НЯ: ОРВИ, повышение количества эозинофилов (два случая), повышение количества моноцитов, гипербилирубинемия, гипопротеинемия, снижение мочевины, гипергликемия, повышение количества базофилов.
Все зарегистрированные НЯ были легкой степени тяжести, полностью разрешились без последствий, никаких действий не предпринималось. В девяти случаях исследователи оценили НЯ как предвиденные, в пяти случаях – как непредвиденные, связь с приемом препарата расценена как вероятная (три случая), сомнительная (пять случаев) или возможная (шесть случаев). Серьезных нежелательных реакций выявлено не было. Один доброволец выбыл из исследования по причине НЯ (ОРВИ).
Результаты исследования № 2
Исследование биоэквивалентности (20 мг после еды). На этапе скрининга был обследован 41 здоровый доброволец, из которых отобраны 30 человек в возрасте от 21 до 43 лет (средний возраст – 30,07 ± 5,58 года) с индексом массы тела 24,11 ± 2,61 кг/м2. Добровольцы были рандомизированы в одну из следующих последовательностей приема препаратов: TR или RT. Доброволец под рандомизационным номером три выбыл из исследования в первый день первого периода исследования в связи с развитием рвоты в течение 12 часов после приема препарата исследования. Доброволец под рандомизационным номером 15 выбыл из исследования в первый день второго периода исследования в связи с развитием диареи в течение 12 часов после приема препарата исследования. Таким образом, в популяцию безопасности вошло 30 добровольцев, в фармакокинетическую популяцию вошло 28 добровольцев.
Усредненные фармакокинетические профили концентрации ривароксабана в плазме крови добровольцев после однократного приема исследуемых препаратов в линейных и полулогарифмических координатах представлены на графиках (рис. 14).
На основании полученных фармакокинетических данных были рассчитаны также параметры относительной биодоступности и относительной степени всасывания исследуемых препаратов. Суммарные результаты оценки биоэквивалентности препаратовпредставлены в таблице.
При анализе данных концентрации ривароксабана 90% ДИ для отношения скорректированных геометрических средних исследуемого препарата и препарата сравнения составили 96,96–111,36% для AUC0-t и 88,73–103,79% для Cmax, то есть находились в пределах стандартного диапазона 80–125%. Соответственно, препарат Зинакорен, таблетки, покрытые пленочной оболочкой, 20 мг («Польфарма» АО, Польша) можно признать биоэквивалентным препарату Ксарелто®, таблетки, покрытые пленочной оболочкой, 20 мг («Байер Фарма» АГ, Германия).
Во время исследования было зарегистрировано 25 случаев НЯ у 13 (43,33%) добровольцев, из них в одном случае (3,33%) отмечалась рвота, в одном случае (3,33%) – головная боль, в одном случае (3,33%) – диарея. В остальных 22 случаях (73,33%) наблюдались отклонения от референсных значений по результатам клинического и биохимического анализа крови, а также анализа мочи в конце первого периода или при завершении исследования. В группе исследуемого препарата (Зинакорен) зарегистрировано четыре НЯ: лейкоцитурия – два случая, лейкоцитоз, гиперхолестеринемия – один случай. В группе препарата сравнения (оригинальный ривароксабан) было 21 НЯ: лейкоцитурия – три случая, лимфоцитопения – три случая, лейкоцитоз – три случая, повышение количества нейтрофилов – три случая, тромбоцитопения, глюкозурия, гипергликемия, гипербилирубинемия, гиперхолестеринемия, много эпителия в общем анализе мочи, рвота, головная боль, диарея.
Из зарегистрированных НЯ 24 были легкой степени тяжести, одно НЯ – умеренной степени тяжести. В 23 случаях НЯ полностью разрешились самостоятельно без применения препаратов сопутствующей терапии либо иных методов лечения. В двух случаях НЯ было применено лечение: при диарее добровольцу под рандомизационным номером 15 было назначено сопутствующее лечение (Лоперамид), после чего НЯ разрешилось. При рвоте добровольцу под рандомизационным номером три было назначено сопутствующее лечение (Метоклопрамид), после чего НЯ разрешилось.
В трех случаях исследователи оценили НЯ как предвиденные, в 22 случаях – как непредвиденные, связь с приемом препарата расценена как вероятная (два случая), сомнительная (один случай) или возможная (22 случая). Серьезных НЯ выявлено не было. Два добровольца выбыли из исследования по причине НЯ (рвота, диарея).
Заключение
В проведенных исследованиях подтверждено, что исследуемый препарат Зинакорен, таблетки, покрытые пленочной оболочкой, 10 мг («Польфарма» АО, Польша) биоэквивалентен препарату Ксарелто®, таблетки, покрытые пленочной оболочкой, 10 мг («Байер Фарма» АГ, Германия), исследуемый препарат Зинакорен, таблетки, покрытые пленочной оболочкой, 20 мг («Польфарма» АО, Польша) биоэквивалентен препарату Ксарелто®, таблетки, покрытые пленочной оболочкой, 20 мг («Байер Фарма» АГ, Германия).
Эффективность и безопасность ривароксабана по всему спектру показаний была изучена в широкой программе клинических исследований на протяжении более 15 лет. Профилактика инсульта при неклапанной фибрилляции предсердий изучена в исследовании Rivaroxaban Once-daily oral direct factor Xa inhibition Compared with vitamin K antagonist for the prevention of stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF) [10]. По показанию «лечение тромбоза глубоких вен и/или тромбоэмболии легочной артерии» препарат изучен в исследованиях EINSTEIN Deep Vein Thrombosis (EINSTEIN DVT) [21] и EINSTEIN Pulmonary Embolism Studies (EINSTEIN PE) [9]. В исследовании EINSTEIN CHOICE ривароксабан снижал риски рецидива тромбоза глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА) эффективнее аспирина [11]. В серии исследований Regulation of Coagulation in Orthopedic Surgery to Prevent DVT and PE (RECORD 1, 2, 3) применялся при профилактике ТГВ после операции по замене тазобедренного или коленного суставов [22]. Эффективность ривароксабана в профилактике венозных тромбоэмболий у пациентов с острыми заболеваниями с риском тромбоэмболических осложнений была изучена в исследовании Multicenter, Randomized, parallel Group Efficacy and safety study for the prevention of venous thromboembolism in hospitalized medically ill patients comparing rivaroxaban with enoxaparin (MAGELLAN) [23]. Наконец, доказательства эффективности и безопасности ривароксабана в снижении риска инсульта, инфаркта миокарда или смерти от сердечно-сосудистых заболеваний у пациентов с ишемической болезнью сердца (ИБС) или заболеванием периферических артерий были получены в двойных слепых исследованиях проекта Cardiovascular OutcoMes for People using Anticoagulation Strategie Strial (COMPASS) [24]. Более поздние исследования подтвердили эти результаты и обосновали назначение ривароксабана как основного средства профилактики нарушений кровообращения, связанных с фибрилляцией предсердий, тромбообразованием, при ИБС и заболеваниях периферических сосудов [25, 26].
В соответствии с принципами разработки и внедрения в клиническую практику воспроизведенных препаратов, принятыми в регуляторных системах всего мира, перечисленные ранее клинические эффекты ривароксабана могут быть экстраполированы на воспроизведенные препараты, если они доказали свою физико-химическую и биологическую эквивалентность [13, 14].
Таким образом, воспроизведенный препарат ривароксабана Зинакорен (МНН – ривароксабан) производства компании «Польфарма» АО (Польша) и АО «АКРИХИН» (РФ) полностью эквивалентен по профилю высвобождения (растворения) in vitro, а также биоэквивалентен по фармакокинетическим параметрам (всасывание, распределение) оригинальному препарату ривароксабана in vivo, обладает хорошей переносимостью и благодаря удачному сочетанию фармакокинетических, фармакодинамических и клинических свойств может быть рекомендован для широкого внедрения в клиническую практику и регистрации в странах ЕАЭС.
A.L. Vertkin, G.Yu. Knorring, I.S. Rodyukova, S.M. Kryzhanovsky, V.I. Kazey, M.S. Dolov, M.A. Mezdrina, N.V. Goncharova, K.S. Manko, E.V. Timoshina
Russian University of Medicine
Clinical hospital of JSC Group of Companies ‘MEDSI’ in Otradnoye
Russian National Research Medical University named after N.I. Pirogov
NMC ‘Komed’ (Ligandresearch LLC)
ExakteLabs
Moscow State University named after M.V. Lomonosov
JSC ‘AKRIKHIN’
Contact person: German Yu. Knorring, knorring@mail.ru
The purpose of the publication: to present the key results of the pharmaceutical development program for the reproduced drug Zinacoren, film-coated tablets (INN rivaroxaban), manufactured by Polpharma JSC, Polandand AKRIKHIN JSC, Russia.
Comparative Dissolution Kinetics Test (CDKT) (in vitro):
Material and methods. CDKT kinetics tests were carried out in 3 media on 12 units of each drug separately for each of the three dissolution media. The studied drug is Zinacorene, film-coated tablets (AKRIKHIN JSC) in dosages of 2.5 mg, 10 mg, 15 mg and 20 mg, the reference drug is Xarelto®, film-coated tablets (Bayer Pharma AG, Germany), in dosages of 2.5 mg, 10 mg, 15 mg and 20 mg. Quantitative determination of the released rivaroxaban was performed using a validated HPLC-UV technique.
Results of the study. The release profiles of rivaroxaban from the studied reproduced drug Zinacoren and the original reference drug rivaroxaban are equivalent in 3 media: in the dissolution medium, an acetate buffer solution pH 4.5 (quality control medium), all dosages are based on the release of the active substance of more than 85% in 15 minutes; in the dissolution media, 0.1 M hydrochloric acid solution and phosphate buffer The pH 6.8 solution is based on the calculated values of the similarity factor f2, which amounted to more than 50.
Conclusion. The drug Zinacoren (INN rivaroxaban) is completely equivalent in terms of release (dissolution) profile in vitro to the original rivaroxaban.
Comparative pharmacokinetics (in vivo) study
The purpose of the study. To study the comparative pharmacokinetics and evidence of bioequivalence of rivaroxaban drugs – Zinacoren (INN rivaroxaban), film-coated tablets (Polpharma JSC, Poland), and Xarelto®, film-coated tablets (Bayer Pharma AG, Germany), with the participation of healthy male volunteers, with a single intake of 10 mg on an empty stomach (study 1) and 20 mg after meals (study 2).
Material and methods. Two studies were conducted per the following design: an open, randomized, cross-sectional two-stage study of a single dose of the test drug and a comparison drug, with a period between doses of at least 7 days and a duration of blood sampling for 48 hours. 56 healthy volunteers were included in the 10 mg study and 30 in the 20 mg study. The quantitative determination of rivaroxaban concentration in plasma was carried out using a validated HPLC-MS/MS analytical method. Pharmacokinetic parameters were determined for both drugs. The study was conducted in accordance with the standards of Good Clinical Practice (GCP) and the legislation of the Russian Federation.
Results. The boundaries of the estimated 90% confidence intervals for the Ln-transformed AUC0-48 and Cmax ratios are in the range of 80–125% according to existing guidelines.
Conclusion. The drug Zinacoren, film-coated tablets, 10 and 20 mg (Polpharma JSC, Poland) is bioequivalent to Xarelto®, film-coated tablets, 10 and 20 mg, respectively (Bayer Pharma AG, Germany).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.