Взаимосвязь полиморфных вариантов гена ABCB1 (rs2032582, rs1045642, rs1128503) и гена CYP3A5 (rs776746) c развитием геморрагических осложнений у пациентов с неклапанной фибрилляцией предсердий в сочетании с хронической болезнью почек
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить влияние полиморфных вариантов генов ABCB1 (rs2032582, rs1045642, rs1128503) и CYP3A5 (rs776746) на развитие кровотечений и уровни остаточной равновесной концентрации (Сmin,ss/D) апиксабана у пациентов с неклапанной фибрилляцией предсердий (ФП) и хронической болезнью почек (ХБП) стадий С3–С4.
Материал и методы. Обследовано 67 пациентов с ФП и ХБП, получавших апиксабан в дозе 5 или 2,5 мг два раза в сутки (средний возраст 84 [75; 91] года). Ретроспективно были оценены геморрагические осложнения, измерена Сmin,ss/D апиксабана в плазме крови и проведен фармакогенетический анализ.
Результаты. У пациентов с гетерозиготным аллелем AG гена CYP3A5 (rs776746) кровотечения на фоне терапии апиксабаном отмечались чаще, чем у пациентов с гомозиготным аллелем, – 83,3 и 47,3% случаев соответственно (р = 0,023). Кроме того, у пациентов с аллелем AG гена CYP3A5 (rs776746) по сравнению с пациентами с аллелем GG гена CYP3A5 (rs776746) была несколько выше Сmin,ss/D апиксабана в плазме крови – 31,95 [15,2; 35,8] и 20,95 [13,2; 34,3] нг/мл соответственно (р = 0,368).
Статистически значимых отличий в количестве кровотечений и в Сmin,ss/D апиксабана в плазме крови у обследованных пациентов в зависимости от наличия полиморфных вариантов гена ABCB1
(rs2032582, rs1045642 и rs1128503) не обнаружено.
Вывод. У пациентов с ФП и ХБП с гетерозиготным аллелем AG гена CYP3A5 (rs776746) количество кровотечений на фоне приема апиксабана выше.
Цель – изучить влияние полиморфных вариантов генов ABCB1 (rs2032582, rs1045642, rs1128503) и CYP3A5 (rs776746) на развитие кровотечений и уровни остаточной равновесной концентрации (Сmin,ss/D) апиксабана у пациентов с неклапанной фибрилляцией предсердий (ФП) и хронической болезнью почек (ХБП) стадий С3–С4.
Материал и методы. Обследовано 67 пациентов с ФП и ХБП, получавших апиксабан в дозе 5 или 2,5 мг два раза в сутки (средний возраст 84 [75; 91] года). Ретроспективно были оценены геморрагические осложнения, измерена Сmin,ss/D апиксабана в плазме крови и проведен фармакогенетический анализ.
Результаты. У пациентов с гетерозиготным аллелем AG гена CYP3A5 (rs776746) кровотечения на фоне терапии апиксабаном отмечались чаще, чем у пациентов с гомозиготным аллелем, – 83,3 и 47,3% случаев соответственно (р = 0,023). Кроме того, у пациентов с аллелем AG гена CYP3A5 (rs776746) по сравнению с пациентами с аллелем GG гена CYP3A5 (rs776746) была несколько выше Сmin,ss/D апиксабана в плазме крови – 31,95 [15,2; 35,8] и 20,95 [13,2; 34,3] нг/мл соответственно (р = 0,368).
Статистически значимых отличий в количестве кровотечений и в Сmin,ss/D апиксабана в плазме крови у обследованных пациентов в зависимости от наличия полиморфных вариантов гена ABCB1
(rs2032582, rs1045642 и rs1128503) не обнаружено.
Вывод. У пациентов с ФП и ХБП с гетерозиготным аллелем AG гена CYP3A5 (rs776746) количество кровотечений на фоне приема апиксабана выше.




Введение
Для профилактики тромбоэмболических осложнений пациентам с неклапанной фибрилляцией предсердий (ФП) показана антикоагулянтная терапия. Предпочтение отдается прямым оральным антикоагулянтам (ПОАК) [1].
Несмотря на то что риск геморрагических осложнений на фоне применения ПОАК ниже, чем при использовании альтернативных схем антикоагулянтной терапии [2], проблема безопасности ПОАК остается актуальной, особенно у пациентов с сопутствующей хронической болезнью почек (ХБП). Согласно статистическим данным, около 50% пациентов с ФП имеют почечную недостаточность какой-либо степени [3], и риск кровотечений на фоне приема оральных антикоагулянтов увеличивается с нарастанием тяжести ХБП [4].
Метаболизм апиксабана по сравнению с другими ПОАК в меньшей степени затрагивает почки: его почечный клиренс в среднем составляет 27%, а большая его часть выводится через кишечник [5]. При этом степень снижения функции почек коррелирует с концентрацией апиксабана в крови [6].
Одним из наиболее перспективных направлений в отношении профилактики развития нежелательных реакций является фармакогенетика. Результаты ряда исследований демонстрируют влияние полиморфных вариантов различных генов на метаболизм ПОАК [7–9]. Например, в исследовании Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) [10, 11] выявлена ассоциация между наличием полиморфных вариантов генов ABCB1 и CES1 и концентрацией дабигатрана в плазме, а также связь одного полиморфного варианта гена CES1 с риском развития кровотечения. В одной из публикаций описан клинический случай, в котором наличие у пациента гомозиготных вариантных аллелей гена ABCB1 и, возможно, изменение активности фермента CYP3A4/5 привело к снижению элиминации ривароксабана и, как следствие, стало причиной кровотечения [8]. Однако существуют исследования, в которых влияние генетических факторов на риск развития кровотечений на фоне терапии ПОАК не подтверждено [12–14]. Поэтому вопрос о взаимосвязи полиморфизмов генов и фармакокинетики ПОАК остается открытым, что диктует необходимость продолжения изучения данного вопроса.
Цель настоящего исследования состояла в оценке влияния полиморфных вариантов гена ABCB1 (rs2032582, rs1045642, rs1128503) и гена CYP3A5 (rs776746) на Сmin,ss/D апиксабана в крови и развитие геморрагических осложнений у пациентов с неклапанной ФП в сочетании с ХБП.
Материал и методы
Протокол исследования рассмотрен и одобрен этическим комитетом ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России (протокол № 16 от 25 ноября 2020 г.).
Дизайн исследования: поперечное (одномоментное) исследование с ретроспективной оценкой геморрагических осложнений.
Критерии включения: пациенты старше 18 лет с неклапанной ФП в сочетании с ХБП стадий С3а, С3б, С4, принимавшие апиксабан. По формуле CKD-EPI на основании уровня креатинина оценивали скорость клубочковой фильтрации (СКФ). Стадия ХБП устанавливалась в зависимости от СКФ: С3а (45–59 мл/мин/1,73 м2), С3б (30–44 мл/мин/1,73 м2, С4 (15–29 мл/мин/1,73 м2) [15]. Пациенты принимали апиксабан в дозе 5 мг два раза в сутки или при наличии двух или более из следующих характеристик: возраст ≥ 80 лет, масса тела ≤ 60 кг или концентрация креатинина в плазме крови ≥ 1,5 мг/дл (133 мкмоль/л) – в дозе 2,5 мг два раза в сутки [16].
Критерии невключения в исследование:
- возраст < 18 лет;
- беременность;
- лактация;
- наличие протезированных клапанов или митрального стеноза средней/тяжелой степени;
- СКФ < 15 мл/мин/1,73м² по CKD-EPI;
- клиренс креатинина (КК) по формуле Кокрофта – Голта < 15 мл/мин;
- обратимые причины ФП (оперативные вмешательства на сердце, тиреотоксикоз, злоупотребление алкоголем);
- клинически значимое активное кровотечение на момент включения в исследование;
- хирургические операции высокого риска;
- травмы головного и спинного мозга;
- переломы в течение предыдущих трех месяцев;
- постоянный прием антиагрегантных препаратов;
- обильное кровотечение любой локализации;
- состояние после перенесенного геморрагического инсульта (или ишемический инсульт с геморрагической трансформацией) в течение последних 12 месяцев;
- внутричерепное кровотечение в анамнезе;
- стадия обострения язвенной болезни желудка или двенадцатиперстной кишки;
- анемия (Нb < 100 г/л) или тромбоцитопения (< 100 × 109/л) любой этиологии;
- известные артериовенозные мальформации, аневризмы сосудов или патология сосудов головного или спинного мозга (из анамнеза);
- системные заболевания соединительной ткани (васкулиты, антифосфолипидный синдром, системная красная волчанка и др.) по данным анамнеза;
- заболевания крови, влияющие на гемостаз;
- онкологические заболевания (анамнестические данные);
- выраженная печеночная недостаточность (классы B и C по шкале Чайлда – Пью) или почечная недостаточность (КК < 15 мл/мин);
- тяжелые психические расстройства;
- длительный прием препаратов с доказанным нефротоксическим действием (нестероидные противовоспалительные средства, антибиотики, цитостатики и др.);
- отказ предоставить информированное согласие;
- ожидаемая низкая приверженность лечению;
- ожидаемая продолжительность жизни менее двух лет.
Геморрагические осложнения (за весь период приема апиксабана, но не более 12 месяцев) оценивали с использованием специального опросника по кровотечениям [17].
Для фармакокинетического тестирования осуществляли забор крови в вакуумные пробирки с литий-гепарином Improvacuter (Guangzhou Improve Medical Instruments Co.Ltd, Китай) емкостью 6 мл через 13–15 часов после последнего приема апиксабана. Материал хранили при температуре -28 °С до момента проведения тестирования. С помощью жидкостного хроматографа Agilent 1200, совмещенного с масс-спектрометром Agilent 6410, определяли Сmin,ss. Поскольку суточная доза апиксабана была различной (5 или 10 мг в сутки), Сmin,ss апиксабана корректировали относительно суточной дозы лекарственного средства (Сmin,ss/D).
Для фармакогенетического исследования выполняли забор 4 мл крови в вакуумные пробирки VACUETTE (Greiner Bio-One, Австрия) с К3 ЭДТА (этилендиаминтетраацетат). Материал хранили при температуре -28 °С до момента проведения тестирования. Используя ДНК-амплификатор CFX96 Touch Real Time System с помощью наборов SNP-Скрин, анализировали полиморфизм rs2032582, rs1045642, rs1128503 гена ABCB1 и полиморфизм rs776746 гена CYP3A5.
Генотипирование проводили в Научно-исследовательском институте молекулярной и персонализированной медицины Российской медицинской академии непрерывного профессионального образования.
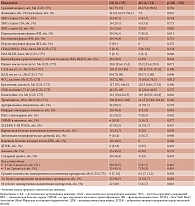
В исследование было включено 67 пациентов с ФП в сочетании с ХБП стадий С3а–С4 (26 (38,8%) мужчин, 41 (61,2%) женщина в возрасте от 58 до 96 лет, средний возраст 84 [75; 91] года), находившихся на терапии апиксабаном и проходивших стационарное лечение в многопрофильном стационаре г. Москвы с 20 мая по 20 ноября 2021 г. (табл. 1).
Из сопутствующих заболеваний пациенты чаще всего страдали артериальной гипертензией (АГ) (97%) и имели хроническую сердечную недостаточность (ХСН) (86,6%).
Анализ лекарственной терапии показал, что подавляющее большинство пациентов (94,1%) получали пять и более лекарственных средств одновременно (табл. 2). Из сопутствующей терапии большинство пациентов (80,6%) принимали препараты из группы блокаторов ренин-ангиотензин-альдостероновой системы. Антиагрегантная терапия была назначена 2 (2,98%) пациентам. Один из них получал комбинацию ацетилсалициловой кислоты и клопидогрела (табл. 2).
Статистическую обработку данных выполняли на основании программного пакета SPSS Statistics 23.0. Нормальность распределения полученных параметров оценивали с использованием критерия Шапиро – Уилка. Описание выборки для ненормально распределенных параметров проводили с помощью подсчета медианы (Ме) и интерквартильного размаха в виде 25-го и 75-го процентилей (С25 и С75), для нормально распределенных параметров – путем определения среднего значения (mean, М) со стандартным отклонением (standart deviation, SD). Категориальные переменные оценивали с помощью точного критерия Фишера, непараметрические показатели – критерия хи-квадрат Пирсона. Статистически значимыми показатели считали при p < 0,05.
Результаты
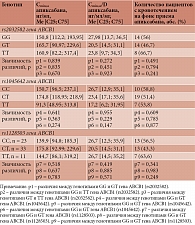
При изучении полиморфизма rs2032582 гена ABCB1 распределение по генотипам оказалось следующим: 25 (37,3%) пациентов с диким генотипом GG, 30 (44,8%) пациентов с гетерозиготным генотипом GT и 12 (17,9%) пациентов с генотипом ТТ. При изучении полиморфизма rs1045642 гена ABCB1 распределение по генотипам выглядело так: 17 (25,4%) пациентов с диким генотипом CC, 37 (55,2%) пациентов с гетерозиготным генотипом TC и 13 (19,4%) пациентов с генотипом ТТ. При оценке полиморфизма rs1128503 гена ABCB1 распределение по генотипам было следующим: 23 (34,3%) пациента с диким генотипом CC, 33 (49,3%) пациента с гетерозиготным генотипом СТ и 11 (16,4%) пациентов с генотипом ТТ. Распределение всех генотипов соответствовало принципу равновесия Харди – Вайнберга. Распределение генотипов полиморфных вариантов rs2032582, rs1045642 и rs1128503 гена ABCB1 представлено в табл. 3.
При сравнении генотипов полиморфных вариантов rs2032582, rs1045642 и rs1128503 гена ABCB1 различий в отношении Сmin,ss/D апиксабана и количества кровотечений не установлено (табл. 4).
При исследовании полиморфизма rs776746 гена CYP3A5 генотипы распределились так: 55 (82,1%) – гомозиготы с генотипом GG и 12 (17,9%) – гетерозиготы с генотипом AG. Распределение этих генотипов соответствовало принципу равновесия Харди – Вайнберга (табл. 5).
При сравнении данных групп обнаружено, что cреди носителей гетерозиготного аллеля AG кровотечения на фоне терапии апиксабаном имели место в 83,3% случаев, тогда как у носителей гомозиготного аллеля GG – в 47,3% (различия статистически значимы: р = 0,023). У носителей гетерозиготного аллеля AG средние значения Сmin,ss/D также были выше апиксабана, но различие не достигло статистической значимости (р = 0,368) (табл. 6).
При сравнении клинических параметров в группах с генотипами GG и AG гена CYP3A5 (rs776746) у пациентов с генотипом GG зафиксирована более высокая частота сердечных сокращений, чем у пациентов с генотипом AG (р = 0,012). По всем другим анализируемым параметрам статистически значимых различий между группами не зарегистрировано (табл. 7).
Обсуждение
Возрастающая частота назначения апиксабана для профилактики тромбоэмболических осложнений у пациентов с ФП обусловлена более высокой безопасностью препарата по сравнению с другими ПОАК [18]. Апиксабан является прямым пероральным обратимым и высокоселективным ингибитором фактора Ха [19, 20]. Ингибируя фактор Ха, апиксабан снижает образование тромбина и тромбов. Препарат не оказывает прямого влияния на агрегацию тромбоцитов, но косвенно ингибирует агрегацию тромбоцитов, индуцированную тромбином [21].
Апиксабан преимущественно метаболизируется изоферментами CYP3A4/5 при незначительном участии изоферментов CYP1A2, CYP2C8, CYP2C9, CYP2C19 и CYP2J2 [22].
В настоящее время наиболее изучена роль нефункционального варианта гена CYP3A5*3 (rs776746, A>G), который характеризуется сниженной экспрессией данного фермента. Носители генотипа CYP3A5*3/*3 не экспрессируют его вовсе [23].
S. Ueshima и соавт. [24] установили, что генотип CYP3A5*3 и функция почек являются потенциальными факторами, которые влияют на минимальные концентрации апиксабана. Минимальное отношение C/D апиксабана в плазме у пациентов с генотипами CYP3A5*1/*3 или *3/*3 cтатистически значимо выше, чем у пациентов с генотипом CYP3A5*1/*1 (p < 0,05) [24].
В нашем исследовании при изучении полиморфных вариантов rs776746 гена CYP3A5 у пациентов с генотипом AG кровотечения в анамнезе встречались чаще, чем у пациентов с генотипом GG. Кроме того, у них отмечалась тенденция к повышению Сmin,ss/D апиксабана в плазме крови. Возможно, различие в результатах обусловлено разными этническими группами пациентов: в исследовании S. Ueshima и соавт. [24] принимали участие пациенты азиатского происхождения, что не позволяет экстраполировать полученные результаты на другие расовые и этнические группы.
Наряду с этим существует исследование, в котором взаимосвязь полиморфизма гена CYP3A5 (rs776746) с концентрацией апиксабана не подтверждена [13].
В метаболизме апиксабана участвует белок-переносчик P-гликопротеин (P-gp) [25], который в свою очередь кодируется геном ABCB1 [26, 27]. Поэтому различные полиморфизмы гена ABCB1 могут влиять на метаболизм апиксабана. Однако в настоящее время в немногочисленных исследованиях, оценивающих потенциальное влияние полиморфных вариантов гена ABCB1 на фармакокинетику апиксабана, не удалось подтвердить взаимосвязь полиморфных вариантов данного гена и концентрации апиксабана в крови [7, 13, 24]. Так, в ряде исследований взаимосвязь между полиморфными вариантами rs1045642 и rs4148738 гена ABCB1 и концентрацией апиксабана не доказана [14, 28].
Результаты нашего исследования сопоставимы с данными литературы: влияние полиморфных вариантов (rs2032582, rs1045642, rs1128503) гена ABCB1 на фармакокинетику апиксабана, равно как и на частоту развития кровотечений, не подтверждено. Отсутствие связи между изученными генетическими полиморфизмами гена ABCB1 и фармакокинетикой апиксабана может быть обусловлено наличием у него нескольких путей метаболизма с участием различных ферментов.
На текущий момент исследований, оценивающих потенциальную связь генетических вариантов с клиническими конечными точками у пациентов, принимающих апиксабан, немного. Анализируя данные о генотипах трех финских биобанков, ученые выявили связь гаплотипа ABCB1 c.2482–2236G>A с более низким риском кровотечений [29]. В нашем исследовании связь между полиморфными вариантами (rs2032582, rs1045642, rs1128503) гена ABCB1 и количеством кровотечений не установлена, что, вероятно, обусловлено небольшим объемом выборки.
Настоящее исследование имеет несколько ограничений: небольшая выборка пациентов, один собранный образец крови для определения Сmin,ss апиксабана в плазме. Это не позволило нам оценить влияние генетических факторов на пиковые концентрации апиксабана в плазме. Кроме того, неоднозначные результаты исследования могут быть обусловлены отсутствием у пациентов крупных кровотечений в анамнезе. В результате не удалось применить стратифицированный анализ, предусматривающий разделение кровотечений на малые и большие, как это было сделано в более крупных исследованиях с применением варфарина [30].
Заключение
У обследованных нами пожилых пациентов с неклапанной ФП и ХБП стадий 3–4 выявлена связь полиморфного варианта rs776746 гена CYP3A5 с развитием кровотечений. Кровотечения преобладали у пациентов с гетерозиготным аллелем AG по сравнению с носителями гомозиготного аллеля GG. При этом влияние полиморфного варианта rs776746 гена CYP3A5 на Сmin,ss/D апиксабана оставалось минимальным. Полиморфизм гена ABCB1 (rs2032582, rs1045642 и rs1128503) не влиял на Сmin,ss апиксабана и количество кровотечений.
Для определения роли фармакогенетических факторов в метаболизме апиксабана необходимы более масштабные исследования с участием различных этнических групп.
Финансирование.
Работа поддержана грантом РНФ № 22-15-00251 «Персонализированное применение прямых
оральных антикоагулянтов
на основе фармакогеномного подхода».
Конфликт интересов.
Авторы заявляют об отсутствии конфликта интересов.
S.V. Batyukina, M.S. Chernyaeva, PhD, K.B. Mirzaev, PhD, Sh.P. Abdullaev, PhD, J.A. Sozaeva, P.O. Bochkov, PhD, O.D. Ostroumova, PhD, Prof., D.A. Sychev, PhD, Prof., Academician of RAS
Russian Medical Academy of Continuous Professional Education
Hospital for War Veterans № 2
Research Institute of Molecular and Personalized Medicine, Russian Medical Academy of Continuous Professional Education
Contact person: Svetlana V. Batyukina, batyukina.svetlana@yandex.ru
The presence of polymorphic variants of genes involved in its metabolism can be one of the possible causes of an increased risk of bleeding during apixaban administration.
The aim of this study was to investigate the influence of polymorphic variants of ABCB1 (rs2032582, rs1045642, rs1128503) and CYP3A5 (rs776746) genes on bleeding development and residual equilibrium concentration (Cmin,ss/D) levels of apixaban in patients with non-valvular atrial fibrillation (AF) and C3–C4 stage chronic kidney disease (CKD).
Material and methods. Sixty-seven patients with AF and CKD who received apixaban at a dose of 5 mg or 2.5 mg 2 times daily (mean age 84 {75; 91] years) were examined. Hemorrhagic complications were retrospectively evaluated, Cmin,ss/D of apixaban in plasma was measured, and pharmacogenetic analysis was performed.
Results. Patients with heterozygous AG allele of CYP3A5 gene (rs776746) had more frequent occurrence of bleeding against the background of apixaban therapy than patients with homozygous GG allele: they were registered in 83.3% of patients with heterozygous AG allele of CYP3A5 gene (rs776746) and in 47.3% of patients with homozygous GG allele of CYP3A5 gene (p = 0,023). Also, patients with the AG allele of the CYP3A5 gene (rs776746) had slightly higher Cmin,ss/D of apixaban in plasma (31.95 [15.2; 35.8] and 20.95 [13.2; 34.3] ng/mL respectively; p = 0.368) compared to patients with the GG allele of the CYP3A5 gene (rs776746).
No statistically significant differences were found in the number of bleeds and in Cmin,ss/D of apixaban in blood plasma in the examined patients depending on the presence of polymorphic variants of the ABCB1 gene (rs2032582, rs1045642 and rs1128503).
Conclusion. Patients with AF and CKD with heterozygous AG allele of CYP3A5 gene (rs776746) have a greater number of bleeding events against the background of apixaban administration.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.