Применение комбинированной антитромботической терапии у пациентов с артериальной гипертензией и мультифокальным атеросклерозом
- Аннотация
- Статья
- Ссылки
- English
Цель – сравнить эффективность двойной антитромботической терапии (ацетилсалициловая кислота (АСК) + ривароксабан) у пациентов с АГ и МФА с/без перенесенного ИИ в анамнезе.
Материал и методы. В исследование включено 219 пациентов (средний возраст – 59,4 ± 8,01 года) с контролируемой АГ и МФА. Первая группа – 110 человек (АГ 2-й степени). Вторая группа – 109 больных (АГ 3-й степени и атеротромботический ишемический инсульт в анамнезе). Состояние системы коагуляционного гемостаза оценивали с помощью локальных и глобальных тестов. Всем пациентам определяли уровень высокочувствительного С-реактивного белка (вчСРБ) и интерлейкина 6 (ИЛ-6). Пациенты были случайным образом распределены на две группы: основную (прием АСК 100 мг в день + ривароксабан 2,5 мг два раза в день) и контрольную (АСК 100 мг в день). Период лечения составил шесть месяцев. Качество жизни оценивали по краткой форме опросника SF-36 до рандомизации и через шесть месяцев лечения. Через 18 месяцев определяли первичные конечные точки (острая сосудистая катастрофа, сердечно-сосудистая смерть, госпитализация).
Заключение. Комбинация АСК и ривароксабана может улучшить качество жизни больных и снизить частоту развития сердечно-сосудистых осложнений при индивидуальном подходе к терапии и надлежащей оценке геморрагических рисков.
Цель – сравнить эффективность двойной антитромботической терапии (ацетилсалициловая кислота (АСК) + ривароксабан) у пациентов с АГ и МФА с/без перенесенного ИИ в анамнезе.
Материал и методы. В исследование включено 219 пациентов (средний возраст – 59,4 ± 8,01 года) с контролируемой АГ и МФА. Первая группа – 110 человек (АГ 2-й степени). Вторая группа – 109 больных (АГ 3-й степени и атеротромботический ишемический инсульт в анамнезе). Состояние системы коагуляционного гемостаза оценивали с помощью локальных и глобальных тестов. Всем пациентам определяли уровень высокочувствительного С-реактивного белка (вчСРБ) и интерлейкина 6 (ИЛ-6). Пациенты были случайным образом распределены на две группы: основную (прием АСК 100 мг в день + ривароксабан 2,5 мг два раза в день) и контрольную (АСК 100 мг в день). Период лечения составил шесть месяцев. Качество жизни оценивали по краткой форме опросника SF-36 до рандомизации и через шесть месяцев лечения. Через 18 месяцев определяли первичные конечные точки (острая сосудистая катастрофа, сердечно-сосудистая смерть, госпитализация).
Заключение. Комбинация АСК и ривароксабана может улучшить качество жизни больных и снизить частоту развития сердечно-сосудистых осложнений при индивидуальном подходе к терапии и надлежащей оценке геморрагических рисков.



Введение
Пациенты с мультифокальным атеросклерозом (МФА) имеют повышенный риск атеротромботических событий в нескольких сосудистых бассейнах. Одним из основных клинических проявлений МФА является ишемический инсульт (ИИ). Среди факторов риска как первого, так и повторного ИИ выделяют артериальную гипертензию (АГ), дислипидемию, сахарный диабет, курение. У пациентов с АГ и МФА практически всегда присутствует дислипидемия, что приводит к отложению липидов в субэндотелиальном пространстве, воспалению сосудистой стенки и последующему тромбообразованию [1]. У пациентов с перенесенным ИИ кроме имеющейся дислипидемии происходит быстрое и обширное высвобождение полиненасыщенных жирных кислот (ПНЖК) сразу после начала ишемии, в результате чего липидные медиаторы, полученные из ПНЖК, способствуют повреждению головного мозга [2]. Накопление липидов в артериальной стенке способствует воспалительному каскаду [3]. Воспалительная активация отражается в системном высвобождении цитокинов, таких как интерлейкин 6 (ИЛ-6), и повышенном уровне С-реактивного белка (СРБ) [4].
После перенесенного ИИ активируется микроглия, которая подвергается сложным процессам, включающим дополнительную секрецию цитокинов, хемотаксис, фагоцитоз и пролиферацию [5]. Окислительный стресс способствует окислению фибриногена, изменяя его структуру и функцию, что приводит к образованию более плотных, более резистентных к лизису фибриновых сгустков [6]. Поскольку активация и агрегация тромбоцитов играют доминирующую роль в патогенезе атеросклероза и атеротромбоза, назначение антиагрегантов является первоочередной задачей. Несмотря на постоянный прием ацетилсалициловой кислоты (АСК), пациенты со стабильными сердечно-сосудистыми заболеваниями остаются в группе повышенного остаточного риска из-за роли коагуляционного звена гемостаза в развитии артериальных осложнений.
Назначение низких доз антикоагулянтов (ривароксабан 2,5 мг два раза в день) в дополнение к АСК в исследовании COMPASS приводило к снижению риска инсульта на 42% [7], так как ривароксабан способен улучшать характеристики фибринового сгустка и тем самым способствовать снижению риска неблагоприятных клинических исходов. В свою очередь АСК за счет ацетилирования остатков лизина приводит к увеличению проницаемости сгустка, повышая его восприимчивость к фибринолитику [8]. Таким образом, применение двойной антитромботической терапии может стать важным шагом для снижения риска сердечно-сосудистых осложнений у пациентов с АГ и МФА.
В настоящее время многие исследования оценивают безопасность и эффективность двойной антитромботической терапии у пациентов с атеросклеротическими заболеваниями, но только единичные работы посвящены изучению качества жизни (КЖ) у пациентов с АГ и МФА, особенно на фоне комбинации АСК + ривароксабан. Цель – сравнить эффективность двойной антитромботической терапии (АСК + ривароксабан) у пациентов с АГ и МФА с/без перенесенного ИИ в анамнезе.
Материал и методы
Всего обследовано 219 пациентов в возрасте 40–70 лет, средний возраст 59,4 ± 8,01 года, с АГ и МФА. Пациенты, участвующие в исследовании, поделены на две группы:
- первая группа (110 пациентов с контролируемой АГ 2-й степени);
- вторая группа (109 пациентов с контролируемой АГ 3-й степени, перенесших ишемический инсульт).
Все пациенты получали стандартную антигипертензивную, гиполипидемическую терапию, а также антиагрегантную терапию (ацетилсалициловую кислоту (АСК) – 100 мг) в монотерапии. Цифры артериального давления контролировались на целевом уровне, показатели холестерина липопротеинов низкой плотности (ЛПНП) при включении в исследование достигли только у 21,2% пациентов. Исследование проводилось в соответствии с Хельсинкской декларацией, информированное согласие на участие в исследовании подписали все участники. Исследование одобрено этическим комитетом УГМУ (протокол от 19.11.2021 г. № 10).
Критерии невключения в исследование:
- симптомное атеросклеротическое заболевание (ишемическая болезнь сердца, заболевания сосудов нижних конечностей);
- сахарный диабет;
- фибрилляция предсердий;
- геморрагический инсульт в анамнезе.
Также не включали пациентов, имеющих декомпенсированные заболевания печени и почек, эндокринной системы, злокачественные новообразования, аутоиммунные заболевания, психические заболевания, соматические заболевания в острой стадии, сопутствующие заболевания, способные значительно повысить риск развития кровотечения (язвенная болезнь желудка/двенадцатиперстной кишки, крупные кровотечения в анамнезе, недавно перенесенное хирургическое вмешательство, прием нестероидных противовоспалительных препаратов в больших дозах). Диагноз АГ устанавливался на основании клинических рекомендаций «Артериальная гипертензия у взрослых», 2020 г. [9]. Диагноз МФА устанавливался при атеросклеротическом поражении двух и более артериальных бассейнов по данным сонографии с гемодинамически незначимыми стенозами (25–49%). Дислипидемия регистрировалась на основании клинических рекомендаций «Нарушения липидного обмена» (РКО, 2023) [10].
Пациенты каждой группы методом конвертов были рандомизированы на две подгруппы:
в первой группе:
- подгруппа 1а (n = 55) принимала ривароксабан – 2,5 мг два раза в день + АСК – 100 мг;
- подгруппа 1b (n = 55) – в монотерапии АСК в дозе 100 мг в день.
во второй группе:
- подгруппа 2а (n = 55) получала ривароксабан – 2,5 мг 2 раза в день + АСК – 100 мг,
- подгруппа 2b (n = 54) – в монотерапии АСК в дозе 100 мг в день.
Всем пациентам к схемам лечения при необходимости был добавлен ингибитор протонной помпы. Каждый месяц проводились контроль режима приема лекарственных препаратов и оценка нежелательных явлений, один раз в три месяца или чаще (при необходимости) анализировался уровень гемоглобина и креатинина с расчетом скорости клубочковой фильтрации. Период лечения составил шесть месяцев. Для выявления нарушений гемостаза всем пациентам определяли показатели гемостазиограммы с помощью скрининговых (локальных) тестов:
- протромбиновый индекс (ПТИ);
- международное нормализованное отношение (МНО);
- активированное частичное тромбопластиновое время (АЧТВ);
- фибриноген;
- D-димер;
- антитромбин III.
Одновременно со стандартной коагулограммой выполнялся глобальный тест тромбодинамики (ТД) в медико-фармацевтическом центре «Гармония» (г. Екатеринбург), с использованием лабораторной диагностической системы «Регистратор тромбодинамики Т-2» («ГемаКор», г. Москва), что дает возможность интегральной оценки работы свертывающей системы в сосудистом русле.
Всем пациентам проводили определение уровня высокочувствительного СРБ (вчСРБ) и ИЛ-6. Оценка КЖ пациентов проводилась с использованием краткой формы опросника состояния здоровья SF-36 до лечения ривароксабаном и через шесть месяцев после терапии. Опросник SF-36, состоящий из 36 пунктов, которые направлены на оценку состояния здоровья и функционирования пациента по его самооценке, включает восемь шкал:
- физическое функционирование (PF);
- ролевое функционирование, обусловленное физическим состоянием (RP);
- интенсивность боли (BP);
- общее состояние здоровья (GH);
- жизненная активность (VT);
- социальное функционирование (SF);
- ролевое функционирование, обусловленное эмоциональным состоянием (RE);
- психическое здоровье (MH).
Каждая шкала была перекодирована соответствующим образом. Шкалы SF-36 могут быть объединены в сводные баллы физического (PH) и психического (МН общий) компонентов здоровья [11].
Диапазон оценок для всех шкал SF-36 составляет 0–100 баллов, а для итоговых физического и психического компонентов средний балл составляет 50 со стандартным отклонением ± 10. При этом более высокие баллы указывают на лучшее КЖ [12]. Статистический анализ был проведен с помощью программы StatTech v.4.7.2 (разработчик – «Статтех», Россия). Данные после проверки на нормальность распределения представлены в виде средних арифметических величин (М) и стандартных отклонений (SD), границ 95%-ного доверительного интервала (95% ДИ) или медианы (Мe) и межквартильного диапазона (25%, 75%).
Для парного сравнения независимых выборок использовали U-критерий Манна – Уитни. Для сравнения групп по первичным конечным точкам рассчитывали относительный риск (ОР) с 95% ДИ, а также использовали точный тест Фишера. Статистически значимыми считали различия при p < 0,05.
Результаты
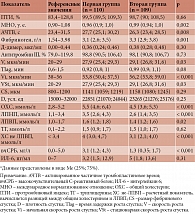
Исходные показатели гемостаза, липидные параметры и маркеры воспаления в первой и второй группах представлены в табл. 1. У пациентов с перенесенным инсультом отмечались значимые изменения в сторону коагуляции как локальных, так и глобальных показателей гемостаза: уровни МНО и фибриногена были выше, а АЧТВ ниже в рамках референсных значений. Более выраженные гиперкоагуляционные сдвиги выявлены по данным глобальных тестов: такие показатели, как скорость роста сгустка, начальная и стационарная скорость роста сгустка также были достоверно выше у пациентов второй группы, что свидетельствует о нарушениях гемостаза, несмотря на постоянный прием АСК. Показатели липидных параметров (ОХС, ХС-ЛНП, ХС не-ЛВП, ммоль/л) и уровень вчСРБ были ниже у пациентов с ИИ, что свидетельствует о большей приверженности лечению пациентов после перенесенного сосудистого события. После рандомизации пациентов в подгруппы ривароксабана/стандартной терапии через шесть месяцев оценивали динамику показателей гемостаза, липидных параметров и воспалительных маркеров (табл. 2).
В подгруппах, получавших ривароксабан, нормализовались все параметры локальных и глобальных тестов, значимых различий между группами по показателям, характеризующим коагуляционный гемостаз, выявлено не было. Это свидетельствует о том, что лечение ривароксабаном может принести пользу разным категориям пациентов. Также в подгруппах 1a и 2a улучшились показатели липидного спектра и воспалительных маркеров, что отражает наличие плейотропных эффектов у ривароксабана. Пациенты подгрупп 1b и 2b, находящиеся на стандартной терапии, демонстрировали смещение как локальных (МНО, АЧТВ), так и глобальных показателей гемостаза (V, Vi, Vst, CS) в сторону гиперкоагуляции, что может быть связано с наличием в крови пациентов прокоагулянтных факторов (следы тканевого фактора). Показатели липидного спектра значимо не отличались между подгруппами. Уровень СРБ был ниже, а уровень ИЛ-6 выше у пациентов, перенесших инсульт.
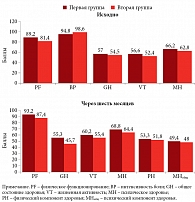
Шкалы физического и психического компонентов здоровья, отражающих КЖ пациентов группы 1 и 2, исходно и через шесть месяцев показаны на рис. 1.
При анализе КЖ на исходном уровне было обнаружено, что пациенты первой группы имели более высокие баллы по всем шкалам SF-36, за исключением BP, который был выше у пациентов второй группы. Значимые различия касались шкал физического компонента здоровья:
- PF – 89,2 балла против 81,4 балла, p < 0,001;
- BP – 94,8 балла против 98,6 балла, p < 0,001;
- GH – 57 баллов против 54,5 балла, p = 0,03.
А также шкал психического компонента здоровья:
- VT – 56,6 балла против 52,4 балла, p = 0,003;
- MH – 66,2 балла против 62,8 балла, p = 0,002.
Через шесть месяцев лечения все баллы в обеих группах стали выше, чем на исходном уровне, что свидетельствует об улучшении КЖ. Что касается отдельных шкал, связанных с физическим здоровьем, статистически значимые различия наблюдались в PF (93,2 балла против 87,4 балла, p < 0,001) и были выше у пациентов с АГ. Показатель общего здоровья снизился у пациентов обеих групп. Среди шкал психического здоровья: статистически значимые различия были обнаружены в VT (60,2 балла против 55,4 балла, p < 0,001) и MH (68,8 балла против 64,6 балла, p < 0,001), которые были выше у пациентов первой группы, как и итоговые компоненты психического и физического здоровья.
После рандомизации в подгруппы ривароксабана проведено сравнение показателей КЖ среди пациентов, получавших комбинированную терапию (АСК + ривароксабан) и монотерапию АСК (табл. 3).
Пациенты подгрупп 1a и 2а показали улучшение КЖ по всем шкалам, за исключением общего состояния здоровья. Статистически значимая разница в лучшую сторону в подгруппе 1а была выявлена в физическом компоненте здоровья и его составляющих: физическом функционировании, общем состоянии здоровья (p < 0,001). Не было обнаружено существенных различий в психических компонентах между пациентами подгрупп 1а и 2а.
Исследование показало значительное ухудшение различных аспектов качества жизни у пациентов подгрупп 1b и 2b. Это касалось как общих компонентов физического и психического здоровья, так и их составляющих, которые были значимо ниже у пациентов с перенесенным инсультом:
- PF – 84,2 балла против 92,3 балла, p < 0,001;
- GH – 41,9 балла против 55 баллов, p < 0,001;
- VT – 53,3 балла против 59,5 балла, p = 0,001;
- МН – 62,4 балла против 68,7 балла, p < 0,001.
Первичные конечные точки исследования:
- острая сосудистая катастрофа (инсульт, инфаркт) – подгруппы 1а – 0 (0%), 1b – 0 (0%), 2а – 1 (1,8%), 2b – 5 (9,3%);
- госпитализация по сердечнососудистым причинам – подгруппы 1а – 4 (7,3%), 1b – 2 (3,6%), 2а – 2 (3,6%), 2b – 6 (11,1%);
- госпитализация по любым причинам – подгруппы 1а – 4 (7,3%), 1b – 4 (7,3%), 2а – 2 (3,6%), 2b – 15 (27,8%);
- смерть по сердечно–сосудистым причинам – подгруппы 1а – 0 (0%), 1b – 0 (0%), 2а – 1 (1,8%), 2b – 3 (5,5%).
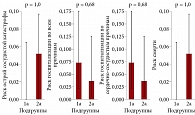
Результаты статистического анализа по первичным конечным точкам между подгруппой 1а и подгруппой 2а, зарегистрированные в период наблюдения, представлены на рис. 2.
Точечная оценка риска в одной из подгрупп равна нулю, поэтому рассчитывали 95%-ные доверительные интервалы для рисков в каждой подгруппе для каждого исхода. Значимые отличия между подгруппами 1а и 2а, согласно точному тесту Фишера, не получены: острая сосудистая катастрофа (р = 1,0) госпитализация по любым причинам (р = 0,68), госпитализация по сердечно-сосудистым причинам (р = 0,68), смерть по сердечно-сосудистым причинам (р = 1,0).
Результаты статистического анализа по первичным конечным точкам между подгруппой 1b и подгруппой 2b представлены на рис. 3.
В подгруппе 1b острая сосудистая катастрофа (р = 0,03) и госпитализация по всем причинам (р = 0,01) были значимо ниже по сравнению с подгруппой 2b. По остальным конечным точкам разница между подгруппами не получена.
Обсуждение
Пациенты с АГ и МФА подвержены высокому риску сердечно-сосудистых осложнений. Одним из факторов, которые могут увеличивать остаточный риск, является нарушение коагуляционного звена гемостаза. Пациенты с перенесенным ИИ имеют более выраженные нарушения гемостаза по сравнению с пациентами без него. Этому способствуют повышенные уровни тромбина в мозге после инсульта из-за нарушения гематоэнцефалического барьера (ГЭБ) и поступления протромбина в мозг, в меньшей степени из-за синтеза протромбина в мозге [13]. Высокая концентрация тромбина приводит к гибели нейронов, усиливая эксайтотоксичность и нейровоспалительную реакцию [14]. В то же время уровни липидных параметров и уровни вчСРБ были значимо ниже во второй группе, что могло быть связано с более высокой приверженностью к терапии статинами после перенесенного инсульта. Другие исследователи также отметили, что статины снижают уровень вчСРБ и провоспалительных цитокинов [15].
Однако в представленном исследовании у пациентов с ИИ уровень ИЛ-6 был выше, чем в первой группе. В недавней работе [16] установлено, что постоянное воспаление, на которое указывают повышенный уровень ИЛ-6, коррелирует с худшим долгосрочным функциональным прогнозом и может приводить к рецидиву инсульта. Таким образом, у пациентов с АГ и МФА в качестве маркеров остаточного риска присутствуют нарушения гемостаза, липидного спектра и воспалительные маркеры. Гиперкоагуляционный фенотип, который выявляется при проведении теста ТД у пациентов с АГ и МФА, несмотря на комплексную терапию, свидетельствует о выходе коагуляционного звена на первый план при развитии атеротромбоза, так как продукция тромбина происходит непрерывно [17].
Добавление низкой дозы ривароксабана (2,5 мг два раза в день) может влиять на образование фибрина и подавлять активацию и агрегацию тромбоцитов [18]. При приеме ривароксабана во время настоящего исследования отмечены улучшения по всем параметрам гемостаза, без значимых отличий между подгруппами, несмотря на то что при включении в исследование у пациентов второй группы были более выраженные изменения.
Это свидетельствует о том, что наибольшую пользу добавление ривароксабана принесет пациентам с перенесенным инсультом. В развитии атеротромбоза также играет роль слабовыраженное хроническое воспаление. Существует тесная взаимосвязь между белками, участвующими в процессе коагуляции, и факторами воспаления. Одним из ключевых элементов этой связи является тромбин, который взаимодействует с рецепторами, активируемыми протеазой 2 (PAR2). Эти рецепторы, расположенные на поверхности эндотелиальных клеток, стимулируются фактором Ха, что способствует миграции лейкоцитов и нарушению функций эндотелия [19].
Ингибирование двойного пути с помощью низких доз ривароксабана и АСК у пациентов с установленным диагнозом ИБС и/или ЗПА было связано со снижением уровня маркеров воспаления, таких как ИЛ-6 и фибриноген [20]. При сравнении подгрупп без ривароксабана в подгруппе 1b был выше уровень вчСРБ, в подгруппе 2b – ИЛ-6. Полученные результаты подтверждены другими авторами, которые отмечали, что повышенные уровни фибриногена и ИЛ-6 были независимыми предикторами смертности у пациентов, переживших инсульт, тогда как повышенный уровень вчСРБ предсказывал смертность у лиц без инсульта [21].
Что касается липидных параметров при приеме ривароксабана, отмечено улучшение липидного профиля в обеих подгруппах, но более выраженное снижение ЛПНП наблюдалось в подгруппе с перенесенным инсультом, что согласуется с известным эффектом снижения уровня липидов, приписываемым инсульту [22].
При оценке КЖ практически все показатели были ниже в группе инсульта. У таких пациентов КЖ ухудшается из-за физических и психологических последствий инсульта, включая снижение активности, беспокойство и стресс [23]. В подгруппах ривароксабана КЖ улучшилось в сравнении со стандартной терапией, однако также более низкие показатели наблюдались у пациентов с инсультом. Даже через пять лет, согласно научным источникам, качество жизни выживших после инсульта оставалось ниже уровня общей популяции [24]. Применение ривароксабана может улучшить КЖ как за счет антикоагулянтного эффекта, так и за счет плейотропных эффектов: уменьшение выраженности атеросклероза, воспалительных медиаторов [25]. Пациенты в подгруппах стандартной терапии показали ухудшение КЖ как в физическом, так и в психологическом аспекте. Предыдущие исследования сообщают, что у пациентов, перенесших инсульт, качество жизни действительно улучшается при реабилитации через 6–12 месяцев после инсульта по сравнению с острой фазой [26].
Однако после годового наблюдения за пациентами, перенесшими инсульт, уровень КЖ оставался ниже, чем у людей того же возраста из общей популяции [27]. При использовании комбинации ацетилсалициловой кислоты (АСК) с ривароксабаном в дозе 2,5 мг два раза в день не было выявлено различий в конечных точках, независимо от перенесенного инсульта. Можно предположить, что добавление ривароксабана может положительно влиять на риск возникновения неблагоприятных сердечно-сосудистых осложнений, независимо от того, были ли ранее диагностированы сердечно-сосудистые заболевания.
В то же время первичная конечная точка (острая сосудистая катастрофа) значимо чаще регистрировалась у пациентов с ИИ на стандартной терапии. Полученные данные свидетельствуют о том, что нужна более ранняя интенсификация терапии у пациентов с перенесенным событием. В исследовании LTOLE, которое явилось продолжением исследования COMPASS, применение комбинации АСК и ривароксабана сопровождалось снижением первичных конечных точек, включая инсульт и кровотечения, на протяжении года наблюдения [28]. Персонализация терапии с двойным ингибированием путем тщательного отбора пациентов может привести к большему эффекту в снижении риска сердечно-сосудистых заболеваний, чем монотерапия аспирином.
Заключение
Пациенты с АГ и МФА имеют высокий риск развития сердечно-сосудистых осложнений, особенно при наличии инсульта в анамнезе. У пациентов с перенесенным ИИ отмечаются более выраженные изменения в коагуляционном звене гемостаза, воспалительных маркеров, КЖ. Первичная конечная точка регистрировалась чаще у пациентов с инсультом в анамнезе. При использовании комбинации АСК + ривароксабан 2,5 мг два раза в день отмечалась не только нормализация лабораторных показателей и качества жизни, но также снижалась частота развития серьезных сердечно-сосудистых осложнений. Индивидуальный подход к терапии и надлежащая оценка геморрагических рисков может минимизировать осложнения двойной антитромботической терапии у пациентов с АГ и МФА.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки.
S.S. Vedenskaya, E.S. Voroshilina, E.D. Prazdnichkova, O.G. Smolenskaya
Ural State medical University
ООО Medical and Pharmaceutical Center ‘Garmoniya’
Contact person: Svetlana S. Vedenskaya, ssveden@yandex.ru
Patients with arterial hypertension (AH) and multifocal atherosclerosis (MFA) are at high risk of cardiovascular complications, one of which is ischemic stroke (IS). Therefore, new therapeutic strategies are needed to further reduce the residual risk that is present in these patients.
Purpose – to compare the effectiveness of dual antithrombotic therapy (acetylsalicylic acid (ASA) + rivaroxaban) in patients with hypertension and MFA with/without a history of IS.
Material and methods. The study included 219 patients (mean age 59.4 ± 8.01 years) with controlled hypertension and MFA, of whom 110 were stage 2 hypertension (group 1), 109 were stage 3 hypertension and a history of atherothrombotic hypertension (group 2). The condition of the coagulation hemostasis system was assessed using local and global tests. All patients underwent determination of the level of highly sensitive C-reactive protein (CRP) and interleukin 6 (IL-6). Patients were randomized into the main group (ASA 100 mg daily + rivaroxaban 2.5 mg twice daily) and the comparison group (ASA 100 mg daily). The treatment period was six months. The quality of life was assessed using the short form of the SF-36 questionnaire before randomization and after six months of treatment. After 18 months, the primary endpoints (acute vascular catastrophe, cardiovascular death, hospitalization) were evaluated.
Results. Significant changes in hemostasis, inflammatory markers, and QOL were observed in patients with stroke. The use of combination therapy (ASA + rivaroxaban) made it possible to normalize the identified changes regardless of the presence of a stroke. Primary endpoints were more frequently reported in patients with IS on standard therapy.
Conclusion. The combination of ASA and rivaroxaban can improve QOL in patients and reduce the incidence of cardiovascular complications with an individual approach to therapy and proper assessment of hemorrhagic risks.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.