Трудные вопросы и возможные решения повышения эффективности антиишемической терапии
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – сравнить биоэквивалентность препарата Тримектал® ОД 80 мг и референтного препарата Предуктал® ОД 80 мг.
Материал и методы. В исследовании участвовали 25 пациентов, которых разделили на группы Тримектала ОД и Предуктала ОД. В ходе исследования оценивали жизненные показатели пациентов, фармакологические показатели триметазидина, а также на протяжении всего исследования изучали безопасность препаратов.
Результаты. В отношении эффективности препараты достоверно не различались. При оценке 90%-ных доверительных интервалов для отношений средних геометрических значений фармакокинетических параметров триметазидина AUC0-t и Cmax для сравниваемых препаратов Тримектал® и Предуктал® было сделано заключение, что определенные доверительные интервалы не выходят за рамки биоэквивалентности 90% и находятся в диапазоне 80–125%. Оба препарата не влияли на основные жизненные показатели, электрокардиограмму, состав крови и мочи.
Выводы. Исходя из полученных результатов, можно констатировать, что препарат Тримектал® ОД полностью биоэквивалентен препарату Предуктал® ОД.
Цель исследования – сравнить биоэквивалентность препарата Тримектал® ОД 80 мг и референтного препарата Предуктал® ОД 80 мг.
Материал и методы. В исследовании участвовали 25 пациентов, которых разделили на группы Тримектала ОД и Предуктала ОД. В ходе исследования оценивали жизненные показатели пациентов, фармакологические показатели триметазидина, а также на протяжении всего исследования изучали безопасность препаратов.
Результаты. В отношении эффективности препараты достоверно не различались. При оценке 90%-ных доверительных интервалов для отношений средних геометрических значений фармакокинетических параметров триметазидина AUC0-t и Cmax для сравниваемых препаратов Тримектал® и Предуктал® было сделано заключение, что определенные доверительные интервалы не выходят за рамки биоэквивалентности 90% и находятся в диапазоне 80–125%. Оба препарата не влияли на основные жизненные показатели, электрокардиограмму, состав крови и мочи.
Выводы. Исходя из полученных результатов, можно констатировать, что препарат Тримектал® ОД полностью биоэквивалентен препарату Предуктал® ОД.

Введение
По данным исследования Глобального бремени болезней (GBD) 2019 г., ведущими причинами смерти в мире и одними из основных факторов инвалидности среди всех заболеваний сердечно-сосудистой системы являются инсульт и ишемическая болезнь сердца (ИБС) [1]. Общее число DALY (сумма лет жизни, потерянных преждевременно, и лет, прожитых с инвалидностью) вследствие ИБС с 1990 по 2019 г. возросло до 185 млн. До 9,14 млн увеличилось число смертей, что превысило половину всех зарегистрированных случаев сердечно-сосудистой смерти. До 197 млн возросло число зарегистрированных случаев ИБС, несмотря на значительные достижения последних лет в области профилактики, медикаментозного и хирургического лечения данного заболевания [1]. Не случайно подходы к лечению больных ИБС по-прежнему находятся в центре внимания практикующих врачей.
Современная концепция ведения пациентов с ИБС основана на пациент-ориентированном подходе, когда ранняя диагностика и оптимальное лечение являются первоочередными и приоритетными задачами. Такой подход успешно представлен в современных российских клинических рекомендациях по стабильной ИБС. В них вместо разделения на группы препаратов, устраняющих симптомы, и препаратов, направленных на профилактику сердечно-сосудистых осложнений, предусмотрен пошаговый подход с учетом характеристик пациента и его клинического статуса [2].
Согласно актуальным клиническим рекомендациям по лечению стабильных форм ИБС, в качестве оптимальной медикаментозной терапии для устранения стенокардии/ишемии миокарда рекомендуется назначать препараты первой и второй линии, используя при этом пошаговый подход [2]. При недостаточной эффективности препаратов первой линии у пациентов со стабильной стенокардией целесообразно к терапии добавлять один из препаратов второй линии (ивабрадин, триметазидин, ранолазин или никорандил) в зависимости от уровня артериального давления (АД), частоты сердечных сокращений (ЧСС) с целью профилактики приступов стенокардии и достижения I функционального класса (ФК) [2]. Для снижения частоты приступов стенокардии и улучшения толерантности к физическим нагрузкам у пациентов с ИБС с исходно низкой ЧСС и низким АД ранолазин или триметазидин могут быть рассмотрены в качестве препаратов первой линии [2].
Отсутствие выраженного влияния на ЧСС, уровень АД и ряд сопутствующих заболеваний делает триметазидин препаратом выбора для значительной категории пациентов с клиникой ишемии. Как известно, триметазидин благодаря своему механизму действия – частичное переключение процесса образования аденозинтрифосфата (АТФ) с окисления длинноцепочечных жирных кислот (ЖК) на окисление пирувата – приводит к оптимизации использования кислорода, что позволяет кардиомиоцитам продолжать синтезировать АТФ в условиях ишемии. Уменьшая негативные последствия ишемии миокарда на этапе развития метаболических нарушений, триметазидин обеспечивает кардиопротективный и антиишемический эффекты в отсутствие нежелательных побочных явлений [3–5].
Триметазидин и его доказанные позиции
Более двух десятилетий экспертами международных и российских профессиональных сообществ триметазидин рекомендуется в качестве препарата второй линии при стабильной стенокардии напряжения. Триметазидин является первым лекарственным препаратом из группы миокардиальных цитопротекторов, который впервые был рекомендован ESC в 1997 г. в качестве препарата для метаболической терапии при стабильной стенокардии напряжения, что подтверждено в рекомендациях ESC 2006, 2013 и 2019 гг. [6, 7]. В настоящее время на основании результатов ряда контролируемых клинических исследований специалисты разных профессиональных научно-практических медицинских обществ (ESC, Американская ассоциация сердца, Российское общество кардиологов и др.) рассматривают триметазидин как эффективный антиишемический и антиангинальный препарат для лечения пациентов разного возраста с диагнозом стабильной стенокардии [2, 6, 8, 9]. Данные кокрейновского метаанализа 22 исследований свидетельствуют о том, что триметазидин существенно снижает количество и частоту приступов стенокардии, увеличивая переносимость физической нагрузки. При этом частота нежелательных явлений на фоне применения триметазидина сопоставима с таковой при использовании плацебо [10]. Отечественные исследователи доказали эффективность триметазидина в крупных исследованиях, таких как ТРИУМФ, ПРИМА, ПАРАЛЛЕЛЬ, ПЕРСПЕКТИВА. Убедительно показана целесообразность назначения триметазидина в комплексной терапии пациентов с хроническими формами ИБС [2].
В экспериментальных и клинических работах показано, что триметазидин – селективный ингибитор бета-окисления ЖК у больных ИБС, в том числе перенесших инфаркт миокарда, повышает физическую работоспособность, уменьшает выраженность ишемии миокарда, оказывает антиаритмическое действие, сокращая число желудочковых и наджелудочковых экстрасистол, влияет на содержание ионов натрия и кальция в кардиомиоцитах, увеличивает биодоступность оксида азота, способствует увеличению стабильности и сохранению целостности клеточных мембран за счет способности встраивания в фосфолипиды клеточных мембран недоокисленных ЖК [11, 12]. Триметазидин может подавлять воспаление и развитие фиброза миокарда, снижая образование свободных радикалов кислорода, способных стимулировать рост гладкомышечных клеток и отложение коллагена [13]. В последнее время стали появляться сведения о положительном влиянии триметазидина на дисперсию QT – предиктора аритмогенности [14].
Результаты ряда исследований демонстрируют, что лечение триметазидином приводит к снижению частоты приступов стенокардии и потребности в приеме нитроглицерина (на 50–66%), повышению толерантности к физической нагрузке у больных стенокардией напряжения [10, 15]. Применение триметазидина у пациентов c ИБС c экстрасистолией ассоциируется с достоверным снижением выраженности нарушений ритма сердца – желудочковой и наджелудочковой экстрасистолии, а также количеством эпизодов тахикардии [16].
Триметазидин – препарат, нормализующий метаболизм миокарда, уменьшающий гипоксию кардиомиоцитов, находящихся в состоянии ишемии. Триметазидин предотвращает снижение внутриклеточного содержания АТФ, обеспечивает нормальное функционирование мембранных ионных каналов, трансмембранный перенос ионов калия и натрия и соответственно сохранение клеточного гомеостаза.
По данным Европейского регистра ESC EORP CICD-L, пациенты в странах, где имеются клиники хронической ИБС, в 15,1% случаев получают комбинированную антиишемическую терапию (комбинация препаратов первой и второй линии), а 9,8% пациентов с ИБС – конкретную комбинацию препаратов первой линии с триметазидином, преимущественно в форме пролонгированного высвобождения [17].
Сегодня триметазидин доступен в форме с модифицированным высвобождением – форма ОД с однократным приемом. В трехмесячном обсервационном многоцентровом исследовании ОДА («Антиангинальная эффективность и переносимость триметазидина в форме с модифицированным высвобождением 80 мг один раз в сутки у пациентов со стабильной стенокардией в повседневной практике») добавление триметазидина, а именно Предуктала ОД в дозе 80 мг в день к антиангинальному лечению позволило снизить частоту приступов стенокардии (на 81%) и использования нитратов короткого действия (на 84%), улучшить ФК стенокардии, повысить физическую активность и приверженность пациентов лечению. Эти положительные эффекты наблюдались в группах пациентов с разной продолжительностью стабильной стенокардии, что указывает на возможность снижения бремени заболевания даже у недавно диагностированных больных [18].
В свою очередь, согласно Консенсусу экспертов о роли и месте триметазидина в терапии больных с хроническими формами ИБС, метаболическая миокардиальная цитопротекция является неотъемлемым компонентом комплексного лечения пациентов со стабильным течением ИБС независимо от механизма развития ишемии миокарда. Кроме того, лечение триметазидином в качестве препарата второй линии в дополнение к бета-адреноблокаторам или блокаторам кальциевых каналов должно проводиться длительно, начиная с ранних этапов развития болезни, с целью улучшения качества жизни больных [19].
Важнейшей проблемой в терапии пациентов c ИБС является не только выбор оптимального лекарственного препарата, его дозы, кратности и длительности приема, но и повышение приверженности пациентов назначенной терапии.
Согласно результатам исследования R. Khera и соавт. (2019), каждый восьмой пациент с сердечно-сосудистым заболеванием объясняет прекращение терапии высокой стоимостью лекарственных препаратов [20]. По данным экспертов Всемирной организации здравоохранения, социально-экономический статус пациентов – важный фактор, повышающий приверженность лечению, наряду с другими факторами, такими как поведение пациента, качество оказания медицинской помощи, организация системы здравоохранения в целом, влияние назначенной терапии на самочувствие пациента, а также факторами, связанными с сопутствующей патологией [21].
Таким образом, при выборе программ лечения пациентов с ИБС, нуждающихся в длительной антиишемической терапии, важно использовать препараты с доказанным терапевтическим действием, однократным приемом, доступным ценовым диапазоном и минимумом нежелательных побочных эффектов.
Внедрение в клиническую практику качественных генерических лекарственных средств с доказанной биоэквивалентностью референтному препарату, несомненно, позволяет снизить стоимость терапии, расширить круг больных, получающих необходимое лечение, что может стать решающим фактором как для пациентов в частности, так и для системы здравоохранения в целом.
Для удовлетворения постоянного спроса на триметазидин фармакологическими производителями осуществляется выпуск новых форм лекарственных препаратов, доступных и удобных для длительной антиишемической терапии для различных категорий пациентов. Одним из таких лекарственных средств является Тримектал® ОД в форме таблеток, выпускаемый АО «ВЕРТЕКС» (Россия). Тримектал® ОД – препарат с модифицированным высвобождением активного вещества, равномерно распределенного в объеме гидрофильного матрикса, что обеспечивает замедленное контролируемое высвобождение триметазидина. Это позволяет увеличить плато концентрации препарата в крови в течение суток и обеспечить поддержание антиангинальной эффективности в течение 24 часов. При регистрации препарата было проведено исследование его биоэквивалентности референтному препарату.
Материал и методы
Разрешение на проведение данного исследования № 632 выдано Министерством здравоохранения Российской Федерации 1 ноября 2019 г. В клиническом исследовании BE-05092018-TRIODVER, проведенном в ООО «Медицинский центр Пробиотек» с 22 января по 20 апреля 2020 г., участвовали 28 добровольцев. Целью исследования стала оценка биоэквивалентности препарата Тримектал® ОД, таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, 80 мг (АО «ВЕРТЕКС», Россия) референтному препарату Предуктал® ОД, капсулы с пролонгированным высвобождением, 80 мг (АО «Сервье», Россия).
Исследование состояло из следующих основных этапов: набор участников, проверка соответствия участников критериям и первичный скрининг, рандомизация участников на две группы, периоды I и II исследования с измерением всех параметров, завершение и обработка результатов. Между I и II периодами предусматривался семидневный отмывочный период. Каждый период включал по три визита для забора крови через 12, 36 и 48 часов после приема препарата.
Информированное согласие на участие в настоящем исследовании подписали 28 человек. Из них трое были исключены: один не соответствовал критериям включения (соответствие одному критерию невключения), второй отказался от участия до момента рандомизации, третий отказался от участия до начала периода I.
25 добровольцев, завершивших все этапы исследования, принадлежали к европеоидной расе. Возраст участников исследования составил 19–44 лет (в среднем 30,9 ± 8,0 года), рост – в пределах 1,59–1,83 м (в среднем 1,738 ± 0,063 м), масса тела – 55,6–95,7 кг (в среднем 74,97 ± 12,39 кг), индекс массы тела (ИМТ) – 19,7–29,9 кг/м2 (в среднем 24,76 ± 3,42 кг/м2). Соотношение женщин и мужчин – 9:16. Все участники как минимум в течение трех месяцев до начала исследования не употребляли алкоголь, наркотические препараты, лекарственные препараты, не являлись донорами крови, не участвовали в других клинических исследованиях, имели сохраненную репродуктивную функцию. 14 человек не курили, 11 выкуривали не более десяти сигарет в день.
Все участники исследования проходили следующие тесты:
при скрининге: первичный физикальный осмотр и сбор анамнеза, измерение массы тела, роста, ИМТ, электрокардиограмма (ЭКГ) в 12 отведениях, измерение основных жизненных показателей (АД, ЧСС, частота дыхательных движений (ЧДД), температура тела), общий анализ мочи, общий анализ крови, биохимический анализ крови на общий белок, общий холестерин, креатинин, глюкоза, общий билирубин, аспартатаминотрансфераза, аланинаминотрансфераза, щелочная фосфатаза, серологическое исследование крови на ВИЧ и гепатиты B и C, сифилис, анализ мочи на содержание наркотических и сильнодействующих лекарственных препаратов, тест на алкоголь в выдыхаемом воздухе или слюне, для женщин тест на беременность;
при обследовании в периодах I и II и по завершении исследования: те же тесты плюс сбор и регистрация нежелательных явлений после первого приема любого из препаратов.
Для оценки биоэквивалентности препаратов использовали основные фармакокинетические параметры – площадь под фармакокинетической кривой AUC0-t (начиная с нулевого значения времени, момента приема препарата, до времени отбора последнего образца крови с определяемой концентрацией действующего вещества в момент времени t) и максимальную концентрацию Cmax (максимальное измеренное значение концентрации действующего вещества в плазме крови добровольца).
Дополнительными параметрами служили время достижения максимальной концентрации Tmax, константа скорости терминальной элиминации kel, период полувыведения T1/2 (рассчитывалось как отношение ln(2)/kel), площадь под фармакокинетической кривой AUC0-∞, отношение AUC0-t к AUC0-∞ (AUC0-t/AUC0-∞), относительная скорость всасывания Cmax/AUC0-t, среднее время удерживания действующего вещества в крови MRT0-t, относительная биодоступность, рассчитанная как отношение AUC0-t(T)/AUC0-t(R), и отношение максимальных концентраций f"= Cmax(T)/Cmax(R).
Статистическая обработка результатов исследования проводилась с использованием некомпартментной модели в валидированном программном обеспечении Phoenix Winnonlin, версия 8.1 (Certara, США).
Результаты
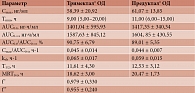
Результаты исследования BE-05092018-TRIODVER показали, что средние значения и стандартные отклонения данных фармакокинетических параметров после приема исследуемого и референтного препаратов статистически достоверно не различались. Средние значения и стандартные отклонения фармакокинетических параметров триметазидина после приема таблеток Тримектал® и капсул Предуктал® в образцах плазмы крови добровольцев, принимавших исследуемый и референтный препараты и завершивших исследование полностью без значительных отклонений от протокола, представлены в табл. 1.
Дисперсионный анализ и оценка биоэквивалентности сравниваемых препаратов выполнены на логарифмически преобразованных индивидуальных фармакокинетических параметрах AUC0-t и Cmax триметазидина у всех добровольцев, участвовавших в исследовании. Статистическая модель дисперсионного анализа включала следующие факторы, влияющие на наблюдаемую вариабельность данных: последовательность, препарат, период и доброволец (внутри последовательности). Полученные в дисперсионном анализе значения остаточной вариабельности использовались при расчете 90%-ных доверительных интервалов (ДИ) для отношений средних геометрических значений (µT/µR) соответствующих фармакокинетических параметров и значений коэффициентов внутрииндивидуальной вариабельности. Их значения представлены в табл. 2.
Границы ДИ для параметров AUC0-t и Cmax находятся в диапазоне 80–125%. При этом рассчитанные 90% ДИ не выходят за рамки биоэквивалентности согласно международным и российским критериям [22, 23]. Таким образом, исследуемый препарат Тримектал® биоэквивалентен референтному препарату Предуктал®.
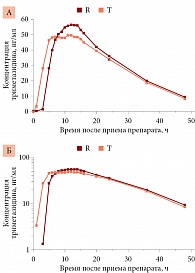
Зависимости средних значений концентраций триметазидина тестируемого препарата Тримектал® и референтного препарата Предуктал® от времени после их приема представлены на рисунке в линейных (А) и логарифмических (Б) координатах. Профили фармакокинетической динамики для обоих препаратов достаточно схожи. Незначительные отличия, выраженные прежде всего в более быстром подъеме концентрации тестируемого препарата Тримектал® по сравнению с референтным препаратом Предуктал® в течение первых 2–5 часов, могут быть обусловлены особенностями всасывания действующего вещества из таблеток, покрытых пленочной оболочкой, и из капсул [24]. Спустя шесть-семь часов концентрации обоих препаратов в крови добровольцев становятся практически идентичными, их средние фармакокинетические профили не отличаются в линейных и логарифмических координатах.
На протяжении всего исследования оценивали безопасность тестируемого и референтного препаратов. Добровольцы находились под постоянным наблюдением квалифицированного медицинского персонала. Оценка состояния здоровья проводилась за 12 часов до приема препарата и через 24 часа после в условиях стационара, а также через 36 и 48 часов после приема препарата амбулаторно. Через семь дней после применения последней дозы препарата каждому участнику был сделан контрольный телефонный звонок для обновления данных медицинского анамнеза и выяснения возможных нежелательных явлений и случаев сопутствующей терапии. Наличие нежелательных явлений оценивали по жалобам добровольцев, а также на основании отклонений от нормы, включая клинически незначимые отклонения, по следующим параметрам безопасности: значения основных жизненных показателей (АД, ЧСС, ЧДД и температуры тела), данные физикального осмотра, результаты ЭКГ в 12 отведениях и значения лабораторных исследований крови и мочи.
Всего за время проведения исследования зарегистрировано четыре нежелательных явления. Все они представляли случаи артериальной гипертензии, повышение систолического АД до 147–153 мм рт. ст., диастолического АД до 93 мм рт. ст. При этом три случая имели место после приема тестируемого препарата, один после применения референтного препарата. Все нежелательные явления, зарегистрированные в данном исследовании у добровольцев, расценивались как несерьезные, легкие и не связанные с приемом ни исследуемого, ни референтного препарата. Все нежелательные явления прошли без осложнений и не потребовали каких-либо действий до завершения исследования, а также дальнейшего наблюдения. Поскольку нежелательные явления не были связаны с приемом препаратов, сравнительного расчета отношений для Тримектала и Предуктала не проводилось.
Обсуждение
Как уже отмечалось, в качестве оптимальной медикаментозной терапии для устранения стенокардии/ишемии миокарда назначают препараты первой и второй линии. При недостаточной эффективности препаратов первой линии у пациентов со стабильной стенокардией к лечению добавляют один из препаратов второй линии (ивабрадин, или триметазидин, или ранолазин, или никорандил) в зависимости от АД, ЧСС с целью профилактики приступов стенокардии и достижения I ФК.
Результаты многочисленных клинических и экспериментальных исследований подтверждают актуальность триметазидина в качестве необходимого компонента антиишемической терапии у больных ИБС для улучшения внутриклеточного энергетического метаболизма, снижения тяжести и длительности периодов ишемии, повышения переносимости физической нагрузки.
Модифицированная лекарственная форма триметазидина – Тримектал® ОД (АО «ВЕРТЕКС», Россия) производится в виде таблеток с пролонгированным высвобождением активного вещества, равномерно распределенного в объеме гидрофильного матрикса, что обеспечивает замедленное контролируемое высвобождение лекарственного средства. Как следствие, увеличивается плато концентрации триметазидина в крови в течение суток и антиангинальный эффект препарата поддерживается в течение 24 часов.
Установлено, что Тримектал® ОД, таблетки 80 мг с пролонгированным высвобождением, покрытые пленочной оболочкой (АО «ВЕРТЕКС», Россия), полностью биоэквивалентен референтному препарату Предуктал® ОД, капсулы 80 мг с пролонгированным высвобождением (АО «Сервье», Россия).
Обоснованное использование в ежедневной практической деятельности знаний доказательной медицины и применение результатов качественно проведенных научных исследований способствуют повышению приверженности пациентов с ИБС назначенной терапии, улучшают прогноз и качество их жизни.
Заключение
При оценке 90% ДИ для отношений средних геометрических значений фармакокинетических параметров триметазидина AUC0-t и Cmax для двух сравниваемых препаратов Тримектал и Предуктал установлено, что определенные ДИ не выходят за рамки биоэквивалентности 90% и находятся в диапазоне 80–125%. Оба препарата проявили себя как безопасные, не влияющие на основные жизненные показатели, ЭКГ, показатели крови и мочи. Нежелательных явлений, связанных с приемом исследуемого и референтного препаратов, в исследовании не зарегистрировано.
Таким образом, установлена полная биоэквивалентность исследуемого препарата Тримектал® ОД, таблетки 80 мг с пролонгированным высвобождением, покрытые пленочной оболочкой (АО «ВЕРТЕКС», Россия), и референтного препарата Предуктал® ОД, капсулы 80 мг с пролонгированным высвобождением (АО «Сервье», Россия).
Конфликт интересов. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
Источник финансирования. Исследование проводилось при финансовой поддержке АО «ВЕРТЕКС».
N.P. Lyamina, PhD, Prof, V.V. Pisarev, PhD, A.V. Ivanov
Moscow Scientific and Practical Center of Medical Rehabilitation, Rehabilitation and Sports Medicine
Scientific and Production Center Probiotech LLC, Moscow
Contact person: Vladimir V. Pisarev, vladimir.pisarev@probiotech.ru
CAD is the leading cause of death among all diseases of the cardiovascular system. According to the recommendations for the treatment of coronary artery disease, the approach to therapy should be phased, there are several stages of therapy. In case of low effectiveness of 1st line drugs, it is recommended to prescribe one of the 2nd line drugs to prevent angina attacks. Trimetazidine has established itself as an effective anti-ischemic therapy for patients with coronary artery disease. Trimektal® OD has recently been launched on the market – a modified release preparation of the active substance trimetazidine 80 mg.
The aim of the study was to evaluate the bioequivalence of using the drug Trimektal® OD, 80 mg compared with the reference drug Preduktal® OD, 80 mg.
Material and methods. The study included 25 patients who were divided to receive Trimektal® OD or Preduktal® OD. During the study, the vital signs of patients were assessed, the pharmacological parameters of trimetazidine were evaluated, and safety was assessed throughout the study.
Results. As a result, it was found that the drugs did not significantly differ in terms of effectiveness, when assessing 90% confidence intervals for the ratios of the geometric mean values of the pharmacokinetic parameters of trimetazidine AUC0-t and Cmax for the two compared drugs Trimektal® and Preduktal®, it was concluded that certain confidence intervals do not go beyond 90% bioequivalence and are in the range of 80–125%. Both drugs had no effect on vital signs, ECG, blood and urine composition. According to the results of the study, we can say that the drug Trimektal® OD is completely bioequivalent to the drug Preduktal® OD.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.