количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
IV Международная междисциплинарная конференция “Manage pain”: Мультидисциплинарный подход к изучению боли
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология и психиатрия" №1
- Аннотация
- Статья
- Ссылки
Открывая сателлитный симпозиум компании «Такеда», Владимир Владимирович НИКОДА (д.м.н., главный научный сотрудник отделения реанимации и интенсивной терапии Российского научного центра хирургии им. акад. Б.В. Петровского) отметил, что проблема боли затрагивает не только медицинские, но и социально-экономические и правовые аспекты. Неудивительно, что многие международные и национальные организации занимаются разработкой принципиально новых алгоритмов, руководств и рекомендаций, обозначая приоритетные методы купирования различных болевых синдромов. В этой связи главной задачей врачей и организаторов здравоохранения является консолидация усилий в поисках оптимального подхода к лечению боли. В рамках симпозиума свою точку зрения в отношении выбора стратегии терапии острой и хронической боли представили зарубежные и отечественные специалисты по неврологии, хирургии, клинической фармакологии и фармакотерапии.

В.В. Никода

Профессор Г.Р. Ликар

Р. Ситтль

Профессор М.В. Путилина

Профессор В.А. Горский

Профессор А.В. Наумов
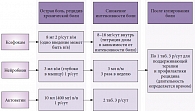
Рис. 1. Схема комбинированного лечения боли
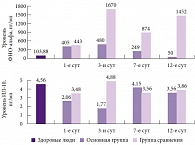
Рис. 2. Изменение уровней цитокинов (фактора некроза опухоли альфа и интерлейкина 10) на фоне терапии Ксефокамом
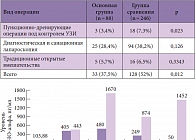
Таблица. Снижение потребности в оперативных вмешательствах в основной группе
Самыми разными могут быть как причины возникновения боли, так и места ее локализации. Однако, как отметил профессор кафедры анестезиологии и интенсивной терапии медицинского факультета университета Грац Рудольф ЛИКАР (Rudolf Likar, Австрия), в этом многообразии прослеживаются определенные тенденции. Что касается этиологических факторов развития болевого синдрома, то чаще всего он возникает на фоне артрита, ишемии, фибромиалгии и герпеса. По локализации наиболее распространенной является боль в спине: по данным исследования, проведенного в 2008 г. в Австрии, от боли в спине страдают 71% всех пациентов, испытывающих сильную боль, 57% участников исследования предъявляли жалобы на сильную боль в суставах, а 35% – в шее. Боли других локализаций (на месте шва от хирургической операции, боли при опухолях, невропатические и другие боли) регистрировались существенно реже.
Если пациент предъявляет жалобы на боли в спине, то более чем в 90% случаев речь идет о неспецифической боли, имеющей не вполне ясную этиологию. К специфическим разновидностям боли (10%) в спине относятся метаболические нарушения, остеопороз, переломы, а также боли воспалительного характера и радикулярные боли. Выбор методов лечения должен осуществляться в зависимости от механизма возникновения боли: лечение боли без адекватной диагностики невозможно. По механизму возникновения боль подразделяют на ноцицептивную (возникающую, например, при остеопоротическом переломе тела позвонка), ноцицептивно-воспалительную (активный спондилоартрит, фасеточный синдром), невропатическую (радикулярная боль при ущемлении корешков спинномозговых нервов) и дисфункциональную (боль в спине при фибромиалгии). Выделяют также смешанный механизм возникновения боли в спине, он характерен, например, для неспецифической боли данной локализации.
Из возможных вариантов терапии следует отдавать предпочтение этиотропным подходам, а также местной терапии и психотерапии. Если достичь результатов в ходе амбулаторного лечения не удается, пациент должен быть госпитализирован в специализированную клинику. Для купирования боли рекомендуется как назначение обезболивающих препаратов различных групп (опиаты, нестероидные противовоспалительные препараты (НПВП), антидепрессанты), так и применение немедикаментозных средств (кинезиотерапия, техники релаксации, эрготерапия и др.). Например, боль, сопровождающая диабетическую полиневропатию, является следствием формирования новых каналов и рецепторов, и терапия в этом случае включает в себя применение антиконвульсантов или антидепрессантов. Пациентам с дисфункциональной болью, возникающей в результате снижения эффективности эндогенных механизмов купирования боли, можно рекомендовать прием ингибиторов обратного захвата серотонина и норадреналина. При болях воспалительного происхождения целесообразно назначение НПВП и глюкокортикостероидов.
Профессор Р. Ликар напомнил, что НПВП, как правило, являются ингибиторами циклооксигеназы (ЦОГ), неселективными и селективными. Первые воздействуют на ЦОГ-1 и ЦОГ-2, вторые – только на ЦОГ-2. Однако оба типа ЦОГ выполняют в организме ряд важных физиологических функций: ЦОГ-1 обеспечивает гастропротекцию, агрегацию тромбоцитов и почечный кровоток, ЦОГ-2 – почечный кровоток и заживление ран. В этой связи прием ингибиторов ЦОГ-1 и/или ЦОГ-2 сопряжен с риском развития нежелательных явлений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы. Уменьшить риски, обусловленные использованием НПВП, можно, делая выбор в пользу наиболее сбалансированных и предсказуемых с точки зрения фармакокинетики препаратов. К таким средствам относится, в частности, лорноксикам – единственный НПВП, продемонстрировавший в исследовании in vitro одинаковую ингибирующую активность в отношении ЦОГ-1 и ЦОГ-2. Лорноксикам представлен на российском рынке препаратом Ксефокам, который выпускается в трех формах: обычные таблетки, таблетки с ускоренным высвобождением действующего вещества и флаконы для приготовления раствора для инъекций.
Лорноксикам характеризуется выраженным обезболивающим и противовоспалительным действием. Благодаря высокой скорости всасывания препарата, эффект от его применения наступает достаточно быстро. Лорноксикам так же эффективно купирует симптомы остеоартрита, ревматоидного артрита, анкилозирующего спондилоартрита, острой ишиалгии и боли в пояснично-крестцовой области, как и другие НПВП. Имеются также данные, согласно которым внутривенное применение лорноксикама после операции по поводу грыжи поясничного отдела позвоночника по эффективности сопоставимо с применением морфия1. Наряду с высокой терапевтической эффективностью, профиль безопасности лорноксикама выше, чем у многих других анальгетических средств, например у напроксена, что, возможно, обусловлено коротким периодом полувыведения лорноксикама, который составляет 3–5 часов. Лорноксикам характеризуется хорошей переносимостью: применение препарата в дозировке 4 мг 2 р/сут на протяжении 28 дней не привело к повышению количества скрытой крови в кале по сравнению с плацебо2. Лорноксикам в минимальной степени влияет на функцию печени и почек.
Высокая безопасность и хорошая переносимость лорноксикама были подтверждены рядом исследований с участием здоровых добровольцев и пациентов с болями различной этиологии, в том числе с послеоперационными болями. Эффективность лорноксикама достоверно выше, чем плацебо: она сопоставима с эффективностью трамадола, при этом лорноксикам переносится существенно лучше, нежели опиоидные анальгетики, гораздо реже вызывая повышенную потливость, головокружение, тошноту3. Наиболее частыми нежелательными явлениями на фоне его приема являются нарушения со стороны желудочно-кишечного тракта. Накопленный на сегодняшний день опыт применения этого препарата указывает на то, что лорноксикам может быть альтернативой опиоидным анальгетикам или дополнением к ним при лечении умеренной или сильной боли.
Применяя лорноксикам, следует придерживаться общих рекомендаций по использованию НПВП. К ним относится назначение минимальной эффективной дозы на минимально возможный срок, неиспользование одновременно неселективных и высокоселективных НПВП и коррекция дозы в зависимости от выраженности боли в течение дня. Пожилым пациентам НПВП должны назначаться с осторожностью, под контролем состояния желудочно-кишечного тракта, функции почек (НПВП и коксибы противопоказаны при скорости клубочковой фильтрации < 30 мл/мин) и сердечно-сосудистой системы. Предпочтение следует отдавать препаратам с коротким периодом полувыведения, так как они меньше накапливаются в организме. Кроме того, необходимо помнить о возможных противопоказаниях к приему НПВП, таких как пептическая язва и кровотечение, тяжелая сердечная недостаточность и др. В отсутствие должного терапевтического эффекта при купировании болевого синдрома препаратами из группы НПВП рекомендуется использование опиатов, однако контроль терапии препаратами данной группы достаточно сложен и требует тщательного отбора пациентов, готовых активно участвовать в процессе лечения.
Мультидисциплинарные терапевтические групповые программы для пациентов с хронической болью
Управление болью – относительно молодая медицинская дисциплина в Германии, однако с прошлого года она включена в обязательную программу подготовки врачей, что говорит о повышенном интересе к проблеме терапии боли у немецких врачей и организаторов здравоохранения. Медицинский директор междисциплинарного центра противоболевой терапии университетского госпиталя (Эрланген) Райнхард СИТТЛЬ (Reinhard Sittl, Германия) коротко описал особенности работы в клинике лечения боли. На мультимодальную терапию в клинику лечения боли направляются пациенты с тяжелой стадией хронического заболевания, ставшего причиной развития хронического болевого синдрома (болями в нижней части спины, невропатическими болями, головной болью). Это больные, у которых амбулаторное моно- или мультидисциплинарное лечение не привело к успеху. Как правило, у них имеются большое количество неудачных попыток лечения в анамнезе и такие психосоциальные проблемы, как:
- недостаток силы, терпения, взаимодействия и т.д.;
- страх перед болью, вызванной движением;
- отношение к себе как к пассивному участнику лечебного процесса;
- злость, чувство беспомощности, иногда депрессия;
- фрустрация вследствие невозможности совершать привычные действия;
- страх обсуждать с другими людьми свои проблемы;
- социальная изоляция, приводящая к усилению боли.
Терапией в клинике лечения боли занимается мультидисциплинарная бригада, состоящая из невролога, анестезиолога, ортопеда, специалиста по психосоматике, педиатра, физиотерапевта, специалиста по спортивной терапии, а также нескольких психологов, сестринского и административного персонала. В своей работе эта группа применяет так называемый мультимодальный подход к лечению боли, который базируется на доверительных отношениях с пациентом и оптимально подобранной терапии. Благодаря комплексному подходу пациент получает необходимый импульс, толчок к выздоровлению и начинает осознавать личную ответственность за собственное состояние. В рамках мультимодального подхода фармакотерапия боли органично сочетается с немедикаментозными методами лечения, включающими лечебную гимнастику, психологические занятия, акупунктуру, цигун и другие неинвазивные физиологичные методы борьбы с болью. Используются также методики релаксации: пациенты овладевают методикой «активного преодоления», учатся правильно использовать мышцы и расслаблять их после нагрузок. Согласно современным представлениям о лечении боли, эти методики помогают пациенту глубже понять свою проблему и – насколько это возможно – решить ее.
Мультимодальный подход также включает в себя занятия, направленные на снижение уровня стресса. Это обучение пациентов методам аутотренинга, гипноз и самогипноз, а также методики управления воображением. Все это помогает разорвать порочный круг, формируемый болью и стрессом, и активизировать механизмы эндогенного ингибирования боли. Одна и та же немедикаментозная методика может служить достижению различных целей: так, лечебная гимнастика не только укрепляет мышцы и увеличивает выносливость, но и способствует формированию социальных связей. Основной целью лечения, как правило, является достижение функционального улучшения и снижение интенсивности боли. Например, пациент, который мог до начала терапии пройти около 200 метров, к моменту окончания лечения сможет пройти в 2 раза больше, дойти до автобусной остановки, выехать в город и т.д. Следовательно, борьба с болью способствует повышению качества жизни пациентов. Использование мультимодального подхода также позволяет сократить интенсивность боли и уменьшить лекарственную нагрузку на организм. Кроме того, терапия, нацеленная на борьбу с болью, уменьшает количество визитов к врачу и снижает загруженность амбулаторного звена. И, наконец, в некоторых случаях пациентам удается вернуть трудоспособность и продлить активный период жизни. Опыт работы подобных клиник по управлению болью, по мнению Р. Ситтля, подтверждает, что мультимодальная терапия является эффективным и доступным средством борьбы с хронической болью, поэтому может и должна применяться у пациентов, страдающих болями различной локализации.
Алгии нервной системы – современные представления о терапии болевых синдромов
Как отметила д.м.н., профессор кафедры неврологии РНИМУ им. Н.И. Пирогова Марина Викторовна ПУТИЛИНА, врачи первичного звена, работающие в условиях постоянной нехватки времени, большинству пациентов, предъявляющих жалобы на боли в спине или головные боли, ставят диагноз «дорсопатия», не назначая дополнительных диагностических исследований. В результате единственным вариантом терапии таких больных становится назначение препаратов, чаще других используемых для лечения боли. При этом нейровегетативный субстрат болезни, как правило, игнорируется. Между тем многие жалобы пациентов, неопределенные, трудно объяснимые страдания могут быть в действительности вегетативного происхождения. Вегетативная нервная система оказывает регулирующее действие на моторность и чувствительность и своим тонусом влияет на функциональное состояние цереброспинальных чувствительных нервов, регулирует порог возбуждения чувствительных окончаний этих нервов и определяет некий чувствительный тонус на уровне кожи и органов чувств. Тонус может повышаться и понижаться, повышая и понижая порог алгогенной чувствительности этих нервов и органов чувств. Признавая важность вегетативного субстрата,
Международная ассоциация по изучению боли (International Association for Study of Pain, IASP) предложила ввести термин «алгии нервной системы». К алгиям может быть отнесен, например, хорошо известный неврологам симпаталгический синдром, характеризующийся вегетативной болью. Отличительной особенностью его является жгучая распирающая постепенно распространяющаяся боль. Симпаталгии могут проявляться постоянной болью или возникать в виде приступов (пароксизмов). Алгии нервной системы отличаются огромным разнообразием клинических проявлений. В данном контексте чрезвычайно важен вопрос «выбора» органа, ведь, как известно, психогенная боль может локализоваться не только в спине, но и в голове, области сердца, животе и др. Зона возникновения боли в той или иной степени определяется следующими факторами:
- перенесенные ранее заболевания, операции или незначительные изменения со стороны органов данной зоны (чаще всего речь идет о перенесенном гастрите, панкреатите, абортах);
- включение местных факторов, характерных для данной зоны или органа (так, усиленное дыхание может привести к заглатыванию воздуха, а оно, в свою очередь, к ипохондрической фиксации внимания на области возникновения распирающих болезненных ощущений);
- наличие жизненных событий, связанных с фиксацией внимания на данной зоне, и, что самое главное, фигурирование данной области в структуре психологического дистресса, конфликта.
Сегодня чрезвычайно велика потребность в принципиально новом подходе к терапии алгий нервной системы, основным направлением которого стала бы борьба не с симптомом, а с патогенетическими механизмами, которые привели к его возникновению. При выборе терапии необходимо учитывать возможность развития как нарушений биохимических процессов, так и органического поражения нервных волокон (что, собственно, и является причиной сочетания болевого симптома и неврологической симптоматики). Таким образом, пациентам должна назначаться комплексная терапия, направленная на снятие отека, устранение источника боли, купирование спазма. Пациентам также показана коррекция когнитивных и вегетативных нарушений – успешная терапия алгий возможна только при использовании комплексного подхода.
Даже в условиях дефицита времени, характерного для врачей районной поликлиники, можно найти возможность побеседовать с больным, дать оценку его состояния и поставить адекватные задачи терапии. Естественно, также важно назначить высокоэффективные обезболивающие препараты, работающие на периферическом, промежуточном и центральном этапах формирования болевого импульса. Следовательно, при необходимости могут использоваться и антиконвульсанты, и миорелаксанты, и НПВП, и препараты других групп, принципиально лишь применение адекватных доз и рациональных комбинаций. Одним из препаратов, использование которых при лечении алгий нервной системы вполне обоснованно, является Ксефокам Рапид – быстродействующая форма Ксефокама. Ксефокам Рапид эффективно купирует болевой синдром: использование дозы 8 мг 2 р/сут эквивалентно действию максимальных доз трамадола, средних терапевтических доз морфина или максимальных доз кеторолака и ибупрофена. Помимо обезболивающего Ксефокам обладает мощным противовоспалительным и антиоксидантным эффектом. Это обусловливает целесообразность его применения при ревматических заболеваниях, особенно с учетом того факта, что Ксефокам не вызывает деструкции хряща.
Ксефокам Рапид характеризуется быстрым началом действия: эффект развивается уже через 10–15 минут после приема таблетки. Столь быстрое купирование болевых ощущений препятствует хронизации боли. Благодаря короткому периоду полувыведения Ксефокам обладает хорошим профилем безопасности. Короткие курсы приема препарата не влияют на свертываемость крови, не вызывают повышения артериального давления и тахикардии. Токсические эффекты не были зарегистрированы даже при одновременном приеме 20 таблеток Ксефокама (160 мг лорноксикама). Пациентам, страдающим алгиями нервной системы, также показан прием витаминов группы В, поскольку они способствуют уменьшению интенсивности боли, улучшению двигательных функций, нормализации рефлекторных реакций, кроме того, они уменьшают потребность в НПВП. Среди препаратов на основе витаминов группы В у пациентов с алгиями может с успехом применяться Нейробион, выпускаемый в таблетках и ампулах. Чрезвычайно важно, что раствор Нейробиона не содержит лидокаин, что уменьшает риск развития аллергических реакций. Наконец, в терапию должны быть включены вегетокорректирующие препараты (Актовегин) с доминирующими когнитивными и противотревожными компонентами (рис. 1). В заключение профессор М.В. Путилина отметила необходимость сотрудничества с пациентом и его родственниками, что позволит повысить комплаентность и эффективность выбранной комбинированной терапии.
Антимедиаторная терапия в комплексном лечении деструктивного панкреатита
Уровень летальности пациентов, перенесших хирургические вмешательства по поводу панкреонекроза, на сегодняшний день недопустимо высок. Уменьшить процент летальных исходов, ассоциированных с панкреонекрозом, по мнению д.м.н., профессора кафедры экспериментальной и клинической хирургии медико-биологического факультета РНИМУ им. Н.И. Пирогова Виктора Александровича ГОРСКОГО, возможно, если пациенты с данным диагнозом начнут получать консервативное лечение еще на дооперационном этапе. Имеющиеся консервативные методы лечения панкреонекроза, однако, обладают достаточно низкой эффективностью – ни блокада секреторной функции поджелудочной железы, ни действия, нацеленные на устранение гиперферментемии, ни антибактериальная профилактика не оправдали надежд на 100%. В связи с тем что эффективной этиотропной терапии данной группы нозологий – за исключением билиарного панкреатита – в распоряжении врачей пока нет, необходимо сосредоточить усилия на поиске действенных патогенетических подходов.
Как известно, основным патогенетическим звеном панкреатита является высвобождение медиаторов воспаления, приводящее к развитию воспалительной реакции. Воспалительная же реакция, в свою очередь, является естественной функцией иммунной системы. Именно поэтому в основу нового подхода к лечению панкреатита легла теория врожденного иммунитета, за создание которой Ж. Хоффман, Б. Бетлер и Р. Стайман были удостоены Нобелевской премии по медицине в 2011 г. Согласно этой теории, ключевую роль в функционировании врожденного иммунитета играют так называемые толл-подобные рецепторы (toll-like receptors, TLR). Именно они ответственны за активизацию механизмов врожденного иммунитета в ответ на различные патогены. В норме толл-подобные рецепторы способствуют развитию адекватного иммунного ответа.
Толл-подобные рецепторы могут быть активированы как эндогенными (эластаза, гиалуронат, гепаран сульфат, HSP60, HSP70), так и экзогенными (липополисахариды, пептидогликан, липотейхоевые кислоты) лигандами. Стимуляция рецепторов запускает процесс выработки цитокинов и катионных противомикробных пептидов, а также активирует адаптивный иммунитет. Однако запуск механизмов, активируемых толл-подобными рецепторами, нередко приводит к увеличению числа самих рецепторов, запускающих выработку новых порций цитокинов, – развивается так называемый цитокиновый шторм. Для того чтобы определить эффективность применения антимедиаторной терапии у пациентов с панкреонекрозом, на базе РНИМУ им. Н.И. Пирогова было проведено масштабное комплексное исследование (2008–2011). На первом этапе оценивалась эффективность различных НПВП на модели крыс с панкреонекрозом, получавших Кеторолак или Ксефокам. Эффективность последнего в плане снижения уровня фактора некроза опухоли альфа, интерлейкина (ИЛ) 6 и ИЛ-10 оказалась статистически значимо выше, чем у Кеторолака.
Второй этап исследования показал, что лорноксикам достоверно ингибирует выработку упомянутых цитокинов. Максимальной эффективности (ингибирования от 40 до 90% выработки цитокинов) удалось достичь при применении лорноксикама в дозе 150 мкг/мл. После завершения первых двух этапов работы стартовало клиническое исследование. В работу были включены 334 пациента с панкреонекрозом. Все они получали базисную терапию в соответствии с приказами Минздравсоцразвития России, однако пациенты, рандомизированные в основную группу, принимали также препарат Ксефокам в течение 5 суток (суточная доза постепенно уменьшалась с 32 до 16 мг). Уже на третьи сутки терапии у пациентов из основной группы достоверно снизилась экспрессия гена TLR2, а на седьмые сутки в этой группе было зарегистрировано статистически значимое снижение экспрессии гена TLR4.
На фоне приема Ксефокама у пациентов достоверно снижался уровень цитокинов. Вместе с тем уровень противовоспалительного ИЛ-10 на фоне лечения практически не изменился, что указывает на сохранение нормального иммунитета и хороший профиль безопасности препарата для иммунной системы (рис. 2). Показатель летальности в основной группе оказался достоверно ниже, чем в группе сравнения, кроме того, у пациентов, получавших Ксефокам, в 1,5 раза реже регистрировались осложнения и была существенно снижена потребность в оперативных вмешательствах (таблица). Полученные в результате исследования данные позволили сделать следующие выводы:
- антимедиаторная терапия в лечении панкреонекроза патогенетически обоснована;
- уровень экспрессии генов TLR2 и TRL4 на фоне антимедиаторной терапии достоверно снижается, как и уровень цитокинов периферической крови, что приводит к снижению выраженности проявлений синдрома системного воспалительного ответа;
- в проведенном исследовании применение антимедиаторной терапии в комплексном лечении панкреонекроза привело к уменьшению частоты осложнений и летальности в 2,8 раза.
Полиморбидный пациент – стратегия лечения
На сегодняшний день медиками собрано огромное количество информации по применению НПВП в различных клинических ситуациях, но одновременно накопились и данные по серьезным побочным эффектам, развивающимся на фоне приема препаратов данной группы. Тщательное изучение механизмов синтеза и роли ЦОГ в организме привело к открытию подтипов данного фермента и появлению селективных НПВП. Д.м.н., профессор кафедры клинической фармакологии, фармакотерапии и скорой медицинской помощи МГМСУ им. А.И. Евдокимова Антон Вячеславович НАУМОВ напомнил, что в общем случае выбор препарата для обезболивания должен базироваться на патогенезе боли и ее интенсивности, клиническом статусе, наличии хронических болезней. В первую очередь должны рассматриваться патогенетические механизмы, поскольку многие имеющиеся в распоряжении врача НПВП работают только на уровне поврежденной ткани, не влияя на путь болевого импульса в центральной нервной системе (ЦНС).
При этом важно помнить, что ЦОГ-2 является одним из ключевых медиаторов боли в спинном мозге, и ее блокада необходима для успешного купирования болевых ощущений. Таким образом, «идеальный» НПВП должен блокировать всю цепочку возникновения боли. Одним из НПВП, работающих на уровне ЦНС, является лорноксикам, липофильные молекулы которого проникают непосредственно в спинной и головной мозг. Эффективность воздействия лорноксикама на ЦНС была подтверждена клиническими исследованиями с использованием метода функциональной магнитно-резонансной томографии4. Лорноксикам обладает мощной доказательной базой, кроме того, за годы использования препарата был накоплен обширный практический опыт, показывающий, в частности, что у 15% пациентов с острой интенсивной болью лорноксикам купирует более 50% болевых ощущений уже в первые 15 минут после приема, а за следующие 10–20 минут 50% боли купируется уже у 60% пациентов.
Еще одним фактором, влияющим на выбор НПВП, должен стать клинический статус пациента. Проблема коморбидных (полиморбидных) состояний в настоящее время чрезвычайно актуальна. Это связано с тем, что сегодня подавляющее большинство российских пациентов страдают не одним заболеванием, а имеют два или более синдромов/заболеваний, патогенетически взаимосвязанных между собой. Полиморбидность социально-значимых заболеваний – наиболее частый вариант полиморбидных состояний, в основе которых лежит накопление клеточных и тканевых инволютивных изменений, снижение общеиммунной реактивности и накопление нозологических единиц с течением времени. Чаще всего полиморбидные пациенты сегодня страдают рядом нейроэндокринных и сердечно-сосудистых патологий, толчком к развитию которых послужило ожирение. Последнее, в свою очередь, связано с увеличением числа адипоцитов, жировых клеток, обладающих способностью к синтезу провоспалительных цитокинов.
Полиморбидные пациенты, как правило, страдают также от хронической боли, причем увеличение числа патологий в составе полиморбидности предсказуемо приводит к увеличению интенсивности болевого синдрома. Боли в спине нередко опережают и предвосхищают развитие атеросклероза у полиморбидных пациентов. Хронические боли ассоциируются со снижением качества жизни, депрессиями и даже с повышением риска летального исхода. Если вероятность смерти от инфаркта миокарда у полиморбидных больных составляет 22%, то наличие хронической боли увеличивает эту цифру до 80%. Причиной столь резкого повышения риска смерти на фоне болевого синдрома предположительно является «цитокиновый шторм», сопровождающий развитие боли. Нетрудно заметить, что болевой синдром оказывается, таким образом, патогенетически связан с воспалительными механизмами, лежащими в основе полиморбидности. Именно поэтому, подбирая полиморбидному пациенту препарат для купирования боли, необходимо отдавать предпочтение средствам, которые будут воздействовать на системную воспалительную реакцию благотворно или хотя бы нейтрально. К таким препаратам, безусловно, относится лорноксикам, воздействующий сразу на 4 ключевых медиатора боли и прогрессирования хронических заболеваний: на ядерный фактор транскрипции, провоспалительные цитокины, простагландины и субстанцию Р.
Доказана эффективность лорноксикама в отношении снижения уровня цитокинов за счет ингибирования синтеза ИЛ-8, играющего важную роль также в развитии хронических заболеваний сердечно-сосудистой системы. При этом на саму сердечно-сосудистую систему лорноксикам практически не воздействует. Поскольку ингибирующая активность препарата в отношении ЦОГ-1 и ЦОГ-2 хорошо сбалансирована, накопления тромбоксана не происходит, равно как и увеличения кардиоваскулярных рисков. Более того, на фоне приема лорноксикама происходит некоторое улучшение эндотелиальной функции. Назначение адекватной обезболивающей терапии невозможно без уточнения характера боли, но большинство врачей не интересуются данным аспектом болезни и автоматически назначают стандартные НПВП. Однако причиной жалоб, как правило, является остеоартрит, а значит, необходимо выбирать такие противовоспалительные средства, которые не разрушают хрящ, а в идеале – обладают также патогенетической активностью. В этом отношении назначение лорноксикама является не только симптоматически, но и патогенетически обоснованным.
Установлено, что синовиальная мембрана, как и другие ткани организма, способна накапливать липопротеины низкой плотности. Это, в свою очередь, приводит к активации макрофагов и стимуляции выработки провоспалительных цитокинов. Однако ингибирование ИЛ-8 (которое осуществляет лорноксикам) препятствует активации макрофагов и сохраняет хрящевую ткань. Таким образом, лорноксикам может стать препаратом выбора для полиморбидных больных, нуждающихся в адекватном обезболивании. В настоящее время максимальная суточная дозировка лорноксикама, зарегистрированная в нашей стране, составляет 16 мг, однако профессор А.В. Наумов привел данные, указывающие на то, что увеличение этой дозировки в 2 раза сокращает общую дозу препарата на курс и снижает, таким образом, риск развития нежелательных явлений. Возможно, в дальнейшем список показаний к применению лорноксикама и спектр разрешенных дозировок будут расширены.
Заключение
Распространенность болевого синдрома велика, и, как правило, именно болезненные ощущения являются одним из самых частых поводов обращения за медицинской помощью. Несмотря на схожесть жалоб, причиной болевого синдрома могут быть различные патогенетические механизмы, и это обстоятельство необходимо учитывать при выборе терапии, одновременно уделяя внимание психологическому состоянию пациента. Только мультимодальный подход, учитывающий и психологический, и физиологический компонент болевого синдрома, может существенно повысить качество жизни пациента, а в некоторых случаях – и увеличить ее продолжительность. Комплексный подход активно используется за рубежом и, возможно, получит признание и российских специалистов.
Помимо патогенеза боли и ее интенсивности, необходимо учитывать клинический статус пациента, сопутствующие хронические заболевания. Следует также помнить, что хроническая боль тесно связана с выделением провоспалительных цитокинов, а значит, она является не только симптомом, но и причиной развития и прогрессирования многих хронических неинфекционных заболеваний. В свете вышесказанного становится ясно, что для лечения хронической боли необходимо как проведение психотерапевтических методик, так и назначение препаратов, обладающих одновременно антицитокиновой активностью и способностью блокировать болевые импульсы на различных участках нервной системы. К таким препаратам относится, в частности, НПВП лорноксикам, характеризующийся, помимо высокой эффективности, хорошей переносимостью и безопасностью. Короткие курсы лорноксикама в составе комплексной терапии острого болевого синдрома препятствуют хронизации процесса, а при лечении пациентов с хронической болью эффективно купируют болевые ощущения, давая пациенту возможность овладеть навыками, необходимыми для немедикаментозного лечения боли.
1. Rosenow D.E., Albrechtsen M., Stolke D. A comparison of patient-controlled analgesia with lornoxicam versus morphine in patients undergoing lumbar disk surgery // Anesth. Analg. 1998. Vol. 86. № 5. P. 1045–1050.
2. Warrington S.J., Debbas N.M., Farthing M. et al. Lornoxicam, indomethacin and placebo: comparison of effects on faecal blood loss and upper gastrointestinal endoscopic appearances in healthy men // Postgrad. Med. J. 1990. Vol. 66. № 778. P. 622–626.
3. Ilias W., Jansen M. Pain control after hysterectomy: an observer-blind, randomised trial of lornoxicam versus tramadol // Br. J. Clin. Pract. 1996. Vol. 50. № 4. P. 197–202.
4. Lorenz I.H., Egger K., Schubert H. et al. Lornoxicam characteristically modulates cerebral pain-processing in human volunteers: a functional magnetic resonance imaging study // Br. J. Anaesth. 2008. Vol. 100. № 6. P. 827–833.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.