Как снизить риск развития осложнений у пациентов с СД 2 типа? Выбор терапевтической тактики. III Всероссийский эндокринологический конгресс «Инновационные технологии в эндокринологии». Сателлитный симпозиум компании MSD
- Аннотация
- Статья
- Ссылки



Вариабельность гликемии как предиктор достижения гликемического контроля и маркер прогноза у пациентов
Cахарный диабет (СД) 2 типа – комплексное, гетерогенное заболевание, развивающееся вследствие воздействия факторов окружающей среды (избыток потребления жиров/углеводов, снижение физической активности). Одним из значимых факторов, по словам заведующего кафедрой эндокринологии и диабетологии Российской медицинской академии непрерывного профессионального образования (РМАНПО), заслуженного деятеля науки РФ, д.м.н., профессора Александра Сергеевича АМЕТОВА, является ожирение, которое обусловлено рядом метаболических нарушений и служит фундаментом для развития инсулинорезистентности.
Не вызывает сомнений и роль генетического фактора, запускающего нарушение «системы множественного равновесия».
До тех пор пока поджелудочная железа способна увеличивать секрецию инсулина, чтобы преодолеть инсулинорезистентность, толерантность к глюкозе остается в норме. Однако с течением времени бета-клетки поджелудочной железы утрачивают способность поддерживать достаточный уровень секреции инсулина, что связано с нарастанием их дисфункции и апоптозом.
Дисфункция бета-клеток является следствием совокупности факторов, в первую очередь липотоксичности и глюкозотоксичности.
В исследовании L. Monnier и соавт. (2007) показано, что потере постпрандиального гликемического контроля предшествует ступенчатое ухудшение гликемии натощак, которое прогрессирует по мере увеличения продолжительности СД 2 типа1. Нарастание гипергликемии натощак связано с повышенной продукцией глюкозы печенью или острой глюкозотоксичностью, которая и есть нарушение прандиальной регуляции.
Результаты исследования A. Ceriello (2003) продемонстрировали, что у больных СД 2 типа несколько раз в сутки изменяется уровень глюкозы в крови. Это ассоциировалось с трехразовым приемом пищи. Последствия постпрандиальной гипергликемии – активация тромбозов, окислительный стресс, поражение эндотелия, разрыв стенки сосудов и в конечном итоге развитие сердечно-сосудистых осложнений2.
Лечение СД 2 типа и предупреждение его осложнений – сложная, комплексная задача. Ее решением, по мнению докладчика, может стать «нейтрализация гипергликемии через понимание ее сути». Гипергликемия включает в себя повышение катаболизма липопротеинов высокой плотности, усиление аутоокисления глюкозы и инсулинорезистентности, нарушение ранней фазы секреции инсулина, выведение триглицеридов и липопротеинов низкой плотности, подавление процессов фибринолиза, снижение секреции оксида азота, лежащее в основе развития оксидативного стресса, нарушение свертывания крови.
Наряду с гипергликемией и глюкозотоксичностью не меньшую опасность представляет глюкозодефицит. Он влияет на риск развития сердечно-сосудистых осложнений посредством повышения воспалительной реакции, нарушения свертываемости крови, дисфункции эндотелия, снижения реакции симпатоадреналовой системы, приводящего к нарушению сердечного ритма и изменению гемодинамики.
Доказано, что активация окислительного стресса, лежащего в основе развития большинства патологических процессов, также связана с колебаниями уровня глюкозы3. L. Monnier и соавт. установили, что колебания глюкозы в целом и в постпрандиальные периоды в частности оказывают более специфическое стимулирующее воздействие на окислительный стресс, чем хроническая устойчивая гипергликемия. Поэтому необходимо учитывать не только концентрацию гликированного гемоглобина (HbA1с), средние концентрации глюкозы, но и резкие ее перепады.
Роль вариабельности глюкозы в развитии осложнений сахарного диабета продолжает изучаться4. По словам профессора А.С. Аметова, на сегодняшний день возможность оценки изменений на электрокардиограмме, связанных именно с вариабельностью глюкозы, предоставляет глюкокардиомониторирование, которое впервые было успешно апробировано сотрудниками кафедры эндокринологии РМАНПО.
Профессор А.С. Аметов представил результаты рандомизированного двойного слепого плацебоконтролируемого исследования по оценке вариабельности гликемии на фоне применения ситаглиптина и плацебо у пациентов с СД 2 типа без адекватного контроля гликемии на фоне применения метформина, выполненного С.Г. Бутаевой (РМАНПО). Параметры, контролируемые на старте и в конце исследования, – антропометрические данные (масса тела, окружность талии (ОТ)), глюкоза в плазме крови натощак (ГПН) и постпрандиальная гликемия (ППГ), HbA1c, индексы вариабельности глюкозы (стандартное отклонение (SD), средняя амплитуда колебаний гликемии (MAGE), индекс длительного повышения гликемии (CONGA) и др.), рассчитываемые по результатам непрерывного мониторирования глюкозы (CGMS), общая антиоксидантная активность плазмы.
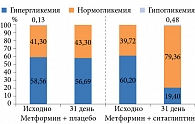
В исследование были включены пациенты старше 56 лет, большую часть которых составили женщины. Стаж диабета – более пяти лет. Характеристика распределения гипергликемии/гипогликемии и нормогликемии в течение 72 часов по данным суточного мониторирования на момент включения в исследование показала, что гипергликемия занимала 60,0% суточного времени, гипогликемия – 0,0–0,13%.
Пациенты были рандомизированы на две группы: первая (n = 25) получала терапию по схеме: метформин 2 г в сутки и плацебо два раза в сутки; вторая (n = 25) – метформин 2 г в сутки и ситаглиптин 50 мг два раза в сутки. Период наблюдения составил четыре недели.
Анализ динамики стандартных показателей углеводного обмена на старте и через четыре недели продемонстрировал преимущество терапии комбинацией «метформин + ситаглиптин»: снижение уровня HbA1c на 1,21% (с 7,91 до 6,7%). Использование комбинации «метформин + плацебо» способствовало уменьшению значений HbA1c с 8,02 до 7,93%.
Оценка динамики структуры гликемического профиля показала достоверное увеличение доли нормогликемии – с 39,72 до 79,36% в группе терапии метформином и ситаглиптином (рис. 1).
В то же время в группе терапии метформином и плацебо увеличение доли нормогликемии оказалось незначительным – с 41,3 до 43,3%.
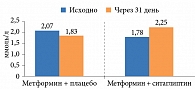
Комбинированное применение ситаглиптина с метформином способствовало достоверному (р < 0,05) повышению общей антиоксидантной активности плазмы с 1,78 до 2,25 ммоль/л. В то же время в группе терапии метформином и плацебо данный показатель даже несколько снизился – с 2,07 до 1,83 ммоль/л (рис. 2).
Полученные результаты позволили сделать вывод: терапия комбинацией «метформин + ситаглиптин» по сравнению с терапией комбинацией «метформин + плацебо» приводит:
- к снижению ГПН, ППГ, HbA1c;
- улучшению структуры гликемического профиля с преобладанием периодов нормогликемии в течение суток (79,36%) по данным CGMS, уменьшению суточной вариабельности глюкозы по CONGA при отсутствии изменений MAGE и SD;
- уменьшению массы тела на 1,2 кг, ОТ на 4,8 см;
- увеличению общей антиоксидантной активности плазмы крови.
Чтобы продемонстрировать актуальность применения ситаглиптина в схеме лечения больных СД 2 типа, профессор А.С. Аметов рассмотрел два клинических случая.
Клинический случай 1. Пациентка К., 65 лет. Стаж СД 2 типа – 9 лет. Получает лечение метформином в дозе 1000 мг. На фоне проводимой терапии HbA1c составил 8,91%, ГПН – 8,27 ммоль/л, ППГ – 8,8 ммоль/л, масса тела – 77,5 кг, ОТ – 79 см, общая антиоксидантная активность плазмы – 1,91 ммоль/л.
Пациентке проведено CGMS в течение 72 часов. Установлено, что 60% времени она находилась в режиме гипергликемии, вариабельность гликемии обусловлена постпрандиальными пиками (MAGE 11,3 ммоль/л, SD 2,4 ммоль/л, CONGA 7,09 ммоль/л).
Схема лечения была изменена. К терапии метформином в дозе 1000 мг два раза в сутки добавлен ситаглиптин в дозе 50 мг два раза в сутки под контролем CGMS через месяц.
На фоне интенсификации лечения удалось достичь следующих показателей: HbA1c – 7%, ГПН – 6,8 ммоль/л, ППГ – 7,7 ммоль/л. Интенсификация терапии позволила уменьшить массу тела на 2,2 кг, ОТ на 1 см, повысить общую антиоксидантную активность плазмы на 0,56 ммоль/л.
Таким образом, у пациентки с неудовлетворительным контролем гликемии на фоне приема максимальных доз метформина интенсификация терапии ингибитором дипептидилпептидазы 4 (ДПП-4) привела к постепенному снижению уровня HbA1c – на 1,91% за четыре недели. При этом отмечено значительное снижение амплитуды колебаний гликемии MAGE с 11,3 до 6,6 ммоль/л. Эпизодов гипогликемии зафиксировано не было. Кроме того, проводимая терапия способствовала снижению массы тела.
Клинический случай 2. Пациент П., 66 лет. Стаж СД 2 типа – 7 лет, получает лечение метформином 1000 мг. На этом фоне уровень HbA1c составил 7,9%, ГПН – 13,8 ммоль/л, ППГ – 14,8 ммоль/л, масса тела – 85 кг, ОТ – 112 см, общая антиоксидантная активность плазмы – 1,39 ммоль/л.
Пациенту проведено CGMS в течение 72 часов, по результатам которого установлено, что 63% времени он находился в состоянии гипергликемии, вариабельность гликемии была обусловлена постпрандиальными пиками (MAGE 12,6 ммоль/л, SD 3,5 ммоль/л, CONGA 9,85 ммоль/л).
Назначено лечение: метформин в дозе 1000 мг два раза в сутки и ситаглиптин в дозе 50 мг два раза в сутки под контролем CGMS через месяц.
Через четыре недели результаты CGMS, проводимого в течение 72 часов, продемонстрировали положительное изменение структуры гликемического профиля. Интенсификация терапии ситаглиптином позволила существенно улучшить показатели гликемии, благодаря чему 88% суточного времени пациент находился в состоянии нормогликемии.
Обоснованно ли раннее назначение комбинированной терапии?
Как отметила заведующая кафедрой эндокринологии Института профессионального образования Первого Московского государственного медицинского университета им. И.М. Сеченова, д.м.н., профессор Нина Александровна ПЕТУНИНА, данные эпидемиологических исследований демонстрируют повышение заболеваемости СД 2 типа. При этом прирост пациентов отмечается не только в возрастной категории от 40 до 64 лет (согласно данным США, их доля составляет 63% от общего числа заболевших), но и в возрастной категории от 17 до 39 лет (на их долю приходится 16% от общего числа больных)5. Важно и то, что около половины смертей (46,6%) регистрируется среди больных моложе 60 лет6.
В связи со сказанным выше не теряет актуальности персонифицированный подход к управлению гипергликемией, который, в частности, предполагает постановку индивидуальных целей лечения, что нашло отражение в международных и российских клинических рекомендациях7, 8.
Кроме того, в соответствии с последними отечественными рекомендациями необходимо своевременное назначение комбинированной терапии пероральными сахароснижающими препаратами. Так, комбинация двух препаратов может использоваться для интенсификации лечения при неэффективности монотерапии либо у пациентов с HbA1c 7,6–9,0% на старте заболевания.
Более консервативного подхода придерживаются Американская диабетическая ассоциация (American Diabetes Association – ADA) и Европейская ассоциация по изучению диабета (European Association for the Study of Diabetes – EASD) (2015). Они рекомендуют назначать стартовую терапию двумя препаратами пациентам с исходным уровнем HbA1c ≥ 9,0%.
Установлено, что пациенты с СД 2 типа на монотерапии метформином сохраняют целевой уровень HbA1c в течение двух лет (средний показатель неудачи лечения – 17% в год). Эффективность монотерапии была выше у тех, кто стартовал с монотерапии метформином в течение трех месяцев после диагностирования заболевания (средний показатель неудачи лечения – 12,2% в год)9.
Терапевтический эффект монотерапии метформином напрямую зависит от его дозы, однако высокие дозы оказывают негативное воздействие на желудочно-кишечный тракт у ряда больных СД 2 типа10.
Американские исследователи доказали, что не только у пациентов с диагностированным диабетом, но и у пациентов с предиабетом и недиагностированным диабетом нарушены функции почек в 32,9, 17,1 и 24,2% случаев соответственно11. Хроническая болезнь почек третьей стадии также ограничивает выбор метформина в качестве препарата первой линии. В этих случаях хорошей альтернативой являются ингибиторы ДПП-4.
Преимущества комбинированной терапии перед монотерапией метформином подтверждены систематическим обзором и метаанализом 15 рандомизированных клинических исследований с участием 6693 пациентов с СД 2 типа. Был сделан вывод о том, что комбинированная терапия значительнее, чем монотерапия метформином, снижает уровень HbA1c12.
Потенциальные преимущества ранней комбинированной терапии13:
- более быстрое достижение гликемического контроля;
- возможность комбинировать пероральные сахароснижающие препараты (ПСП) с взаимодополняющими механизмами действия;
- использование более низких доз препаратов.
Среди представленных на рынке комбинаций хорошую эффективность демонстрирует стандартная комбинация ингибитора ДПП-4 ситаглиптина с метформином. Так, стартовая терапия препаратом Янумет (ситаглиптин + метформин) в подгруппе пациентов, имевших исходно высокие значения HbA1c, по сравнению с монотерапией метформином привела к более выраженному снижению исходного уровня HbA1c > 11% – на 3,6%14.
При этом стартовая терапия Януметом в меньшей степени сопровождалась нежелательными явлениями со стороны желудочно-кишечного тракта, чем монотерапия метформином15.
В ретроспективном когортном исследовании с участием 253 690 пациентов с СД 2 типа, проведенном в Великобритании, было показано, что применение ингибитора ДПП-4 связано с меньшим риском прекращения терапии по сравнению с применением препаратов сульфонилмочевины (ПСМ)16. Преимущество комбинации «ингибитор ДПП-4 + метформин» перед комбинацией «ПСМ + метформин» было обусловлено более значимым снижением количества эпизодов гипогликемий.
Как долго удается удерживать результат на фоне такой терапии?
Эффект применения ситаглиптина (Янувия) при СД 2 типа после пяти лет терапии оценивался G. Derosa и соавт.17 Установлено, что терапия ситаглиптином (Янувия) характеризуется эффективностью и безопасностью в течение продолжительного времени. Добавление ситаглиптина к метформину приводило к более выраженному снижению HbA1c по сравнению с добавлением ПСМ и лучшему удержанию результата в ходе пятилетнего наблюдения.
Далее профессор Н.А. Петунина проанализировала результаты трех японских исследований по оценке динамики HbA1c через 12 месяцев терапии ситаглиптином у больных СД 2 типа, проведенных в условиях реальной клинической практики18. В исследовании ASSET-K пациенты (n = 1073), наблюдавшиеся у врачей-эндокринологов, не получали препараты инсулина, только ПСП, в том числе ситаглиптин. В исследовании ASSIST-K пациенты (n = 854) получали ситаглиптин и могли получать другие ПСП и препараты инсулина. В исследовании ATTEST-K пациенты (n = 411) принимали ситаглиптин и могли получать другие ПСП и препараты инсулина.
Внутри исследований были значительные различия в характеристиках пациентов, в дозе ситаглиптина и использовании других сахароснижающих препаратов. Тем не менее во всех трех работах отмечалось значительное снижение HbA1c в течение года после терапии ситаглиптином.
Приведенные данные подтверждают эффективность интенсификации лечения СД 2 типа и раннего назначения комбинированной терапии.
Почему же тогда большое количество пациентов остается вне целевой зоны контроля?
По мнению профессора Н.А. Петуниной, проблема кроется в клинической инертности врачей. Клиническая инертность определяется как отсутствие шага интенсификации терапии у пациентов, не достигавших целей лечения.
Существует алгоритм определения клинической инертности при лечении пациента с СД. Безусловно, подход к больному старше 80 лет и с индексом коморбидности выше трех должен осуществляться по принципу «не навреди». Более молодым пациентам с HbA1c 7,0–11% в течение трех – шести месяцев должны быть проведены мероприятия по интенсификации терапии в виде добавления сахароснижающего препарата, а пациентам с HbA1c > 11% – в виде инсулина или двух и более ПСП. В противном случае речь идет о клинической инертности.
По оценкам экспертов, клиническую инертность в 20% случаев предопределяют факторы, связанные с системой здравоохранения, в 30% – пациенты и в 50% – врачи19.
В канадском исследовании оценивалась клиническая инертность врачей-специалистов и врачей первичного звена в отношении пациентов с СД 2 типа с недостаточным гликемическим контролем20. Установлено, что только у 45% пациентов, наблюдавшихся у специалистов, и у 37% пациентов, наблюдавшихся у врачей первичного звена, проведена интенсификация терапии, причем в большинстве случаев за счет более частого использования инсулина, то есть речь идет о поздней интенсификации лечения.
В то же время результаты ретроспективного когортного исследования базы данных Великобритании (1999–2012 гг.), проведенного S.K. Paul и соавт., продемонстрировали, что промедление c интенсификацией лечения пациента с СД 2 типа повышает риск развития сердечно-сосудистых осложнений21. Несвоевременная интенсификация сахароснижающей терапии на один год в сочетании с неудовлетворительным гликемическим контролем увеличивает риск развития инфаркта миокарда (ИМ) на 67%, сердечной недостаточности (СН) – на 64%, инсульта – на 51%, комбинированного риска сердечно-сосудистых осложнений – на 62%.
Учитывая тот факт, что основной целью лечения СД является уменьшение риска сердечно-сосудистых осложнений, единственный способ ее достижения – своевременная интенсификация терапии и длительное удержание адекватного гликемического контроля.
В настоящее время завершены три исследования по оценке сердечно-сосудистой безопасности ингибиторов ДПП-4: ситаглиптина (TECOS)22, саксаглиптина (SAVOR-TIMI)23 и алоглиптина (EXAMINE)24. Продолжается исследование по оценке сердечно-сосудистой безопасности линаглиптина (CARMELINA).
Во всех трех исследованиях первичные конечные точки – время до сердечно-сосудистой смерти, нефатального ИМ, нефатального инсульта – совпадают. Однако в исследовании EXAMINE анализ показателя «госпитализация вследствие СН» продемонстрировал его недостоверное увеличение (на 19%), а в исследовании SAVOR-TIMI – достоверное (на 27%) в отличие от исследования TECOS, в котором не было зафиксировано повышения риска госпитализаций по причине СН.
В связи с этим 5 апреля 2016 г. Управление контроля за качеством продуктов и лекарственных средств США (Food and Drug Administration – FDA) сделало заявление о необходимости внесения предупреждения о СН в инструкции по применению лекарственных препаратов, содержащих саксаглиптин и алоглиптин.
Проведенный анализ оценки безопасности выявил, что сахароснижающие препараты, содержащие саксаглиптин и алоглиптин, повышают риск развития СН, в частности, у пациентов с заболеваниями сердца и почек. Кроме того, предполагается внести дополнительные рекомендации для пациентов и врачей: первым следует обратиться к врачу, если на фоне приема этих препаратов развиваются симптомы СН, вторым – рассмотреть целесообразность отмены препарата у пациентов с СН и мониторировать их гликемию.
В заключение профессор Н.А. Петунина выделила следующие ключевые пункты:
- существуют убедительные доказательства в пользу индивидуализированных целей лечения и способов их достижения с помощью ранней комбинированной терапии;
- индивидуализация лечения требует сотрудничества врачей и пациентов, в том числе в преодолении клинической инертности.
Остеопороз как недооцененное осложнение сахарного диабета
Согласно определению Всемирной организации здравоохранения (ВОЗ), остеопороз – это системное заболевание скелета, характеризующееся снижением массы костной ткани и нарушением ее микроархитектуры, приводящее к повышению хрупкости костей и высокому риску переломов. По словам заведующего кафедрой эндокринологии и диабетологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова, руководителя отдела эндокринных заболеваний Московского клинического научного центра, заслуженного врача РФ, д.м.н., профессора Ашота Мусаеловича МКРТУМЯНА, медико-социальная значимость остеопороза (ОП) определяется в первую очередь переломами позвонков и костей периферического скелета, что обусловливает значительный рост инвалидизации и смертности.
Еще в 2008 г. президент Международного фонда остеопороза J. Kanis в ходе проведенных им исследований установил, что в случае перелома шейки бедра большинство летальных исходов отмечается в первые три – шесть месяцев после события, и 20–30% этих смертей абсолютно связаны с переломом как таковым, а не с его последствиями25.
В 2012 г. в мире насчитывалось 200 млн лиц с остеопорозом, что позволило говорить об остеопорозе как о «безмолвной эпидемии неинфекционной болезни».
В соответствии с клинической классификацией выделяют первичный остеопороз (постменопаузальный, сенильный, ювенильный, идиопатический), на долю которого приходится 85% случаев, и вторичный, причинами которого могут стать эндокринные болезни (синдром Иценко – Кушинга, СД, тиреотоксикоз, гипогонадизм, гиперпаратиреоз и др.), болезни почек и органов пищеварения, генетические нарушения, ревматические заболевания и др.
Костное ремоделирование обеспечивают два основных типа клеток – остеокласты, которые разрушают кальцинированный костный матрикс, и остеобласты, которые синтезируют новое вещество кости.
При СД нарушается баланс между остеокластами и остеобластами –разрушение костной ткани происходит заметно быстрее, чем ее синтез.
Профессором А.М. Мкртумяном еще в 2000 г. была сформулирована теория патогенеза диабетического остеопороза. В его основе лежит хроническая гипергликемия, метаболический ацидоз, гипоинсулинемия или абсолютный дефицит инсулина в зависимости от типа сахарного диабета. Инсулин – это не просто регулятор углеводного обмена, а универсальный гормон, который принимает участие во всех видах обмена веществ. Он влияет на синтез коллагена I типа – основного компонента белкового матрикса кости, инсулиноподобного фактора роста 1 (IGF-1), также участвующего в костеобразовании.
Основными звеньями патогенеза остеопороза при СД считаются сниженная секреция инсулина, недостаток активных метаболитов витамина D, снижение всасываемости кальция в кишечнике, развитие вторичного гиперпаратиреоза, что нарушает механизм отрицательной обратной связи ПТГ-Ca (ПТГ – паратгормон) и усиливает резорбцию костной ткани. Это согласуется и с современными представлениями о механизме развития заболевания костей при СД. Согласно последним данным, на хрупкость костей при СД 2 типа влияют неферментативное гликозилирование коллагена, снижение костного метаболизма, провоспалительное состояние, потеря инкретинового эффекта, жировое перерождение костного мозга, нарушение регуляции адипокинов, изменение сигнального пути инсулина и дефицит инсулина, изменение уровня IGF-1, метаболизма Ca и ПТГ26.
На риск переломов у больных диабетом оказывают влияние эпидемиологические факторы (возраст, пол), осложнения диабета (ретинопатия, нефропатия, нейропатия), факторы, специфические для диабета (высокий уровень HbA1c, гипогликемия, ятрогенные эффекты), и связанные с ними падения.
Среди больных диабетом наиболее подвержены риску переломов женщины, которые составляют 51% от общего числа пациентов, и лица старше 50 лет27. Существенным фактором риска переломов у пациентов с СД 2 типа, связанных с падениями, является поражение органов-мишеней – глаз, стоп, почек, при этом внутренние факторы играют более значимую роль, чем внешние28.
У значительной части пациентов с диабетом имеются специфические для заболевания факторы риска переломов. Мультивариантный анализ риска переломов костей бедра в зависимости от уровня HbA1c у более 20 тыс. пожилых пациентов с СД 2 типа продемонстрировал повышенный риск перелома при HbA1c < 6% и > 7% и выше. Наиболее нейтральным и безопасным оказался уровень HbA1c в пределах 6–7%29.
В другом исследовании анализ оценки риска переломов вследствие падений в зависимости от наличия гипогликемии в группе пациентов с СД 2 типа старше 65 лет (n = 21 613) по сравнению с группой пациентов без гипогликемий показал более высокий риск переломов у первых30.
Почти 90% переломов бедра и запястья у пожилых пациентов с диабетом вызваны именно падением31.
Играет ли ожирение протективную роль в поражении скелета?
По данным C.J. Rosen (2006)32, отношение к этому вопросу неоднозначное. Одни авторы приписывают ожирению протективную роль. Другие – рассматривают жировую ткань как гигантскую эндокринную ткань, вырабатывающую и провоспалительные цитокины, которые нарушают костеобразование. Такие цитокины, например, лептин, могут отрицательно влиять на минеральную плотность костной ткани. Гипергликемия, инсулинорезистентность, лежащие в основе развития СД 2 типа, ожирение могут оказывать неблагоприятное воздействие на костеобразование, повышая риск переломов.
При СД для предотвращения любых осложнений, в том числе такого недооцененного, каким является ОП, необходимо достичь компенсации углеводного обмена. Приоритетом в выборе препаратов должны стать их эффективность и безопасность в отношении побочных эффектов, в том числе риска переломов. Для некоторых гипогликемических препаратов, например ингибиторов натрий-глюкозного котранспортера 2 типа (НГЛТ-2) и тиазолидиндионов, была выявлена связь с повышенным риском переломов33. Однако положительный эффект в этом отношении демонстрируют ингибиторы ДПП-4. По данным общенационального когортного исследования с участием 207 558 пациентов в возрасте 50 лет и старше, начавших применение противодиабетических препаратов в период 2008–2011 гг., лечение ингибиторами ДПП-4 может оказывать защитное действие на метаболизм костной ткани по сравнению с лечением ПСМ в добавление к метформину34.
В американском популяционном когортном исследовании определялась независимая взаимосвязь между началом применения ситаглиптина и частотой остеопоротических переломов35. Согласно дизайну исследования при анализе использовалась национальная репрезентативная база данных страхового обслуживания США, в которую входили 72 738 застрахованных пациентов с СД 2 типа.
Исследователи сравнивали частоту переломов костей бедра, клинических переломов позвонков, переломов проксимального отдела плечевой кости и дистального отдела лучевой кости у пациентов, начавших принимать ситаглиптин, и у пациентов, его не использовавших. Медиана наблюдения составила 2,2 года, медиана возраста больных – 52 года, медиана уровня HbA1c – 7%. В сумме период наблюдения составил 181 139 пациенто-лет.
Многомерный анализ показал, что ситаглиптин не связан с переломами (скорректированное отношение рисков 1,1 при 95%-ном доверительном интервале (ДИ) 0,8–1,4, р = 0,7). Однако, согласно анализу, терапия инсулином (р < 0,001), препаратами сульфонилмочевины (р < 0,008) и тиазолидиндионами (р = 0,019) ассоциировалась с повышенным риском переломов.
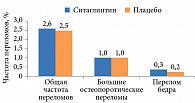
В исследовании TECOS22 по оценке сердечно-сосудистой безопасности ситаглиптина по сравнению с плацебо при их добавлении к стандартной терапии СД также изучалось влияние указанной терапии на риск переломов. Полученные результаты продемонстрировали отсутствие увеличения риска переломов на фоне применения ситаглиптина, сопоставимое с применением плацебо, как в отношении общей частоты переломов (2,6 против 2,5%, р = 0,944), больших остеопоротических переломов (1,0 против 1,0%, р = 0,779), так и в отношении перелома бедра (0,3 против 0,2%, р = 0,747) (рис. 3). Скорректированная частота этих переломов на 1000 пациенто-лет составила 8,7 и 8,6, 3,5 и 3,3, 0,8 и 0,7 соответственно.
Первый селективный ингибитор ДПП-4 Янувия (ситаглиптин) получил одобрение к применению в 2006 г. Уже через год, в 2007 г., на рынке появился препарат Янумет, представляющий собой фиксированную комбинацию ситаглиптина и метформина. В 2008 г. стартовало наиболее длительное исследование TECOS по оценке сердечно-сосудистых исходов терапии ситаглиптином, включившее более 14 тыс. пациентов из 38 стран. Результаты исследования, представленные 8 июня 2015 г. на конгрессе ADA, дали основание предположить, что ситаглиптин не оказывает влияния на развитие сердечно-сосудистых событий. Представленные позже данные подтвердили отсутствие повышенного риска переломов на фоне терапии ситаглиптином у больных СД 2 типа.
ВОЗ разработан универсальный метод расчета десятилетнего абсолютного риска переломов – опросник FRAX, доступный любому врачу первичного звена, имеющему выход в Интернет. Однако, как отметил профессор А.М. Мкртумян, у пациентов с СД 2 типа существует повышенный риск переломов, который объясняется не более низкой плотностью костей, а их архитектоникой. В связи с этим показатель FRAX нуждается в корректировке36.
Завершая выступление, профессор А.М. Мкртумян сформулировал ряд выводов:
- остеопороз – недооцененное или незамеченное осложнение СД 2 типа, требующее ранней диагностики;
- при выборе сахароснижающей терапии нужно отдавать предпочтение препаратам, не повышающим риск переломов;
- ситаглиптин (Янувия) не связан с повышением риска переломов.
Заключение
Учитывая тот факт, что основной целью лечения СД является уменьшение риска развития осложнений, единственный способ ее достижения заключается в своевременной интенсификации терапии, раннем назначении комбинированной терапии и длительном удержании адекватного гликемического контроля. Использование ситаглиптина (Янувия) на фоне терапии метформином или фиксированной комбинации «ситаглиптин + метформин» (Янумет) позволяет достигать и удерживать адекватный гликемический контроль, предотвращать развитие осложнений СД 2 типа и нежелательных явлений сахароснижающей терапии.
