количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Хламидиоз у детей: современные аспекты лечения
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эпидемиология и инфекции" № 1
- Аннотация
- Статья
- Ссылки
Представлены собственные данные клинической и серологической оценки эффективности лечения респираторных форм хламидийной инфекции у детей препаратами группы макролидов. Показано, что наибольшую эффективность и самый высокий профиль безопасности демонстрирует инновационная форма джозамицина Вильпрафен® Солютаб, которая рекомендуется для применения как в амбулаторной, так и в госпитальной практике в качестве стартовой терапии или вторым курсом после получения положительных серологических результатов на внутриклеточные инфекции (хламидии и микоплазмы).
Представлены собственные данные клинической и серологической оценки эффективности лечения респираторных форм хламидийной инфекции у детей препаратами группы макролидов. Показано, что наибольшую эффективность и самый высокий профиль безопасности демонстрирует инновационная форма джозамицина Вильпрафен® Солютаб, которая рекомендуется для применения как в амбулаторной, так и в госпитальной практике в качестве стартовой терапии или вторым курсом после получения положительных серологических результатов на внутриклеточные инфекции (хламидии и микоплазмы).
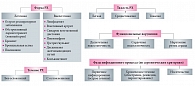
Рис. Классификация респираторного хламидиоза (РХ )
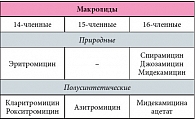
Таблица 1. Классификация макролидов
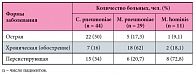
Таблица 2. Формы внутриклеточных инфекций
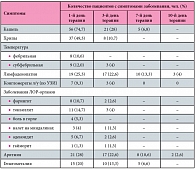
Таблица 3. Клиническая эффективность препарата Вильпрафен® Солютаб (n = 75)
Активное исследование и диагностика хламидийной инфекции (ХИ) у детей охватывают небольшой временной отрезок – немногим более тридцати лет (с конца 1980-х гг.). Этот короткий по историческим меркам период характеризуется целым рядом важных открытий. Долгие годы ХИ связывали с воспалительными заболеваниями урогенитального тракта у взрослых, и благодаря многочисленным публикациям в сознании врачей многих специальностей и пациентов надолго укоренилось мнение, что ХИ способна передаваться только половым путем. Можно сказать, что эта ситуация надолго задержала процесс изучения ХИ. Трудность исследования ХИ во многом была обусловлена сложностью диагностики. С развитием современных генно-инженерных и иммуноферментных диагностических методов были выделены различные виды и формы хламидий, изучен уникальный цикл развития хламидии, определены особенности острого и хронического течения заболевания, создана классификация, уточнен патогенез, обозначены основные пути лечения. За последние годы были сформулированы основные направления в изучении ХИ у детей. Прежде всего это касается респираторных форм, которые занимают первое место по частоте среди других форм ХИ.
На основании многолетнего собственного опыта семейного и индивидуального лечения детей и взрослых было дано определение хламидиоза: респираторный хламидиоз (РХ) – системное инфекционное заболевание хламидийной или комбинированной этиологии, проявляющееся морфологическими, клиническими и функциональными нарушениями со стороны органов дыхательной системы и других органов-мишеней, сопровождающееся развитием специфической иммунной реакции. При формулировании диагноза «респираторный хламидиоз» (рис.) [1] целесообразно выделять клиническую форму заболевания (легочную): ОРЗ, обструктивный ларинготрахеит (ложный круп), бронхит, бронхиальная астма или пневмония с указанием внелегочных проявлений (лимфаденита, реактивного артрита, синдрома вегетативной дистонии, пиелонефрита, дискинезии желчевыводящих путей); фазы инфекционного процесса по серологическим критериям (первичное инфицирование, обострение хронического процесса или ремиссия, носительство); осложнений заболевания (плеврит, миокардит и т.д.); а также степени функциональных нарушений со стороны органов-мишеней (дыхательная, сердечная недостаточность и т.д.).
В качестве примера может быть приведен следующий вариант развернутого диагноза респираторного хламидиоза (РХ): «Респираторный хламидиоз: обструктивный ларинготрахеит (ложный круп), в сочетании с лимфаденитом и конъюнктивитом, фаза первичного инфицирования, вегетососудистая дистония, дыхательная недостаточность II степени». Развернутое определение РХ позволяет разрешить до сих пор ведущиеся споры о патогенности хламидийных возбудителей и обязательном проведении лечения во всех случаях их выявления. Приведенные критерии позволяют четко дифференцировать хламидиоз как заболевание, требующее активного лечения, с «носительством возбудителя». Последнее состояние является поводом к тщательному наблюдению за ребенком и укреплению его иммунитета. Любое «форс-мажорное» событие, например, наслоившаяся другая инфекция, переохлаждение, стресс и другие факторы, могут привести к переходу носительства хламидий (латентной фазы инфекции) в хламидиоз (обострение хронической фазы течения) со всеми вышеперечисленными признаками и последствиями. В разработанном определении заложены алгоритмы диагностики РХ (выявление клинических, микробиологических и функциональных признаков) и медикаментозного лечения в виде этиотропной (антибактериальной), патогенетической (иммунокорригирующей) и симптоматической (функциональной) терапии.
Наиболее изучены следующие формы РХ: ОРЗ, синдром ложного крупа (острый стенозирующий ларинготрахеит), бронхит с явлениями обструкции и без нее, пневмония и бронхиальная астма. Данные собственных наблюдений и статистические исследования свидетельствуют о том, что ХИ обнаруживается практически у каждого 3–5-го ребенка, поступающего в стационар с симптомом длительного кашля либо часто болеющего респираторными заболеваниями. Воспалительный процесс при ХИ наблюдается, помимо респираторного тракта, в лимфатических узлах, суставах, органах мочевыводящей системы. Отмечаются воспалительные изменения в миндалинах, конъюнктиве глаз, паренхиматозных органах. К более редким формам относится серозный менингит. Известно, что при хроническом течении ХИ развиваются не только функциональные нарушения, но и деструктивные изменения во внутренних органах. Важно отметить, что в последние годы хламидиоз часто сочетается с другими инфекциями. Нельзя не учитывать сложившуюся на сегодняшний день тенденцию к взаимодействию и ассоциации вирусов и бактерий. Активное назначение с 1990-х гг. в амбулаторной практике антибиотиков – макролидов – привело к уменьшению частоты заболеваний, вызванных внутриклеточными возбудителями. Однако уже начиная с 2003 г. в структуре заболеваний стали преобладать вирусы герпеса. Смешанные формы заболеваний были выявлены также и у находившихся в отделении реанимации детей с тяжелыми формами ХИ. В этой связи напомним, что в результате эпидемии гриппа 2010 г. увеличилось количество пневмоний, ассоциированных с хламидиями и микоплазмами.
Учитывая механизмы развития РХ, можно выделить несколько направлений патогенетического воздействия при лечении больных, основными из которых являются антибактериальная, иммунокорригирующая терапия и симптоматическое лечение выявленных функциональных расстройств. Важным условием эффективной антибактериальной терапии является подбор адекватной схемы применения выбранного антибактериального средства. В идеале при выборе последнего необходимо учитывать сроки заболевания и остроту инфекционного процесса, оценивать эффект от ранее проведенной терапии, вероятность персистирования возбудителя. Считается, что лечение острого, особенно впервые возникшего хламидиоза не представляет сложности. Например, при лечении урогенитальных форм хламидиоза (уретрита, цервицита) во взрослой практике были распространены короткие курсы применения макролидов (3 дня) либо доксициклина (5–7 дней) [2, 3]. Однако практику лечения урогенитального хламидиоза короткими курсами нельзя полностью перенести на респираторные формы. Значительно сложнее поддаются лечению затяжные, хронические и особенно персистирующие формы хламидиозов. В этой ситуации нередко требуется проведение повторных циклов антибактериальной терапии, а их продолжительность увеличивается с 7–10 дней при бронхитах до 14–21 дня при пневмониях.
До настоящего времени отсутствует единая точка зрения на продолжительность лечения хламидиозов антибиотиками. В литературных источниках представлен достаточно большой разброс данных по эффективности антибактериальной терапии ХИ (от 40 до 100%), что свидетельствует о необходимости индивидуального подхода к выбору лечения, схема которого во многом определяется динамикой серологических показателей. Крайне важным следует считать вопрос о критериях излеченности ХИ. Зачастую клинические и бактериологические критерии выздоровления не совпадают. В некоторых исследованиях были сделаны попытки ориентироваться на культуральный метод выделения хламидий в ближайшие 2–3 недели после лечения, однако последнее реально лишь в случае доступности бактериологического материала. При респираторной и других формах хламидиоза ориентироваться на культуральный метод нельзя по причине невозможности взять образцы из очага воспаления. В этих ситуациях более достоверным является использование серологических методов на основе иммуноферментного анализа (ИФА) с определением титров антител (IgM и IgG) и фазы инфекционного процесса. Несомненно, важную роль в контроле лечения играет оценка серологических маркеров, в частности снижения титров специфических иммуноглобулинов. В гинекологической и урологической практике при проведении анализа материала, взятого в острой фазе воспаления, широко используется метод полимеразной цепной реакции (ПЦР). В педиатрической практике ПЦР также можно использовать, но только в качестве вспомогательного метода при острых формах бронхолегочных заболеваний (или в период обострения). В качестве основного метода диагностики хламидиоза использовать данную реакцию, как и определять антигены (АГ) в крови, не рекомендуется, поскольку информативность (чувствительность) методики в данном случае снижается до 14% [4].
Если в прежние годы для лечения инфекций, вызванных атипичными возбудителями, широко использовали препараты тетрациклинового ряда, то в последние годы эта группа антибиотиков практически не применяется из-за выраженных побочных реакций и низкой эффективности лечения. Ранее проведенные исследования показали, что тетрациклин, эритромицин и препараты хинолонового ряда менее эффективны в отношении хламидий, чем макролиды. На сегодняшний день макролиды являются практически единственной группой используемых в педиатрии антибиотиков, к которой высокочувствительны внутриклеточные инфекционные агенты. Макролиды обладают способностью к накоплению в тканях и очагах воспаления, причем наиболее интенсивно они накапливаются в миндалинах, лимфоузлах, легких, плевральной жидкости, органах малого таза, суставах, что и определяет предпочтительность использования препаратов данной группы для лечения хламидиоза. Кроме того, в последние годы значительно возросла роль макролидов в лечении заболеваний верхних и нижних дыхательных путей [5–7]. Широкое применение антибиотиков макролидного ряда можно объяснить следующими факторами: спектром действия, безопасностью, эффективностью, возможностью применения в различных формах у детей любого возраста и взрослых (диспергируемые таблетки, суспензии, внутривенные формы).
Макролиды преимущественно активны в отношении грамположительных, ряда грамотрицательных и внутриклеточных возбудителей (хламидий, микоплазм, легионелл). Высокую чувствительность к макролидам проявляют стрептококки, пневмококки, стафилококки, гонококки, хламидии, микоплазмы. Умеренной активностью обладают макролиды в отношении Helicobacter pylori, боррелий, микобактерий (не всех видов), токсоплазм, анаэробов, гемофильной палочки. Устойчивы к ним метициллин-резистентные штаммы стафилококков, E. faecium, грамотрицательные микроорганизмы семейства Enterobacteriaceae, P. aeruginosa, Acinetobacter, M. tuberculosis. Макролиды имеют особое химическое строение: в их структуре имеется макроциклическое лактонное кольцо, содержащее одну или несколько боковых углеводородных цепей. В основе классификации макролидов лежит число атомов углерода в лактонном кольце: 14-членные, 15-членные и 16-членные (табл. 1) [8]. За полвека было создано 14 макролидов, 8 из которых зарегистрированы в России. В представленной в таблице 1 классификации макролидов перечислены препараты, которые применяются в России. При приеме внутрь рекомендованы следующие дозы макролидов: джозамицин – 40–50 мг/кг/сут в 3 приема; cпирамицин – 150–300 тыс. МЕ/кг/сут в 2–3 приема; мидекамицин – 30–50 мг/кг/сут в 2–3 приема; рокситромицин – 5–8 мг/кг/сут в 2 приема; эритромицин – 40–50 мг/кг/сут в 3–4 приема; азитромицин – 10 мг/кг/сут в один прием; кларитромицин – 15 мг/кг/сут в 2 приема.
При лечении хламидиоза явно недостаточно ориентироваться только на клинические данные. Антибактериальная терапия у наблюдаемых нами детей проводилась при наличии повышенных титров хламидийных IgM (первичное острое инфицирование), нарастании титров IgG при повторном исследовании или их четырех- и более кратное повышение (реактивация, реинфекция). В качестве положительного серологического эффекта после лечения следует ориентироваться на снижение титров антител ниже референтных значений. В связи с появившимися данными о применении коротких курсов лечения макролидами (5–10 мг/кг азитромицина в течение 1–3 дней) при острых и осложненных формах инфекционных заболеваний вопрос о продолжительности антибактериальной терапии хламидиоза приобрел принципиальное значение. Такой подход может быть оправдан только у очень ограниченной группы детей с первичным инфицированием хламидиями и локальной воспалительной реакцией респираторного тракта. Данную ситуацию нужно обязательно подтверждать с помощью соответствующих серологических исследований, которые на практике, как правило, не проводятся. Наш опыт лечения свидетельствует о том, что в большинстве случаев мы имеем дело с обострением хронической инфекции или реинфицированием на фоне постоянного контакта больного с возбудителем. В этих ситуациях целесообразно применение более длительных, то есть 10-дневных, курсов лечения с последующим проведением иммунокорригирующей терапии.
Средняя продолжительность антибактериальной терапии составляет 5–10 дней. Курс лечения РХ определяется формой заболевания (острой или хронической – определяется по результатам серологического обследования). При острой форме заболевания возможно проведение короткого 5-дневного курса лечения. При наличии в анамнезе рецидивов заболевания, эпизодов затяжного кашля, а также в случае хронического течения РХ (по данным серологического обследования) проводится более длительный (10-дневный) курс лечения. Необходимость в повторных противорецидивных курсах антибактериальной терапии определяется по результатам контрольного серологического обследования через 2–4 месяца. Нами была проведена клиническая и серологическая оценка эффективности лечения макролидами (джозамицином, мидекамицином, рокситромицином, спирамицином, азитромицином, кларитромицином) при 5- и 10-дневных курсах лечения. После проведенной терапии антибиотиками у больных с ХИ отмечалось достоверное уменьшение общего количества рецидивов. Десятидневные курсы лечения оказались более эффективными, количество рецидивов после проведенных 10-дневных курсов лечения было на 23,7–38,3% меньше по сравнению с таковыми при 5-дневном лечении. Преимущество 10-дневного лечения больных с рецидивирующей ХИ было подтверждено меньшим количеством серопозитивных больных в течение всего периода наблюдения (1 год). Меньшей эффективностью обладал эритромицин (всего 40%). Выделены наиболее эффективные (84,6–95,5%) для лечения антибактериальные препараты (в порядке убывания эффекта): джозамицин, кларитромицин, рокситромицин, азитромицин, мидекамицин.
Выбор пути введения препарата (пероральный или парентеральный) зависит от тяжести течения заболевания. При тяжелых формах заболевания, пребывании детей в отделении реанимации и интенсивной терапии (ОРИТ), развитии тяжелых форм пневмонии, других осложнений и т.д. предпочтение отдается внутривенным или внутримышечным способам доставки антибиотиков. Препараты могут быть назначены детям различного возраста, включая новорожденных. Продолжительность лечения макролидами в этих случаях может быть увеличена до 2–3 недель. Существуют более продолжительные схемы лечения азитромицином, например, при муковисцидозе [9]. Значительно хуже поддаются лечению затяжные, хронические и особенно персистирующие формы хламидиозов. В этой ситуации нередко требуется проведение повторных циклов антибактериальной терапии, а их продолжительность увеличивается с 7–10 до 14–21 дней. Наилучшие результаты лечения болезни Рейтера у детей были получены при назначении нескольких курсов препаратов группы макролидов. Продолжительность лечения составила 3–4 недели. После первого курса терапии полное излечение отмечено у 42,5% детей, после второго – у 30%, после третьего – у 22%, что в общей сложности составило 94,5%.
В связи с ростом бесконтрольного применения антибиотиков особую актуальность приобретает проблема возможного развития резистентности хламидий к этим препаратам, аналогичной резистентности пневмококков к антибиотикам. По данным литературы, в странах Западной и Южной Европы широкое применение макролидов привело к росту количества резистентных штаммов пневмококков (до 30%). В США вплоть до конца 1980-х гг. к макролидам были чувствительны все штаммы пневмококков, однако с годами число устойчивых штаммов росло, и сегодня в США в той или иной степени устойчивы к макролидам около 25% пневмококков. В отношении хламидий и микоплазм пока таких сведений нет. Макролиды неэффективны в отношении микроорганизмов, обладающих природной устойчивостью к эритромицину (внутригрупповая перекрестная устойчивость).
Побочные эффекты, вызываемые макролидами, встречаются редко. Макролиды рассматриваются как наиболее безопасные препараты с точки зрения побочных реакций. У детей аллергические реакции на препараты данной группы наблюдаются не чаще чем в 5% случаев. Через 10–21 день от начала лечения могут развиться гепатотоксические реакции, сопровождающиеся увеличением размеров печени и повышением уровня билирубина в крови [10]. При сочетании с сыпью аллергического характера такие реакции рассматриваются как токсико-аллергические. Влияние препаратов на слух напрямую зависит от высоких доз и концентрации в сыворотке крови (в основном описаны при применении эритромицина). Кларитромицин не рекомендуется применять одновременно с теофиллинами из-за влияния на систему цитохрома печени. Не до конца ясен вопрос о взаимодействии азитромицина с дигоксином, поэтому рекомендуется контролировать содержание дигоксина в крови при приеме азитромицина. В литературе описаны случаи кардиотоксического действия макролидов, сопровождающиеся брадикардией, артериальной гипотонией, остановкой сердца.
Наиболее частое (5–29%) побочное явление при лечении макролидами – кишечная дисфункция, однако при приеме препаратов новых поколений она встречается реже (в 4–6% случаев). В этой связи заслуживают особого внимания инновационные технологии создания безопасных лекарств как для взрослых, так и для детей, к которым относится технология диспергируемых таблеток Солютаб. Действующее вещество объединяется в микрогранулы, покрытые кислотоустойчивой оболочкой, которая становится проницаемой только при воздействии бикарбонатов в кишечнике. Таким образом, действующее вещество высвобождается именно в зоне максимального всасывания, что позволяет избежать ряда побочных эффектов. Мы располагаем опытом применения джозамицина, который в прежние годы назначался детям в виде суспензии и взрослым в виде таблеток. Появление нового препарата – Вильпрафена Солютаб – открывает большие возможности и перспективы его применения в педиатрии. К главным преимуществам Вильпрафена Солютаб относятся:
По результатам серологического обследования было выявлено преобладание C. pneumoniae (58,7%) среди внутриклеточных возбудителей. Доля микоплазменных возбудителей была меньше: M. pneumoniae – 38,7%, M. hominis – 14,6%. Дети наблюдались амбулаторно со следующими диагнозами: ОРЗ – 32 (42,7%), простой бронхит – 16 (21,3%), обструктивный бронхит – 8 (10,7%) детей. В стационаре Вильпрафен® Солютаб был назначен 19 детям: из них у 18 (24%) с пневмониями и у 1 ребенка (1,3%) – с бронхиальной астмой. При анализе амбулаторных карт и историй болезни у 45,3% детей были выявлены рецидивирующие респираторные заболевания дыхательных путей и ЛОР-органов, именно по этой причине эти дети были отнесены к группе ЧБД. До момента обращения дети не были обследованы и не получали этиотропной терапии. Тем не менее 30,3% детей ранее лечились антибиотиками (Сумамедом короткими курсами, Амоксиклавом, Аугментином) как амбулаторно, так и в различных стационарах города. В анамнезе у 26,6% матерей имела место неблагополучно протекающая беременность: угроза выкидыша (10,7%), родоразрешение путем кесарева сечения (6,6%). Заслуживает внимания факт инфицирования 9,3% матерей во время беременности внутриклеточными возбудителями – хламидиями, уреаплазмами, микоплазмами.
Наряду с катаральными симптомами у детей имела место лимфаденопатия (34,7%), длительный субфебрилитет (12%), а также частые воспалительные заболевания ЛОР-органов – отиты, гаймориты, аденоидиты, ангины – у 16%. Анализ течения внутриклеточных инфекций показал преобладание смешанных инфекций, которые наблюдались у 42 (56%) детей, тогда как в виде моноинфекций заболевание протекало у 28 (37,3%) детей. У детей с моноинфицированием преобладали хламидии (у 18 (24%)), далее шли микоплазмы: M. pneumoniae – у 8 (10,7%), M. hominis – у 2 (2,6%). В случае смешанного инфицирования выделено два варианта: хламидийно-микоплазменное – у 13 (17,3%) детей и сочетание какой-либо из внутриклеточных инфекций с инфекцией, вызванной вирусом герпеса, – у 29 (38,7%) детей. Это обстоятельство нами учитывалось при назначении соответствующего лечения. На сегодняшний день внутриклеточные инфекции могут иметь несколько форм (острую, хроническую, персистирующую) (табл. 2). Хламидийную инфекцию у большинства детей характеризовало острое течение, микоплазменную – хроническое в стадии обострения. Следует подчеркнуть, что длительная персистенция и хроническое течение внутриклеточных инфекций требуют назначения более длительных курсов антибактериальной терапии, а сопутствующее инфицирование герпесвирусами – использования противовирусных и иммунных препаратов. Герпесвирусы (вирусы простого герпеса 1-го и 2-го типа, цитомегаловирус (ЦМВ), вирус Эпштейна – Барр (ЭБВ)) у большинства детей следует рассматривать как фоновые инфекции, которые находятся в стадии персистенции. Тем не менее имели место и острые формы. Их причиной являлись вирус простого герпеса 1-го и 2-го типа – у 25% детей, ЭБВ – у 18,7% детей, ЦМВ – у 12,5% детей.
Эффект лечения препаратом Вильпрафен® Солютаб оценивали по динамике клинических симптомов (при повторных осмотрах на 1, 3, 10-й день) и наличию (или отсутствию) серологических маркеров хламидий и микоплазм через 2 месяца после лечения (табл. 3). На фоне лечения оценивалось развитие осложнений и побочных явлений. Вильпрафен® Солютаб в качестве стартовой терапии получили 48 детей (64%), вторым курсом (после получения результатов серологического исследования и данных о чувствительности) – 27 детей (36%). Особенно следует подчеркнуть эффективность Вильпрафена Солютаб у детей с пневмониями в период эпидемического подъема заболеваемости гриппом в качестве стартового препарата либо вторым курсом после определения этиологии заболевания. Результаты лечения Вильпрафеном Солютаб свидетельствуют о положительной динамике со стороны основных клинических симптомов уже к 3-му дню лечения. Так, количество детей с кашлем к 3-му дню лечения сократилось в 2,7 раза, с хрипами в легких – в 4,6 раза, с нарушениями со стороны ЛОР-органов – в 3,5 раза. На фоне лечения значительно сокращались размеры лимфоузлов, однако это происходило более медленно. Конгломераты лимфоузлов исчезали к 7-му дню лечения. Также под действием антибиотикотерапии отмечалась нормализация сердечного ритма. Восстановление регулярного синусового ритма происходило медленнее.
Результат серологического исследования через 2 месяца после проведенного курса терапии был отрицательным у 43 (93,4%) из 46 детей. У 3 (6,5%) детей с диагнозом «бронхит» был проведен второй курс лечения Вильпрафеном Солютаб. При анализе историй болезни было выяснено, что у этих детей была смешанная хламидийно-микоплазменная инфекция, причем инфекция, вызванная одним из возбудителей, – в стадии хронического течения, которое потребовало более продолжительного курса лечения. Микробиологическое обследование детей, проведенное в динамике через 2 месяца, выявило также положительную динамику в виде значительного сокращения частоты обнаружения патогенной микрофлоры: S. pneumoniae (c 97,8% до 17,4%), Neisseriae spp. (с 86,9% до 6,5%), S. aureus (с 50% до 0%). Таким образом, уже к 3-му дню лечения применение Вильпрафена Солютаб у больных с серологически подтвержденными внутриклеточными инфекциями хламидийной и микоплазменной этиологии способствует значительному уменьшению выраженности клинических симптомов: кашля, лихорадки, воспалительных явлений со стороны ротоглотки.
Настоящее исследование показало, что Вильпрафен® Солютаб следует применять как в амбулаторной, так и в госпитальной практике либо в качестве стартовой терапии, либо вторым курсом после получения положительных серологических результатов на внутриклеточные инфекции (хламидии и микоплазмы). Большое значение при лечении хламидийной и микоплазменной инфекции имеет коррекция функциональных нарушений со стороны бронхолегочной и сердечно-сосудистой систем. Очень часто хроническая инфекция приводит к развитию бронхообструктивного синдрома, нередко на начальных стадиях болезни протекающего бессимптомно, а впоследствии переходящего в бронхиальную астму. По этой причине показано исследование функции внешнего дыхания у детей с 4-летнего возраста. В случаях выявления признаков бронхообструкции необходимо восстановление бронхиальной проходимости с помощью бета-агонистов и уменьшение гиперреактивности бронхов путем назначения ингаляционных кортикостероидов. В свою очередь, у детей с бронхиальной астмой показано проведение целенаправленного поиска «атипичной», в частности хламидийной, инфекции и в случае ее обнаружения – проведение этиотропной антибактериальной терапии.
Функциональные сердечно-сосудистые нарушения являются типичными для данных инфекций. Они значительно уменьшаются после успешно проведенной этиотропной терапии, однако полностью не исчезают. Важную роль в их коррекции играют методы физической реабилитации и восстановительного лечения в процессе диспансерного наблюдения. Как уже отмечалось ранее, специальную гипотензивную или антиаритмическую терапию целесообразно применять лишь ситуационно, при стойких нарушениях, не поддающихся этиотропному и немедикаментозному лечению. Решение вопроса о целесообразности длительного применения кардиотропной медикаментозной терапии следует перенести на более старший возраст, когда закончится возрастная морфофункциональная перестройка организма. Проведенное катамнестическое наблюдение за большой группой больных показало, что у многих детей основными причинами формирования хронического течения ХИ явились неадекватный контроль и недостаточно эффективное лечение заболевания на его ранних этапах, тесный и продолжительный контакт с инфицированными членами семьи и лицами в замкнутых коллективах. В этой связи большое значение приобретает своевременное проведение антибактериальной, иммунокорригирующей и функционально-восстановительной терапии ХИ.
Вместе с тем необходимо отметить, что одна антибактериальная терапия, являясь необходимым компонентом лечения, полностью не решает проблему рецидивирующего течения заболевания. Для лечения детей с ХИ необходимо исключать, в первую очередь, внутрисемейное инфицирование, которое является постоянным источником инфицирования и развития рецидивов. Второй по значению причиной неэффективного лечения является присутствие конкурирующих патогенов – герпесвирусов или других внутриклеточных возбудителей (микоплазм). Таким образом, лечение хламидийной инфекции у детей на сегодняшний день представляет собой сложную, многогранную проблему, которая должна решаться комплексно, с применением знаний из области серологии, сведений об эпидемиологической ситуации в семье, основных возбудителях, и при условии обязательного динамического наблюдения за пациентами.
На основании многолетнего собственного опыта семейного и индивидуального лечения детей и взрослых было дано определение хламидиоза: респираторный хламидиоз (РХ) – системное инфекционное заболевание хламидийной или комбинированной этиологии, проявляющееся морфологическими, клиническими и функциональными нарушениями со стороны органов дыхательной системы и других органов-мишеней, сопровождающееся развитием специфической иммунной реакции. При формулировании диагноза «респираторный хламидиоз» (рис.) [1] целесообразно выделять клиническую форму заболевания (легочную): ОРЗ, обструктивный ларинготрахеит (ложный круп), бронхит, бронхиальная астма или пневмония с указанием внелегочных проявлений (лимфаденита, реактивного артрита, синдрома вегетативной дистонии, пиелонефрита, дискинезии желчевыводящих путей); фазы инфекционного процесса по серологическим критериям (первичное инфицирование, обострение хронического процесса или ремиссия, носительство); осложнений заболевания (плеврит, миокардит и т.д.); а также степени функциональных нарушений со стороны органов-мишеней (дыхательная, сердечная недостаточность и т.д.).
В качестве примера может быть приведен следующий вариант развернутого диагноза респираторного хламидиоза (РХ): «Респираторный хламидиоз: обструктивный ларинготрахеит (ложный круп), в сочетании с лимфаденитом и конъюнктивитом, фаза первичного инфицирования, вегетососудистая дистония, дыхательная недостаточность II степени». Развернутое определение РХ позволяет разрешить до сих пор ведущиеся споры о патогенности хламидийных возбудителей и обязательном проведении лечения во всех случаях их выявления. Приведенные критерии позволяют четко дифференцировать хламидиоз как заболевание, требующее активного лечения, с «носительством возбудителя». Последнее состояние является поводом к тщательному наблюдению за ребенком и укреплению его иммунитета. Любое «форс-мажорное» событие, например, наслоившаяся другая инфекция, переохлаждение, стресс и другие факторы, могут привести к переходу носительства хламидий (латентной фазы инфекции) в хламидиоз (обострение хронической фазы течения) со всеми вышеперечисленными признаками и последствиями. В разработанном определении заложены алгоритмы диагностики РХ (выявление клинических, микробиологических и функциональных признаков) и медикаментозного лечения в виде этиотропной (антибактериальной), патогенетической (иммунокорригирующей) и симптоматической (функциональной) терапии.
Наиболее изучены следующие формы РХ: ОРЗ, синдром ложного крупа (острый стенозирующий ларинготрахеит), бронхит с явлениями обструкции и без нее, пневмония и бронхиальная астма. Данные собственных наблюдений и статистические исследования свидетельствуют о том, что ХИ обнаруживается практически у каждого 3–5-го ребенка, поступающего в стационар с симптомом длительного кашля либо часто болеющего респираторными заболеваниями. Воспалительный процесс при ХИ наблюдается, помимо респираторного тракта, в лимфатических узлах, суставах, органах мочевыводящей системы. Отмечаются воспалительные изменения в миндалинах, конъюнктиве глаз, паренхиматозных органах. К более редким формам относится серозный менингит. Известно, что при хроническом течении ХИ развиваются не только функциональные нарушения, но и деструктивные изменения во внутренних органах. Важно отметить, что в последние годы хламидиоз часто сочетается с другими инфекциями. Нельзя не учитывать сложившуюся на сегодняшний день тенденцию к взаимодействию и ассоциации вирусов и бактерий. Активное назначение с 1990-х гг. в амбулаторной практике антибиотиков – макролидов – привело к уменьшению частоты заболеваний, вызванных внутриклеточными возбудителями. Однако уже начиная с 2003 г. в структуре заболеваний стали преобладать вирусы герпеса. Смешанные формы заболеваний были выявлены также и у находившихся в отделении реанимации детей с тяжелыми формами ХИ. В этой связи напомним, что в результате эпидемии гриппа 2010 г. увеличилось количество пневмоний, ассоциированных с хламидиями и микоплазмами.
Учитывая механизмы развития РХ, можно выделить несколько направлений патогенетического воздействия при лечении больных, основными из которых являются антибактериальная, иммунокорригирующая терапия и симптоматическое лечение выявленных функциональных расстройств. Важным условием эффективной антибактериальной терапии является подбор адекватной схемы применения выбранного антибактериального средства. В идеале при выборе последнего необходимо учитывать сроки заболевания и остроту инфекционного процесса, оценивать эффект от ранее проведенной терапии, вероятность персистирования возбудителя. Считается, что лечение острого, особенно впервые возникшего хламидиоза не представляет сложности. Например, при лечении урогенитальных форм хламидиоза (уретрита, цервицита) во взрослой практике были распространены короткие курсы применения макролидов (3 дня) либо доксициклина (5–7 дней) [2, 3]. Однако практику лечения урогенитального хламидиоза короткими курсами нельзя полностью перенести на респираторные формы. Значительно сложнее поддаются лечению затяжные, хронические и особенно персистирующие формы хламидиозов. В этой ситуации нередко требуется проведение повторных циклов антибактериальной терапии, а их продолжительность увеличивается с 7–10 дней при бронхитах до 14–21 дня при пневмониях.
До настоящего времени отсутствует единая точка зрения на продолжительность лечения хламидиозов антибиотиками. В литературных источниках представлен достаточно большой разброс данных по эффективности антибактериальной терапии ХИ (от 40 до 100%), что свидетельствует о необходимости индивидуального подхода к выбору лечения, схема которого во многом определяется динамикой серологических показателей. Крайне важным следует считать вопрос о критериях излеченности ХИ. Зачастую клинические и бактериологические критерии выздоровления не совпадают. В некоторых исследованиях были сделаны попытки ориентироваться на культуральный метод выделения хламидий в ближайшие 2–3 недели после лечения, однако последнее реально лишь в случае доступности бактериологического материала. При респираторной и других формах хламидиоза ориентироваться на культуральный метод нельзя по причине невозможности взять образцы из очага воспаления. В этих ситуациях более достоверным является использование серологических методов на основе иммуноферментного анализа (ИФА) с определением титров антител (IgM и IgG) и фазы инфекционного процесса. Несомненно, важную роль в контроле лечения играет оценка серологических маркеров, в частности снижения титров специфических иммуноглобулинов. В гинекологической и урологической практике при проведении анализа материала, взятого в острой фазе воспаления, широко используется метод полимеразной цепной реакции (ПЦР). В педиатрической практике ПЦР также можно использовать, но только в качестве вспомогательного метода при острых формах бронхолегочных заболеваний (или в период обострения). В качестве основного метода диагностики хламидиоза использовать данную реакцию, как и определять антигены (АГ) в крови, не рекомендуется, поскольку информативность (чувствительность) методики в данном случае снижается до 14% [4].
Если в прежние годы для лечения инфекций, вызванных атипичными возбудителями, широко использовали препараты тетрациклинового ряда, то в последние годы эта группа антибиотиков практически не применяется из-за выраженных побочных реакций и низкой эффективности лечения. Ранее проведенные исследования показали, что тетрациклин, эритромицин и препараты хинолонового ряда менее эффективны в отношении хламидий, чем макролиды. На сегодняшний день макролиды являются практически единственной группой используемых в педиатрии антибиотиков, к которой высокочувствительны внутриклеточные инфекционные агенты. Макролиды обладают способностью к накоплению в тканях и очагах воспаления, причем наиболее интенсивно они накапливаются в миндалинах, лимфоузлах, легких, плевральной жидкости, органах малого таза, суставах, что и определяет предпочтительность использования препаратов данной группы для лечения хламидиоза. Кроме того, в последние годы значительно возросла роль макролидов в лечении заболеваний верхних и нижних дыхательных путей [5–7]. Широкое применение антибиотиков макролидного ряда можно объяснить следующими факторами: спектром действия, безопасностью, эффективностью, возможностью применения в различных формах у детей любого возраста и взрослых (диспергируемые таблетки, суспензии, внутривенные формы).
Макролиды преимущественно активны в отношении грамположительных, ряда грамотрицательных и внутриклеточных возбудителей (хламидий, микоплазм, легионелл). Высокую чувствительность к макролидам проявляют стрептококки, пневмококки, стафилококки, гонококки, хламидии, микоплазмы. Умеренной активностью обладают макролиды в отношении Helicobacter pylori, боррелий, микобактерий (не всех видов), токсоплазм, анаэробов, гемофильной палочки. Устойчивы к ним метициллин-резистентные штаммы стафилококков, E. faecium, грамотрицательные микроорганизмы семейства Enterobacteriaceae, P. aeruginosa, Acinetobacter, M. tuberculosis. Макролиды имеют особое химическое строение: в их структуре имеется макроциклическое лактонное кольцо, содержащее одну или несколько боковых углеводородных цепей. В основе классификации макролидов лежит число атомов углерода в лактонном кольце: 14-членные, 15-членные и 16-членные (табл. 1) [8]. За полвека было создано 14 макролидов, 8 из которых зарегистрированы в России. В представленной в таблице 1 классификации макролидов перечислены препараты, которые применяются в России. При приеме внутрь рекомендованы следующие дозы макролидов: джозамицин – 40–50 мг/кг/сут в 3 приема; cпирамицин – 150–300 тыс. МЕ/кг/сут в 2–3 приема; мидекамицин – 30–50 мг/кг/сут в 2–3 приема; рокситромицин – 5–8 мг/кг/сут в 2 приема; эритромицин – 40–50 мг/кг/сут в 3–4 приема; азитромицин – 10 мг/кг/сут в один прием; кларитромицин – 15 мг/кг/сут в 2 приема.
При лечении хламидиоза явно недостаточно ориентироваться только на клинические данные. Антибактериальная терапия у наблюдаемых нами детей проводилась при наличии повышенных титров хламидийных IgM (первичное острое инфицирование), нарастании титров IgG при повторном исследовании или их четырех- и более кратное повышение (реактивация, реинфекция). В качестве положительного серологического эффекта после лечения следует ориентироваться на снижение титров антител ниже референтных значений. В связи с появившимися данными о применении коротких курсов лечения макролидами (5–10 мг/кг азитромицина в течение 1–3 дней) при острых и осложненных формах инфекционных заболеваний вопрос о продолжительности антибактериальной терапии хламидиоза приобрел принципиальное значение. Такой подход может быть оправдан только у очень ограниченной группы детей с первичным инфицированием хламидиями и локальной воспалительной реакцией респираторного тракта. Данную ситуацию нужно обязательно подтверждать с помощью соответствующих серологических исследований, которые на практике, как правило, не проводятся. Наш опыт лечения свидетельствует о том, что в большинстве случаев мы имеем дело с обострением хронической инфекции или реинфицированием на фоне постоянного контакта больного с возбудителем. В этих ситуациях целесообразно применение более длительных, то есть 10-дневных, курсов лечения с последующим проведением иммунокорригирующей терапии.
Средняя продолжительность антибактериальной терапии составляет 5–10 дней. Курс лечения РХ определяется формой заболевания (острой или хронической – определяется по результатам серологического обследования). При острой форме заболевания возможно проведение короткого 5-дневного курса лечения. При наличии в анамнезе рецидивов заболевания, эпизодов затяжного кашля, а также в случае хронического течения РХ (по данным серологического обследования) проводится более длительный (10-дневный) курс лечения. Необходимость в повторных противорецидивных курсах антибактериальной терапии определяется по результатам контрольного серологического обследования через 2–4 месяца. Нами была проведена клиническая и серологическая оценка эффективности лечения макролидами (джозамицином, мидекамицином, рокситромицином, спирамицином, азитромицином, кларитромицином) при 5- и 10-дневных курсах лечения. После проведенной терапии антибиотиками у больных с ХИ отмечалось достоверное уменьшение общего количества рецидивов. Десятидневные курсы лечения оказались более эффективными, количество рецидивов после проведенных 10-дневных курсов лечения было на 23,7–38,3% меньше по сравнению с таковыми при 5-дневном лечении. Преимущество 10-дневного лечения больных с рецидивирующей ХИ было подтверждено меньшим количеством серопозитивных больных в течение всего периода наблюдения (1 год). Меньшей эффективностью обладал эритромицин (всего 40%). Выделены наиболее эффективные (84,6–95,5%) для лечения антибактериальные препараты (в порядке убывания эффекта): джозамицин, кларитромицин, рокситромицин, азитромицин, мидекамицин.
Выбор пути введения препарата (пероральный или парентеральный) зависит от тяжести течения заболевания. При тяжелых формах заболевания, пребывании детей в отделении реанимации и интенсивной терапии (ОРИТ), развитии тяжелых форм пневмонии, других осложнений и т.д. предпочтение отдается внутривенным или внутримышечным способам доставки антибиотиков. Препараты могут быть назначены детям различного возраста, включая новорожденных. Продолжительность лечения макролидами в этих случаях может быть увеличена до 2–3 недель. Существуют более продолжительные схемы лечения азитромицином, например, при муковисцидозе [9]. Значительно хуже поддаются лечению затяжные, хронические и особенно персистирующие формы хламидиозов. В этой ситуации нередко требуется проведение повторных циклов антибактериальной терапии, а их продолжительность увеличивается с 7–10 до 14–21 дней. Наилучшие результаты лечения болезни Рейтера у детей были получены при назначении нескольких курсов препаратов группы макролидов. Продолжительность лечения составила 3–4 недели. После первого курса терапии полное излечение отмечено у 42,5% детей, после второго – у 30%, после третьего – у 22%, что в общей сложности составило 94,5%.
В связи с ростом бесконтрольного применения антибиотиков особую актуальность приобретает проблема возможного развития резистентности хламидий к этим препаратам, аналогичной резистентности пневмококков к антибиотикам. По данным литературы, в странах Западной и Южной Европы широкое применение макролидов привело к росту количества резистентных штаммов пневмококков (до 30%). В США вплоть до конца 1980-х гг. к макролидам были чувствительны все штаммы пневмококков, однако с годами число устойчивых штаммов росло, и сегодня в США в той или иной степени устойчивы к макролидам около 25% пневмококков. В отношении хламидий и микоплазм пока таких сведений нет. Макролиды неэффективны в отношении микроорганизмов, обладающих природной устойчивостью к эритромицину (внутригрупповая перекрестная устойчивость).
Побочные эффекты, вызываемые макролидами, встречаются редко. Макролиды рассматриваются как наиболее безопасные препараты с точки зрения побочных реакций. У детей аллергические реакции на препараты данной группы наблюдаются не чаще чем в 5% случаев. Через 10–21 день от начала лечения могут развиться гепатотоксические реакции, сопровождающиеся увеличением размеров печени и повышением уровня билирубина в крови [10]. При сочетании с сыпью аллергического характера такие реакции рассматриваются как токсико-аллергические. Влияние препаратов на слух напрямую зависит от высоких доз и концентрации в сыворотке крови (в основном описаны при применении эритромицина). Кларитромицин не рекомендуется применять одновременно с теофиллинами из-за влияния на систему цитохрома печени. Не до конца ясен вопрос о взаимодействии азитромицина с дигоксином, поэтому рекомендуется контролировать содержание дигоксина в крови при приеме азитромицина. В литературе описаны случаи кардиотоксического действия макролидов, сопровождающиеся брадикардией, артериальной гипотонией, остановкой сердца.
Наиболее частое (5–29%) побочное явление при лечении макролидами – кишечная дисфункция, однако при приеме препаратов новых поколений она встречается реже (в 4–6% случаев). В этой связи заслуживают особого внимания инновационные технологии создания безопасных лекарств как для взрослых, так и для детей, к которым относится технология диспергируемых таблеток Солютаб. Действующее вещество объединяется в микрогранулы, покрытые кислотоустойчивой оболочкой, которая становится проницаемой только при воздействии бикарбонатов в кишечнике. Таким образом, действующее вещество высвобождается именно в зоне максимального всасывания, что позволяет избежать ряда побочных эффектов. Мы располагаем опытом применения джозамицина, который в прежние годы назначался детям в виде суспензии и взрослым в виде таблеток. Появление нового препарата – Вильпрафена Солютаб – открывает большие возможности и перспективы его применения в педиатрии. К главным преимуществам Вильпрафена Солютаб относятся:
- высокие концентрации действующего вещества в бронхиальном секрете, миндалинах;
- отсутствие мотилиноподобного действия обусловливает низкий риск нежелательных реакций со стороны желудочно-кишечного тракта;
- низкая вероятность ингибирования микросомальных ферментов печени предполагает низкий риск лекарственных взаимодействий;
- удобная форма приготовления и хранения за счет формы Солютаб.
По результатам серологического обследования было выявлено преобладание C. pneumoniae (58,7%) среди внутриклеточных возбудителей. Доля микоплазменных возбудителей была меньше: M. pneumoniae – 38,7%, M. hominis – 14,6%. Дети наблюдались амбулаторно со следующими диагнозами: ОРЗ – 32 (42,7%), простой бронхит – 16 (21,3%), обструктивный бронхит – 8 (10,7%) детей. В стационаре Вильпрафен® Солютаб был назначен 19 детям: из них у 18 (24%) с пневмониями и у 1 ребенка (1,3%) – с бронхиальной астмой. При анализе амбулаторных карт и историй болезни у 45,3% детей были выявлены рецидивирующие респираторные заболевания дыхательных путей и ЛОР-органов, именно по этой причине эти дети были отнесены к группе ЧБД. До момента обращения дети не были обследованы и не получали этиотропной терапии. Тем не менее 30,3% детей ранее лечились антибиотиками (Сумамедом короткими курсами, Амоксиклавом, Аугментином) как амбулаторно, так и в различных стационарах города. В анамнезе у 26,6% матерей имела место неблагополучно протекающая беременность: угроза выкидыша (10,7%), родоразрешение путем кесарева сечения (6,6%). Заслуживает внимания факт инфицирования 9,3% матерей во время беременности внутриклеточными возбудителями – хламидиями, уреаплазмами, микоплазмами.
Наряду с катаральными симптомами у детей имела место лимфаденопатия (34,7%), длительный субфебрилитет (12%), а также частые воспалительные заболевания ЛОР-органов – отиты, гаймориты, аденоидиты, ангины – у 16%. Анализ течения внутриклеточных инфекций показал преобладание смешанных инфекций, которые наблюдались у 42 (56%) детей, тогда как в виде моноинфекций заболевание протекало у 28 (37,3%) детей. У детей с моноинфицированием преобладали хламидии (у 18 (24%)), далее шли микоплазмы: M. pneumoniae – у 8 (10,7%), M. hominis – у 2 (2,6%). В случае смешанного инфицирования выделено два варианта: хламидийно-микоплазменное – у 13 (17,3%) детей и сочетание какой-либо из внутриклеточных инфекций с инфекцией, вызванной вирусом герпеса, – у 29 (38,7%) детей. Это обстоятельство нами учитывалось при назначении соответствующего лечения. На сегодняшний день внутриклеточные инфекции могут иметь несколько форм (острую, хроническую, персистирующую) (табл. 2). Хламидийную инфекцию у большинства детей характеризовало острое течение, микоплазменную – хроническое в стадии обострения. Следует подчеркнуть, что длительная персистенция и хроническое течение внутриклеточных инфекций требуют назначения более длительных курсов антибактериальной терапии, а сопутствующее инфицирование герпесвирусами – использования противовирусных и иммунных препаратов. Герпесвирусы (вирусы простого герпеса 1-го и 2-го типа, цитомегаловирус (ЦМВ), вирус Эпштейна – Барр (ЭБВ)) у большинства детей следует рассматривать как фоновые инфекции, которые находятся в стадии персистенции. Тем не менее имели место и острые формы. Их причиной являлись вирус простого герпеса 1-го и 2-го типа – у 25% детей, ЭБВ – у 18,7% детей, ЦМВ – у 12,5% детей.
Эффект лечения препаратом Вильпрафен® Солютаб оценивали по динамике клинических симптомов (при повторных осмотрах на 1, 3, 10-й день) и наличию (или отсутствию) серологических маркеров хламидий и микоплазм через 2 месяца после лечения (табл. 3). На фоне лечения оценивалось развитие осложнений и побочных явлений. Вильпрафен® Солютаб в качестве стартовой терапии получили 48 детей (64%), вторым курсом (после получения результатов серологического исследования и данных о чувствительности) – 27 детей (36%). Особенно следует подчеркнуть эффективность Вильпрафена Солютаб у детей с пневмониями в период эпидемического подъема заболеваемости гриппом в качестве стартового препарата либо вторым курсом после определения этиологии заболевания. Результаты лечения Вильпрафеном Солютаб свидетельствуют о положительной динамике со стороны основных клинических симптомов уже к 3-му дню лечения. Так, количество детей с кашлем к 3-му дню лечения сократилось в 2,7 раза, с хрипами в легких – в 4,6 раза, с нарушениями со стороны ЛОР-органов – в 3,5 раза. На фоне лечения значительно сокращались размеры лимфоузлов, однако это происходило более медленно. Конгломераты лимфоузлов исчезали к 7-му дню лечения. Также под действием антибиотикотерапии отмечалась нормализация сердечного ритма. Восстановление регулярного синусового ритма происходило медленнее.
Результат серологического исследования через 2 месяца после проведенного курса терапии был отрицательным у 43 (93,4%) из 46 детей. У 3 (6,5%) детей с диагнозом «бронхит» был проведен второй курс лечения Вильпрафеном Солютаб. При анализе историй болезни было выяснено, что у этих детей была смешанная хламидийно-микоплазменная инфекция, причем инфекция, вызванная одним из возбудителей, – в стадии хронического течения, которое потребовало более продолжительного курса лечения. Микробиологическое обследование детей, проведенное в динамике через 2 месяца, выявило также положительную динамику в виде значительного сокращения частоты обнаружения патогенной микрофлоры: S. pneumoniae (c 97,8% до 17,4%), Neisseriae spp. (с 86,9% до 6,5%), S. aureus (с 50% до 0%). Таким образом, уже к 3-му дню лечения применение Вильпрафена Солютаб у больных с серологически подтвержденными внутриклеточными инфекциями хламидийной и микоплазменной этиологии способствует значительному уменьшению выраженности клинических симптомов: кашля, лихорадки, воспалительных явлений со стороны ротоглотки.
Настоящее исследование показало, что Вильпрафен® Солютаб следует применять как в амбулаторной, так и в госпитальной практике либо в качестве стартовой терапии, либо вторым курсом после получения положительных серологических результатов на внутриклеточные инфекции (хламидии и микоплазмы). Большое значение при лечении хламидийной и микоплазменной инфекции имеет коррекция функциональных нарушений со стороны бронхолегочной и сердечно-сосудистой систем. Очень часто хроническая инфекция приводит к развитию бронхообструктивного синдрома, нередко на начальных стадиях болезни протекающего бессимптомно, а впоследствии переходящего в бронхиальную астму. По этой причине показано исследование функции внешнего дыхания у детей с 4-летнего возраста. В случаях выявления признаков бронхообструкции необходимо восстановление бронхиальной проходимости с помощью бета-агонистов и уменьшение гиперреактивности бронхов путем назначения ингаляционных кортикостероидов. В свою очередь, у детей с бронхиальной астмой показано проведение целенаправленного поиска «атипичной», в частности хламидийной, инфекции и в случае ее обнаружения – проведение этиотропной антибактериальной терапии.
Функциональные сердечно-сосудистые нарушения являются типичными для данных инфекций. Они значительно уменьшаются после успешно проведенной этиотропной терапии, однако полностью не исчезают. Важную роль в их коррекции играют методы физической реабилитации и восстановительного лечения в процессе диспансерного наблюдения. Как уже отмечалось ранее, специальную гипотензивную или антиаритмическую терапию целесообразно применять лишь ситуационно, при стойких нарушениях, не поддающихся этиотропному и немедикаментозному лечению. Решение вопроса о целесообразности длительного применения кардиотропной медикаментозной терапии следует перенести на более старший возраст, когда закончится возрастная морфофункциональная перестройка организма. Проведенное катамнестическое наблюдение за большой группой больных показало, что у многих детей основными причинами формирования хронического течения ХИ явились неадекватный контроль и недостаточно эффективное лечение заболевания на его ранних этапах, тесный и продолжительный контакт с инфицированными членами семьи и лицами в замкнутых коллективах. В этой связи большое значение приобретает своевременное проведение антибактериальной, иммунокорригирующей и функционально-восстановительной терапии ХИ.
Вместе с тем необходимо отметить, что одна антибактериальная терапия, являясь необходимым компонентом лечения, полностью не решает проблему рецидивирующего течения заболевания. Для лечения детей с ХИ необходимо исключать, в первую очередь, внутрисемейное инфицирование, которое является постоянным источником инфицирования и развития рецидивов. Второй по значению причиной неэффективного лечения является присутствие конкурирующих патогенов – герпесвирусов или других внутриклеточных возбудителей (микоплазм). Таким образом, лечение хламидийной инфекции у детей на сегодняшний день представляет собой сложную, многогранную проблему, которая должна решаться комплексно, с применением знаний из области серологии, сведений об эпидемиологической ситуации в семье, основных возбудителях, и при условии обязательного динамического наблюдения за пациентами.
1. Савенкова М.С., Савенков М.П. Респираторный хламидиоз у детей // Лечебное дело. 2007. № 1. С. 19–30.
2. Делекторский В.В., Яшкова Г.Н. Современное представление о роли хламидий в патологии урогенитального тракта (клиника, диагностика, лечение). М., 1994. 28 с.
3. Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий // М.: ЮНИТИ, 1995. 313 с.
4. Савенкова М.С. Клиника, диагностика и лечение респираторного хламидиоза у детей // Автореф. дисс. … докт. мед. наук. М., 2004. 46 с.
5. Ноников В.Е. Антибиотики-макролиды в пульмонологической практике // Атмосфера. Пульмонология и аллергология. 2004. № 3 (15). С. 24–28.
6. Самсыгина Г.А. Макролидные антибиотики в современной педиатрической практике // Фарматека. 2005. № 15 (110). С. 13–17.
7. Богомильский М.Р. Антибактериальная терапия ЛОР-инфекций у детей: синуситы, средние отиты, тонзиллиты // Consilium medicum. 2001. С. 10–14.
8. Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. М., 2002. 381 с.
9. Жаркова Л.П., Андреева И.В. Азитромицин в педиатрической практике: традиционные показания и новые возможности клинического использования // Фарматека. 2006. № 2 (117). С. 8–15.
10. Белоусов Ю.Б. Лекарственные поражения печени, ассоциируемые с макролидами. Очевидна ли связь? // РМЖ. Медицинское обозрение. 2011. Т. 19. № 18. С. 3–7.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Представлены собственные данные клинической и серологической оценки эффективности лечения респираторных форм хламидийной инфекции у детей препаратами группы макролидов. Показано, что наибольшую эффективность и самый высокий профиль безопасности демонстрирует инновационная форма джозамицина Вильпрафен® Солютаб, которая рекомендуется для применения как в амбулаторной, так и в госпитальной практике в качестве стартовой терапии или вторым курсом после получения положительных серологических результатов на внутриклеточные инфекции (хламидии и микоплазмы).
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
