Кишечная микробиота как ключевой фактор развития неврологического дефицита вследствие острого нарушения мозгового кровообращения у пациентов с запором
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить состав микробиоты толстого кишечника у пациентов с различным течением ОНМК и синдромом раздраженного кишечника (СРК) с преобладанием запора и установить зависимость прогрессирования клинического течения от состава микробиоты кишечника.
Материал и методы. В исследование было включено 67 пациентов, медиана возраста составила 62 года [50; 71]. Пациентов разделили на пять групп:
- ОНМК легкой степени тяжести с СРК с преобладанием запора (n = 13);
- ОНМК легкой степени тяжести без СРК (n = 13);
- ОНМК средней степени тяжести с СРК с преобладанием запора (n = 13);
- ОНМК средней степени тяжести без СРК (n = 13);
- референтная группа (здоровые добровольцы) (n = 15).
Результаты. Изменения состава микробиоты кишечника выявлены у 58 (86,5%) пациентов. В группах ОНМК и СРК с преобладанием запора зафиксирована значительная разница в количественном содержании бактерий рода Verrucomicrobia (Akkermansia muciniphila; 92,3%) и Bacteroidota (Prevotella clara; 76,9%).
Выводы. Полученные результаты подтверждают связь оси «кишечник – мозг» с нервной системой. Выявление нарушения количественного представительства определенных микроорганизмов поможет создать прогностическую модель профилактики осложнений инсульта.
Цель – изучить состав микробиоты толстого кишечника у пациентов с различным течением ОНМК и синдромом раздраженного кишечника (СРК) с преобладанием запора и установить зависимость прогрессирования клинического течения от состава микробиоты кишечника.
Материал и методы. В исследование было включено 67 пациентов, медиана возраста составила 62 года [50; 71]. Пациентов разделили на пять групп:
- ОНМК легкой степени тяжести с СРК с преобладанием запора (n = 13);
- ОНМК легкой степени тяжести без СРК (n = 13);
- ОНМК средней степени тяжести с СРК с преобладанием запора (n = 13);
- ОНМК средней степени тяжести без СРК (n = 13);
- референтная группа (здоровые добровольцы) (n = 15).
Результаты. Изменения состава микробиоты кишечника выявлены у 58 (86,5%) пациентов. В группах ОНМК и СРК с преобладанием запора зафиксирована значительная разница в количественном содержании бактерий рода Verrucomicrobia (Akkermansia muciniphila; 92,3%) и Bacteroidota (Prevotella clara; 76,9%).
Выводы. Полученные результаты подтверждают связь оси «кишечник – мозг» с нервной системой. Выявление нарушения количественного представительства определенных микроорганизмов поможет создать прогностическую модель профилактики осложнений инсульта.
Введение
Острое нарушение мозгового кровообращения (ОНМК) – значимое медико-социальное заболевание, которое характеризуется высоким уровнем инвалидизации и смертности в мире [1]. Низкий процент возвращения к труду (около 20%) и длительная постинсультная реабилитация снижают качество жизни пациентов [2]. Приоритетными направлениями в борьбе с цереброваскулярными заболеваниями, в том числе ОНМК, являются первичная профилактика и снижение влияния факторов риска. Основными факторами риска развития ОНМК считаются артериальная гипертензия, курение, употребление алкоголя, заболевания сердца, сахарный диабет, дислипидемия и образ жизни (низкая физическая активность, избыточный вес, стресс). Кроме того, по последним данным, одним из главных факторов риска развития заболевания является нарушение состава микробиома человека [3]. Под микробиомом понимают совокупность всех микробов, населяющих организм человека. Ведущую роль в патогенезе ряда заболеваний играет кишечник [4].
Существует понятие оси «кишечник – мозг». Эта ось представляет собой сложную коммуникационную сеть, связывающую желудочно-кишечный тракт (ЖКТ) и центральную нервную систему (ЦНС). Связь внутри оси возникает через преобразование сенсорной информации в нейронные, гормональные и иммунные сигналы, передаваемые от ЦНС к кишечнику и обратно. Важной молекулой, циркулирующей в составе клеточной стенки, является пептидогликан. Его фрагменты образуются из клеточных стенок бактерий и могут преодолевать гематоэнцефалический барьер и активировать рецепторы. Микробиота кишечника косвенно влияет на ЦНС, регулируя местный иммунитет и системно воздействуя на развивающийся мозг, а также влияет на нейроразвитие, выступая в качестве медиатора [5]. Микроглия тесно связана с нейроразвитием, и аномалии в ее морфологии, а также функциях могут ассоциироваться с нарушением развития нервной системы. Одним из распространенных сопутствующих заболеваний при ОНМК является синдром раздраженного кишечника (СРК) с преобладанием запора. Запор – симптом, который сопровождается нарушением работы кишечника [6]. Пациенты, перенесшие ОНМК, помимо неврологического дефицита отмечают осложнения в работе ЖКТ [7], которые обычно проявляются диареей, запором, снижением поступления питательных веществ вследствие нарушения глотания и изменения состава микробиоты кишечника.
При запоре интервал между актами дефекации удлиняется до 72 часов и более, что сопровождается изменением консистенции и формы каловых масс, чувством неполного опорожнения кишечника во время акта дефекации, безрезультативным избыточным натуживанием [8]. Нередко пациенты самостоятельно используют слабительные средства, микроклизмы, что может усугубить клинические проявления и вызвать зависимость. В условиях стационарного лечения пациентам с запором назначают манипуляции, облегчающие процесс дефекации.
Бристольская шкала кала – важный инструментарий для оценки формы и текстуры стула, а следовательно, состояния здоровья кишечника и выявления потенциальных проблем с пищеварением [9, 10]. Чем дольше стул задерживается в кишечнике, тем более твердым и сухим он становится. Это увеличивает риск развития запора и его осложнений [11]. По Бристольской шкале запору соответствуют 1-й и 2-й типы. Каловые массы 1-го типа в виде отдельных округлых комков, похожих на орехи, трудно передвигаются по толстому кишечнику. Каловые массы 2-го типа в форме колбаски, но из отдельных комков также трудно продвигаются [12].
Все больше появляется данных, подтверждающих патологическую роль нарушения микробиоты кишечника в развитии функционального запора. Наблюдения показывают, что функциональный запор связан с уменьшением количества полезных видов, увеличением количества патогенных видов и уменьшением видового разнообразия. Кроме того, микробиота кишечника способна модулировать функции кишечника посредством продукции метаболитов, таких как короткоцепочечные жирные кислоты и желчные кислоты, и косвенной кишечной нейроэндокринной регуляции у животных [13].
Мы проанализировали состав микробиоты кишечника у пациентов с запором и выявили его связь с течением и исходом ОНМК. Изучение микробиотического фактора позволяет существенно изменить подход к диагностике, лечению и реабилитации пациентов с ОНМК [14]. Мы установили взаимосвязь между определенными микроорганизмами и неврологическими нарушениями [15].
Цель – изучить состав микробиоты толстого кишечника у пациентов с различным течением ОНМК и СРК с преобладанием запора и установить зависимость между прогрессированием клинического течения и составом микробиоты кишечника.
Материал и методы
В исследовании участвовало 67 пациентов в возрасте 50–71 года. Возрастная медиана составила 62 года [50; 71], медиана длительности госпитализации – десять дней [9–13]. Отбор участников исследования проводили в сосудистом отделении БУЗ ВО «Воронежская областная клиническая больница № 1» и БУЗ ВО «Воронежская городская клиническая поликлиника № 1» в период с декабря 2023 г. по декабрь 2025 г. Из 67 пациентов 15 не состояли на диспансерном учете по поводу хронических заболеваний или пороков развития, не получали какой-либо медикаментозной поддержки, в частности местных антисептиков и антибактериальной терапии, в течение месяца перед стартом исследования, 52 пациента проходили лечение по поводу ОНМК. Участники исследования были разделены на пять групп:
- ОНМК легкой степени тяжести (1–4 балла по NIHSS (National Institutes of Health Stroke Scale, шкала инсульта Национального института здоровья) с СРК с преобладанием запора (n = 13);
- ОНМК легкой степени тяжести (1–4 балла по NIHSS) без СРК (n = 13);
- ОНМК средней степени тяжести (5–15 баллов по NIHSS) с СРК с преобладанием запора (n = 13);
- ОНМК средней степени тяжести (5–15 баллов по NIHSS) без СРК (n = 13);
- референтная группа (здоровые добровольцы; n = 15).
Во всех группах проводили сравнительный анализ клинических данных и общеклинических лабораторных исследований, сбор анамнеза и анализ кала методом генетического секвенирования 16S-рибосомальной РНК для установления состава микробиоты кишечника.
Для сбора анамнеза нами была разработана шкала наличия запора. У всех пациентов брали образцы материала для общего анализа крови и анализа кала для генетического секвенирования. Кроме того, проводили неврологическое обследование и анкетирование.
Статистическую обработку полученных результатов осуществляли методом параметрического и непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов выполнялись в электронных таблицах Microsoft Exell в составе пакета Microsoft Office LTSC профессиональный плюс 2024. Статистический анализ выполняли в программе IBM SPSS Statistics 25.0. Данные вносили в единую базу, в которой содержались исследуемые показатели в виде абсолютных и относительных величин. Полученные данные в зависимости от принадлежности к группе пациентов объединяли в вариационные ряды. Данные обрабатывали с использованием лицензионной программы Microsoft Excel 2019 г. При сравнении групп применяли точный критерий Фишера. Полногеномное секвенирование полученных библиотек осуществлялось на платформе Oxford Nanopore Technologies с минимальным выходом 5000 видов на образец. Поскольку большинство изучаемых переменных имели распределение, отличное от нормального, в качестве меры центральной тенденции использовалась медиана (Ме), а для характеристики меры изменчивости – межквартильный интервал (Q1–Q3). Таким образом, все признаки описаны в виде Ме [Q1–Q3], где Ме – медиана, Q1 и Q3 – первый и третий квартили соответственно. Для исследования номинальных переменных применяли точный критерий Фишера (если предполагаемое число наблюдений менее пяти более чем в 20% ячеек) или χ2 Пирсона (если предполагаемое число наблюдений менее пяти не более чем в 20% ячеек). Интерпретация полученных результатов выполнялась с помощью таблиц сопряженности.
Межгрупповые различия показателей считались статистически значимыми при p < 0,05, то есть вероятности безошибочного прогноза не менее 95%. Для визуализации данных использовались преимущественно графики типа «ящик с усами».
Результаты
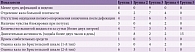
На основании полученных данных были установлены значимые отличия в количественном содержании микроорганизмов в кале пациентов. В таблице 1 представлены данные анкетирования пациентов. Как видим, частота встречаемости акта дефекации реже трех раз в неделю в третьей группе выше, чем в первой (76,9 и 61,5% соответственно). Отделение кала большой плотности также в третьей группе встречалось чаще, чем в первой (53,8 и 46,1% соответственно). Во второй группе данный показатель составил 15,3%, в четвертой – 30,7%. Отсутствие ощущения полного опорожнения кишечника после акта дефекации отмечали 30,7% пациентов первой группы, 15,3% – второй, 46,1% – третьей, 23% – четвертой, 6,7% – пятой. Двигательная активность в третьей и четвертой группах была сопоставимой – 15,3%. В первой группе этот показатель составил 38%, в пятой – 100%. При оценке кала по Бристольской шкале преимущественно в первой группе отмечался 2-й тип – 46,1%, в третьей группе – 1-й тип (30,7%).
Каждому пациенту проводилось анкетирование с использованием NIHSS, MoCA (Montreal Cognitive Assessment, Монреальская когнитивная шкала), ШРМ (шкала реабилитационной маршрутизации) и оценкой длительности госпитализации. У пациентов с ОНМК без СРК результаты были лучше, чем у пациентов с ОНМК и СРК с преобладанием запора.
Проанализируем результаты, полученные в группах пациентов с ОНМК легкой степени тяжести (1–4 балла по NIHSS). Когнитивные процессы в первой группе были выражены слабее, чем во второй, среднее значение – 21,6/30 и 21,9/30 баллов соответственно. Согласно ШРМ, пациенты обеих групп в среднем имели легкое нарушение функционирования и ограничение жизнедеятельности (2 балла). Средняя длительность госпитализации в первой группе составила 8,84 дня, во второй – 8,38 дня.
В отношении групп пациентов с ОНМК средней степени тяжести (5–15 баллов по NIHSS) можно сделать следующие выводы. При определении когнитивных способностей по MoCA в третьей группе средние значения были ниже (11,7 балла), чем в четвертой (12,38 балла). По ШРМ пациенты обеих групп в среднем имели легкое нарушение функционирования и ограничение жизнедеятельности (2 балла). Средняя длительность госпитализации в третьей группе составила 12,07 дня, в четвертой – 10,3 дня. Результаты опроса и осмотра представлены в табл. 2.
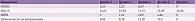
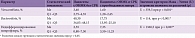
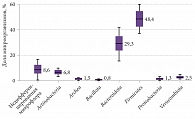
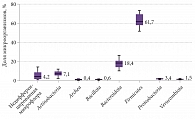
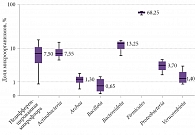
При микробиологическом исследовании методом генетического секвенирования фрагмента гена 16S-рибосомальной РНК были определены основные представительства микроорганизмов. Установлено среднее количество микроорганизмов, что позволило судить об их содержании в толстом кишечнике. Согласно данным, у пациентов с СРК и преобладанием запора метаногенных бактерий рода Bacteroidota (Prevotella) было меньше, чем у пациентов без запора. Медиана количества бактерий рода Verrucomicrobia составила 3,40 [2,75–4,35], Bacteroidota – 40,30 [34,05–48,15]. Различия в составе микробиома между группами представлены в табл. 3.
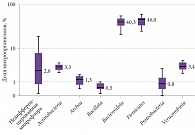
На рисунках 1–4 показан типологический состав кишечной микробиоты пациентов разных групп (использована логарифмическая шкала).
Результаты исследования показали, что влияние оси «кишечник – мозг» имеет высокую значимость в клинике неврологических заболеваний. У пациентов, у которых уровни бактерий рода Verrucomicrobia и Bacteroidota снижены, проявления неврологического дефицита и запора выше, чем у пациентов с нормальной микрофлорой.
При комплексной оценке групп пациентов с ОНМК и СРК с преобладанием запора получен ожидаемый результат в виде продолжительной госпитализации более десяти дней (84,6%), снижения когнитивных функций у пациентов с ОНМК легкой степени тяжести – Ме – 21,5 [19,5–23,5], у пациентов с ОНМК средней степени тяжести – Ме – 12,5 [10,5–14,5] и ухудшения неврологического состояния.
До недавнего времени данных о влиянии микробиоты толстого кишечника на различные процессы в организме было крайне мало [16]. В нашем исследовании подтвержден тот факт, что ось «кишечник – мозг» может рассматриваться как единый механизм лечения и профилактики ОНМК. Микробиота кишечника напрямую зависит от таких факторов, как питание, избыточная масса тела, характер потребляемой пищи. Установлено, что у пациентов с ОНМК без СРК существенно более низкий результат по NIHSS (p < 0,001), шкале оценки нутритивного статуса (NRS-2002) (p < 0,001), ШРМ (p < 0,001), более низкие индекс массы тела (p < 0,001), сроки госпитализации (p < 0,001), но более высокий балл по МoCА (p < 0,001).
Заключение
Показана взаимосвязь между кишечной микробиотой и клинической картиной инсульта. Полученные данные свидетельствуют о том, что роль микробиома в патогенезе ОНМК значима, но до конца не изучена. На основании представленных результатов можно построить прогностическую модель лечения и профилактики болезней системы кровообращения. Метод генетического секвенирования 16S-рибосомальной РНК позволит врачам-неврологам заподозрить нарушение состава кишечной микробиоты и вовремя начать лечение.
Авторы заявляют об отсутствии финансирования и конфликта интересов.
N.A. Khripushin, G.S. Golosnaya, PhD, Prof., N.A. Ermolenko, PhD, Prof., O.N. Krasnorutskaya, PhD, Prof.
N.N. Burdenko Voronezh State Medical University
Contact person: Nikita A. Khripushin, hripushinn@mail.ru
Relevance. Acute cerebrovascular accident (ACVC) is one of the most common vascular diseases and one of the leading causes of death and disability in the world. Modern approaches to treatment and rehabilitation are aimed not only at eliminating vascular factors, but also at correcting systemic disorders affecting the restoration of neurological function. One of the factors that has recently received special attention is the state of the intestinal microbiota. Studies show that the gut microbiota significantly affects the human nervous system by acting through the gut – brain axis, affecting neuroinflammation, barriers, immune responses, and neuroplasticity. Of particular clinical importance is the study of this relationship in patients with chronic constipation, which is common in people with stroke and is itself associated with a pronounced microbiotic imbalance.
The aim was to study the composition of the microbiota of the large intestine in patients with various types of cancer and irritable bowel syndrome (IBS) with a predominance of constipation and to establish the dependence of the progression of the clinical course on the composition of the intestinal microbiota.
Material and methods. The study included 67 patients with a median age of 62 years [50; 71]. The patients were divided into five groups:
- mild ACVC with IBS with predominance of constipation (n = 13);
- mild ACVC without IBS (n = 13);
- moderate grade ACVC with IBS with predominance of constipation (n = 13);
- moderate grade ACVC without IBS (n = 13);
- reference group (healthy volunteers) (n = 15).
Results. A change in the composition of the intestinal microbiota was detected in 58 (86.5%) patients. In the groups of patients with ACVC and IBS with a predominance of constipation, there was a significant difference in the quantitative content of bacteria of the genus Verrucomicrobia (Akkermansia muciniphila; 92.3%) and Bacteroidota (Prevotella clara; 76.9%).
Conclusions. The results obtained in the framework of the study prove the existence of a connection between the gut – brain axis. The detection of a violation of the quantitative representation of certain microorganisms may make it possible to create a prognostic model for the prevention of stroke complications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


