Алгоритм поддержки принятия решений о реабилитационных мероприятиях для пациента с постинсультным парезом на основании клинико-нейровизуализационных данных
- Аннотация
- Статья
- Ссылки
- English



Инсульт является одной из ведущих причин утраты трудоспособности в мире. В России ежегодно регистрируется свыше 500 тыс. случаев впервые выявленного инсульта, после которого менее 10% людей возвращаются к трудовой деятельности и более 30% остаются инвалидами. Вследствие поражения кортико-спинальных (пирамидных) трактов (КСТ) при инсульте развиваются двигательные нарушения в виде пареза, в дальнейшем значительно снижающие качество жизни пациентов [1].
Один из ключевых вопросов, стоящих перед мультидисциплинарной бригадой (МДБ) специалистов, занимающихся помощью пациентам, перенесшим инсульт, – разработка индивидуальной программы реабилитации с учетом потенциала каждого пациента в аспекте восстановления [2]. В течение ряда лет в России и зарубежных странах осуществляются работы, направленные на выделение основных факторов, влияющих на прогноз восстановления двигательной функции. В ситуациях, когда достаточного восстановления утраченных функций не ожидается, задача врачей – подобрать методики адаптации и максимального вовлечения пациента в самообслуживание. Если реабилитационный потенциал в плане восстановления утраченных функций в паретичных конечностях после церебрального инсульта высокий, то задачи МДБ состоят в ранней и интенсивной реабилитации с акцентом на терапию, включая физическую терапию, эрготерапию, психологическое стимулирование, направленные на восстановление моторной функции мышц.
Диффузионно-тензорная магнитно-резонансная томография (ДТ-МРТ, трактография) является современным методом нейровизуализации, позволяющим количественно и качественно оценить микроструктуру проводящих путей головного мозга [3]. Метод основан на измерении направленной диффузии молекул воды, что дает возможность получать информацию о целостности нервных волокон. Трактография, основанная на данных ДТ-МРТ, позволяет визуализировать КСТ, что способствует более точной диагностике и прогнозированию восстановления двигательных функций.
Исследования демонстрируют, что изменения показателей фракционной анизотропии (ФА) и средней диффузии (СД) в КСТ на основании данных магнитно-резонансной (МР) трактографии могут отражать степень повреждения белого вещества и коррелировать с тяжестью двигательных нарушений [4, 5].
Нами проведено клинико-нейровизуализационное исследование, основные положения которого публиковались ранее [6–10]. Полученные результаты позволили разработать дополнительный алгоритм принятия решений о реабилитационных мероприятиях для пациента с постинсультным парезом.
Материал и методы
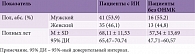
С 2021 по 2024 г. в Федеральном государственном бюджетном образовательном учреждении высшего образования «Башкирский государственный медицинский университет» (БГМУ) Минздрава России проводилось исследование по оценке клинико-нейровизуализационных данных, собранных в Республиканской клинической больнице им. Г.Г. Куватова и Клинике БГМУ. Дизайн исследования включал современные расширенные протоколы МРТ с МР-трактографией, описанные ранее [6–10]. Работа основана на данных 105 взрослых пациентов, осмотренных нами: 76 пациентов в раннем и позднем восстановительном периодах острого церебрального ишемического инсульта (ИИ) составили основную группу, 29 человек без проявлений острого нарушения мозгового кровообращения (ОНМК) и симптомов поражения центральной нервной системы – контрольную (табл. 1).
Все исследованные пациенты имели клинически зафиксированный постинсультный центральный парез мышц конечностей, подписали информированное добровольное согласие на участие в исследовании, не страдали деменцией (когнитивный статус по Монреальской шкале оценки когнитивных функций более 24 баллов), находились в ясном сознании. В исследовании не участвовали пациенты, которым было противопоказано проведение МРТ головного мозга, и пациенты, получавшие тромболитическую терапию в остром периоде ИИ. Данные сравнивали с показателями пациентов без ОНМК в анамнезе, без диагностированного двигательного дефицита, которым МРТ головного мозга выполнялась по другим показаниям в соответствии с назначением лечащего врача.
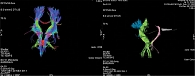
Изображения, полученные для анализа (рис. 1), оценивались двумя специалистами-рентгенологами количественно по следующим параметрам при ДТ-МРТ: ФА (от 1 до 0), средняя скорость диффузии (АvDC, мм2/с), плотность тракта (ПТ), аксиальная диффузия (АД, мм2/с), радиальная диффузия (РД, мм2/с), СД (мм2/с).
Оценивали соотношение ФА ипсилатерально (относительно очага поражения) в КСТ и показателей ФА в КСТ в контралатеральном полушарии.
Статистическая обработка данных осуществлялась с помощью программных продуктов SPSS Statistics v. 26.0 (IBM) и StatTech v. 4.8.0 (ООО «Статтех», Россия). Для оценки количественных данных на соответствие закону нормального распределения использовали критерий Шапиро – Уилка при объеме выборки менее 50 наблюдений и критерий Колмогорова – Смирнова при числе наблюдений более 50. При нормальном распределении количественные данные представляли в виде среднего арифметического (M), стандартного отклонения (SD) и диапазона 95%-ного доверительного интервала (ДИ). В случае ненормального распределения данные описывали с помощью медианы (Me), а также нижнего и верхнего квартилей (Q1–Q3). При сравнении двух групп по количественным переменным с нормальным распределением применяли критерий Стьюдента (при равенстве дисперсий) либо критерий Уэлча (при неравенстве дисперсий). Если распределение показателя отличалось от нормального, сравнение проводилось на основании U-критерия Манна – Уитни. Диагностическую значимость количественных признаков для прогноза определенного клинического исхода оценивали путем анализа ROC-кривых. Пороговое значение количественного признака (cut-off) определяли по максимальному значению индекса Юдена. Статистически значимыми считали результаты при p < 0,05.
Все исследования были выполнены на аппарате OPTIMA 360 (GE) с напряженностью магнитного поля 1,5 Т. Применялась 16-канальная поверхностная квадратическая катушка для головного мозга. Стандартный протокол, согласно клиническим рекомендациям, включал в себя набор программ с получением T1- и T2-взвешенных изображений, а также изображений в режиме T2-FLAIR с подавлением сигнала от свободной воды и диффузионно-взвешенных изображений (DWI) с коэффициентами диффузии b0 и b1000 с/мм2. Трактографию (DTI) выполняли в 25 направлениях с первичным получением цветовой карты фракционной анизотропии и последующим объемным моделированием КСТ. Реконструкция полученных изображений осуществлялась с помощью пакета рабочих программ Volume Viewer 7. Анализ DTI проводился на рабочей станции AW Volume Share 7 с использованием программного обеспечения READY View. На изображениях оценивали значения ФА, плотность трактов, показатели радиальной и аксиальной диффузии, средний коэффициент диффузии.
Результаты
Показатель по Шкале реабилитационной маршрутизации (ШРМ), закрепленный в актуальных клинических рекомендациях и оцененный в исследовании у каждого пациента, был преобразован в категориальный признак, где показатели от 0 до 3 баллов расценивались как функциональная независимость пациента от окружающих, а от 4 до 6 баллов – как функциональная зависимость.
Показатель по Шкале оценки тяжести инсульта Национального института здоровья США (NIHSS) был также преобразован в категориальный признак, где показатели от 0 до 5 баллов расценивались как благоприятный исход ИИ в раннем восстановительном периоде, а от 6 баллов и выше – как неблагоприятный исход ИИ.
Анализ клинико-нейровизуализационных данных выявил значимые различия показателей ДТ-МРТ между пациентами с разными уровнями функциональной зависимости по ШРМ и неврологического дефицита по шкале NIHSS.
Было рассчитано отношение ФА в КСТ ипсилатерально к очагу инсульта и ФА в КСТ контралатерально к очагу инсульта. У пациентов, независимых от окружающих, с показателями ШРМ от 0 до 3 баллов эти значения оказались существенно выше (0,98 против 0,94), что было статистически значимо при p < 0,001 (табл. 2).
По результатам ROC-анализа площадь под кривой составила 0,959 ± 0,018 (95% ДИ 0,924–0,994). Полученная модель была статистически значимой (p < 0,001). Пороговое значение отношения ФА в КСТ в пораженном полушарии и ФА в КСТ интактного полушария в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,963. Чувствительность и специфичность модели – 95,8 и 87,7% соответственно.
Установлено, что показатели ФА и РД, по данным МР-трактографии, оказывают наибольшее влияние на потенциальный двигательный исход после перенесенного ИИ (табл. 3).
Как результат данной работы предлагаем алгоритм поддержки принятия решений, основанный на данных нейровизуализационного исследования отдельного пациента. Такой алгоритм может быть полезен МДБ при определении стратегии реабилитационных мероприятий (рис. 2).
Обсуждение
Результаты проведенного нами клинико-нейровизуализационного исследования позволили выделить ряд показателей, на основании которых МДБ, планирующая реабилитационные мероприятия, может прогнозировать потенциал восстановления активных движений (разрешения парезов) в конечностях пациента, перенесшего ИИ.
Так, отношение показателей ФА по данным МР-трактографии КСТ у пациентов в восстановительном (раннем и позднем) периодах церебрального ИИ ипсилатарельно к стороне ОНМК и ФА в контралатеральном полушарии 0,976 (p < 0,001) и менее и РД 0,851 (p < 0,001) и ниже ассоциируется с неблагоприятным исходом для восстановления моторной функции в паретичных конечностях в раннем восстановительном периоде ИИ. Аналогичным образом рассчитанные показатели отношений аксиальной диффузии 0,888 (p < 0,001) и ниже и средней диффузии 0,905 (p < 0,001) и ниже могут ассоциироваться с функциональной зависимостью пациента от окружающих.
При значениях по ШРМ 4 балла и более и по NIHSS 6 баллов и более с учетом параметров ФА, РД, АД и СД реабилитационные усилия следует сосредоточить на адаптации пациента к новым условиям жизни с учетом незначительных шансов на восстановление паретичных конечностей. В случаях, когда показатели ШРМ в пределах от 0 до 3 баллов и значения по NIHSS от 0 до 5 баллов сочетаются с более высокими показателями отношений ФА, РД, АД и СД в КСТ по данным МР-трактографии, есть основания считать, что специалисты восстановительной медицины должны направить усилия на максимальное восстановление функции паретичных конечностей с помощью научно обоснованных и доказанных медико-социальных реабилитационных методов.
Заключение
Предложенный в данной работе алгоритм поддержки принятия решения, разработанный на основании клинических данных и результатов МР-трактографии, может оказаться полезным в практической работе МДБ для формирования стратегии персонализированных реабилитационных мероприятий для пациента в восстановительном периоде ИИ. Алгоритм можно применять в дополнение к методикам, ранее рекомендованным российскими [1, 11, 12] и зарубежными [13, 14] специалистами.
R.R. Gizatullin, L.R. Akhmadeeva, PhD, Prof., D.E. Baykov, PhD, Prof.
Bashkir State Medical University
Russian Railways-Medicine Clinical Hospital, Ufa
Academy of Sciences of Bashkortostan Republic
Contact person: Leila R. Akhmadeeva, Leila_ufa@mail.ru
Based on our own clinical and modern neuroimaging data (quantitative assessment of magnetic resonance (MR) tractography), we present a decision support algorithm for multidisciplinary teams providing rehabilitation care to patients with motor deficits (central limb muscle paresis) in the recovery period of acute ischemic stroke. The quantitative parameters allowing personalized prediction of the rehabilitation potential of such patients are analyzed. Based on the ROC analysis, the cut-off points embedded in the proposed algorithm are determined. Thus, the ratio of fractional anisotropy (FA) indices according to MR tractography of the corticospinal tracts in the studied patients ipsilateral to the stroke side to FA in the contralateral hemisphere, amounting to 0.976 (p < 0.001) or less, and radial diffusion (RD) 0.851 (p < 0.001) or less are associated with an unfavorable outcome for the restoration of motor function in the paretic limbs for the specified group of patients. The ratio of axial diffusion (AD) indices 0.888 (p < 0.001) or less, and mean diffusion (MD) 0.905 (p < 0.001) or less may be associated with the patient's functional dependence on others. If the values of the Russia Rehabilitation routing scale (RRS) are 4 or more points and the NIHSS scale is 6 or more points, taking into account the described parameters of FA, RD, AD and MD, rehabilitation efforts should be focused on the patient's adaptation to new living conditions. In cases where the RRS values are in the range from 0 to 3 points, NIHSS – from 0 to 5 points, in combination with higher values of the ratios of the parameters of FA, RD, AD and MD in the corticospinal tracts according to MR tractography data, there is reason to believe that specialists in rehabilitation medicine should focus their efforts on maximum restoration of the function of paretic limbs using scientifically based and proven medical and social rehabilitation methods.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.