Клиническая фармакология Суперлимфа при заболеваниях урогенитального тракта через призму уровней реализации его эффектов
- Аннотация
- Статья
- Ссылки
- English
Введение
Иммунотропный препарат Суперлимф представляет собой фракцию противомикробных (протегрин-подобных) пептидов и естественный комплекс цитокинов, в частности интерлейкинов (ИЛ) 1, 2, 6, фактора некроза опухоли альфа, фактора, ингибирующего миграцию фагоцитов, трансформирующего фактора роста бета. Суперлимф обладает широким спектром влияния на клетки, участвующие в реакциях врожденного иммунитета: макрофаги, нейтрофилы и естественные киллеры. Препарат активирует фагоцитоз, выработку ИЛ, фактора некроза опухоли (ФНО) альфа, интерферона (ИФН) альфа и гамма моноцитами, индуцирует противоопухолевую активность макрофагов, способствует гибели внутриклеточных паразитов, регулирует миграцию лейкоцитов. Вследствие активации клеток макрофагально-моноцитарного ряда под влиянием Суперлимфа активируются механизмы адаптивного клеточного и гуморального иммунного ответа. Рассмотрим механизмы действия лекарственного препарата в соответствии с уровнем реализации эффекта при заболеваниях урогенитального тракта.
Механизмы действия Суперлимфа в соответствии с уровнем реализации эффекта
Согласно Государственному реестру лекарственных средств, препарат Суперлимф определяется по фармакотерапевтической группе как стимулятор репарации тканей. Репаративной называют регенерацию, протекающую вследствие повреждения или утраты какой-либо части тела или ткани. Это сложный динамичный процесс, высокодинамичный каскад сигналов, поддерживаемый множеством клеточных событий, которые должны быть тесно скоординированы для эффективного восстановления. В настоящее время регенерация представляет собой отдельное направление медицины – регенеративная медицина.
К сожалению, практикующий врач нечасто сталкивается с достижениями регенеративной медицины в силу того, что данное направление зачастую носит экспериментальный характер. Методы и препараты не входят в клинические рекомендации, нередко имеют высокую стоимость, а о принципах и механизмах действия рассказывается только на профильных образовательных мероприятиях. Вместе с тем известно, что методы регенеративной медицины направлены на адекватное восстановление структуры и функции поврежденного органа или ткани. Значит, они способны повышать качество жизни, продлевать трудоспособный возраст, снижать затраты на длительное лечение пациентов с хроническими заболеваниями [1].
Методы регенеративной медицины принято ассоциировать с использованием стволовых клеток, клеток-предшественников, выделенных из разных аллогенных органов, задействованных в процессе производства организмом новых клеток для замещения старых и нормализации работы имеющихся [1].
За последние два десятилетия были проведены исследования с использованием стволовых клеток при ряде хронических урологических состояний, при которых традиционная терапия оказалась неудовлетворительной, например дисфункции мочевого пузыря, стрессовом недержании мочи, эректильной дисфункции, травме уретры, острой почечной недостаточности и ишемической травме почек [2].
Доказано, что трансплантация разных стволовых клеток из разнообразных источников в полость матки влияет на эндометрий (предотвращает развитие фиброза, повышает количество желез, стимулирует ангиогенез, увеличивает толщину эндометрия, лучше формирует тканевые структуры), что приводит к повышению частоты наступления беременности [3, 4].
Нередко механизм действия объясняется высвобождением различных биоактивных молекул трансплантированными стволовыми клетками, которые модулируют воспаление, различные иммунные реакции. В конечном счете активируются тканеспецифичные клетки-предшественники, что приводит к регенерации [5–8].
Несмотря на впечатляющие эффекты стволовых клеток, сохраняется ряд серьезных негативных рисков, в частности опасность неконтролируемого роста (при пересадке некоторые клетки остаются недифференцированными и пролиферирующими), неопределенность в отношении долгосрочных эффектов индуцированного плюрипотентного состояния. Кроме того, известно, что соматические клетки за время жизни организма накапливают в своих геномах изменения, которые могут отражаться на свойствах полученных из них плюрипотентных клеток. Перепрограммирование может активировать онкогены, из-за чего возрастает риск возникновения опухолей или тератокарцином [9, 10].
Наряду с методом стволовых клеток существуют другие методы, демонстрирующие регенеративный эффект, с использованием аллогенных клеток. Имеются доказательства применения аутологичной плазмы, богатой тромбоцитами, для стимуляции регенерации эндометрия в клинических ситуациях с нарушением роста эндометрия и рубцеванием [11]. В обзорах данный метод расценивают как альтернативную стратегию лечения пациенток с тонким эндометрием и рецидивирующей неудачей имплантации [12].
В урологической практике аутологичную плазму, богатую тромбоцитами, успешно используют в качестве инстилляций и инъекций при заболеваниях мочевого пузыря в качестве стимулятора регенерации [13–17].
Посредством секреции альфа-гранул тромбоцитов плазма, богатая тромбоцитами, увеличивает высвобождение факторов роста, молекул адгезии и хемокинов, которые, взаимодействуя с местной средой, способствуют дифференцировке, пролиферации и регенерации клеток [18, 19]. Вместе с тем тромбоциты как основные компоненты плазмы, богатой тромбоцитами, содержат свыше 1100 различных регуляторных молекул [20]. То есть механизм действия обеспечивается не собственно введенными клетками, а непосредственно содержащимися в них сигнальными эффекторами.
Для регенеративных эффектов структур эндометрия доказано использование другого типа клеток из аутологичной периферической крови – мононуклеаров (МНК), состоящих из Т-, В- и NK-клеток, моноцитов и дендритных клеток. Это направление также расценивают как новую лечебную процедуру, при которой развивается начальное воспаление, необходимое для имплантации. Данная процедура демонстрирует высокую эффективность [21]. Установлено, что введение мононуклеаров периферической крови независимо от стадии эмбриона и типа цикла увеличивает частоту клинической беременности и живорождения у пациенток, перенесших рецидивирующие неудачи имплантации [22]. На данный момент качество доказательств, полученных в рандомизированных клинических исследованиях внутриматочной инфузии МНК, остается умеренным, в то время как для всех остальных видов терапии/вмешательств оно варьируется от низкого до очень низкого [23].
В целом механизм действия любой клеточной терапии включает выработку цитокинов, факторов роста, блокирование антител, пролиферацию B-клеток, снижение активности NK-клеток, увеличение количества Th2 и Treg и уменьшение числа Th1 и Th17 [24] за счет совокупности всех веществ-мессенджеров, выпущенных имплантированными клетками наружу, включая микровезикулы и экзосомы, а также другие важные факторы, растворенные в жидкости.
Обширный арсенал биоактивных молекул, секретируемых клетками, именуют секретомом. Секретом продемонстрировал значительный терапевтический эффект в регенеративной медицине. Изучение терапевтического потенциала секретома позволило исследователям воспроизвести противовоспалительные, проангиогенные и трофические эффекты клеточных технологий без использования самих клеток. В настоящее время секретом считается наиболее предпочтительным для регенеративной медицины по сравнению с традиционной клеточной терапией [25].
Использование бесклеточного секретома позволяет избежать проблем с туморогенностью, иммунореактивностью и неправильной дифференцировкой, связанной с клеточной терапией [26–29]. Более того, доказано, что супернатанты (жидкая фаза, остающаяся после того, как нерастворимые вещества осаждаются в процессе центрифугирования или осаждения), полученные из МНК, незначительно отличаются от секретома стволовых клеток в отношении пролиферации клеток [30].
В настоящее время исследования использования секретома с целью регенерации тканей охватывают большое количество областей медицины – от диабетической стопы до урологической практики, где демонстрируется значительная эффективность [25]. В Европе на основе секретома МНК готовится к выпуску коммерческий препарат [31]. Тем не менее разработка секретомной терапии в мире все еще происходит медленно: крайне необходимы масштабируемые и соответствующие GMP процедуры выделения, информация о терапевтическом механизме действия, дозировках, способах введения и новых рецептурах, способных доставлять растворимые белки неинвазивным способом [32].
К тому моменту, когда в современной литературе секретомную терапию назвали прорывом в регенеративной медицине, а клиническое исследование 2015 г. (ClinicalTrials.gov: NCT02284360) стало первым в мире исследованием регенерации кожи на основе секретома [33], в России уже был разработан и опубликован (1987 г.) метод извлечения секретома из мононуклеаров и его стабилизации. В 2005 г. была опубликована работа, обобщающая клинический опыт комплексного лечения осложненного раневого процесса [34]. Термин «секретом» был введен только в 2004 г. [35]. На момент создания методики в России существовал термин «лимфокины» – биологически активные вещества, синтезируемые и выделяемые всеми популяциями лимфоцитов. С их помощью осуществляются кооперация, координация и регуляция функции клеток [36]. Соответственно метод, а впоследствии и препарат, разрешенный к обращению на территории России, содержащий супернатант лимфокинов (секретома) МНК, был назван Суперлимфом.
Примечательно, что до настоящего времени данный метод имеет самый большой опыт клинического применения (при разных нозологиях). Метод, неоднократно демонстрировавший регенеративный, противовоспалительный и антибактериальный эффекты и отсутствие побочных явлений, подтвержден в более чем 200 научно-клинических работах [37].
Выделяют следующие уровни реализации эффектов: системный, органный, клеточный, субклеточный, рецепторный, биохимический и генетический.
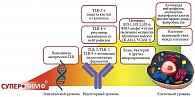
Действие Суперлимфа начинается на рецепторном уровне, а именно с взаимосвязи с Toll-подобными рецепторами (Toll-like receptors, TLR). TLR – сигнальные образ-распознающие рецепторы (pattern-recognition receptors, PRR) врожденной иммунной системы, через которые запускаются гены, ответственные за синтез провоспалительных цитокинов. Система врожденного иммунитета сфокусирована на нескольких высококонсервативных структурах микроорганизмов, которые получили название молекулярных паттернов, ассоциированных с патогеном (patogen-associated molecular patterns, PAMP), а соответствующие им рецепторы – образ-распознающих рецепторов, или PRR [38]. Лекарственный препарат связывается с TLR-2- и TLR-4-, а также TLR-3-, TLR-7-, TLR-9-рецепторами (причем TLR-2 отвечает за защиту клетки от апоптоза, TLR-4 проявляет себя как важный регулятор выживаемости нейтрофилов, а TLR-3, TLR-7, TLR-9 отвечают за активацию лизосомальных ферментов). Эффект Суперлимфа на генетическом уровне заключается в повышении экспрессии TLR. Эта взаимосвязь очень важна, поскольку при хроническом эндометрите первичным звеном в формировании реактивности эндометрия к чужеродным агентам считаются TLR. При активации TLR бактериями, вирусами, простейшими и любыми другими экзогенными и эндогенными факторами запускается каскад последовательных внутриклеточных реакций, инициирующих в ядре транскрипцию генов провоспалительных цитокинов, ИФН и антимикробных пептидов. Так, на фоне применения Суперлимфа при дисплазии шейки матки уменьшается вирусная нагрузка, что обусловлено активацией показателей врожденного иммунитета как в слизистой оболочке цервикального канала, так и во влагалище за счет активации экспрессии генов TLR-2 и TLR-9 (рис. 1) [39].
Реализация эффектов регуляции состояния TLR неоднократно отмечалась в исследованиях у больных хроническим рецидивирующим циститом, при котором значительную роль играет дисбаланс факторов врожденного иммунитета. Наиболее значимыми из них при инфекции мочевыводящих путей являются мембранные рецепторы TLR-2 и TLR-4 и противомикробный пептид бета-дефензин-1 (HBD-1). У пациенток с хроническим бактериальным циститом отмечалось достоверное увеличение экспрессии генов TLR-2 в 6,9 раза, TLR-4 – в 2,6 раза, а также снижение экспрессии гена HBD-1 в 13,6 раза по сравнению со здоровыми женщинами. Соответственно при инстилляции препарата Суперлимф непосредственно в мочевой пузырь спустя шесть месяцев после комбинированной терапии с применением антибиотиков у больных циститом наблюдалась нормализация показателей уровня экспрессии генов TLR-2, TLR-4 и HBD-1 до аналогичных значений в группе здоровых женщин, что позволило сократить количество рецидивов у женщин с хроническим бактериальным циститом [40].
Исследование с использованием препарата в суппозиториях расширило понимание регуляции экспрессии генов TLR. В начале терапии отмечалось увеличение экспрессии гена TLR-2 у женщин, получавших Cуперлимф 25 ЕД, в 4,5 раза (р = 0,08), что свидетельствовало об усиленном распознавании лигандов и активации защитной функции мукозального иммунитета мочеполового тракта. Ближе к завершению курса терапии уровни ФНО-альфа, TLR-2, TLR-4 снижались, что свидетельствовало об уменьшении воспалительной реакции и наступлении фазы реконвалесценции, а следовательно, об иммунорегуляторном действии препарата Суперлимф [41].
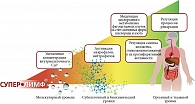
Клеточный уровень реализации эффекта лекарственного препарата характеризуется активацией нейтрофилов, моноцитов, макрофагов (клеток фагоцитарного ряда), фибробластов и усилением взаимодействия между этими клеточными элементами. Развитие молекулярного уровня реализации Суперлимфа заключается в увеличении концентрации внутриклеточных ионов кальция и последующей модуляции кислородного метаболизма фагоцитарных клеток за счет активных форм кислорода и азота, что приводит к активации данных клеток (макрофагов, нейтрофилов). Это отражает биохимический и субклеточный уровни реализации. Например, действие препарата на фибробласты кожи человека, пародонта и роговицы состоит в регуляции синтеза коллагена, гликозаминогликанов и их пролиферативной активности [42, 43], тем более что фибробласты кожи, являющейся самостоятельным эндокринным и иммунным органом, регулируют процессы репарации. Это в свою очередь характеризует тканевой и органный уровни реализации эффектов. Неполноценность первичного звена реагирования, то есть нарушение базовых механизмов врожденного иммунитета, таких как распознавание и фагоцитоз возбудителя, приводит к недостаточной продукции провоспалительных цитокинов и развитию хронической воспалительной реакции. Наличие последнего в высоком цилиндрическом эпителии матки препятствует наступлению беременности. Хронический эндометрит – самостоятельная причина бесплодия у 18,8% женщин и фактор невынашивания беременности у 52,1% пациенток [44–46]. Например, на фоне применения Суперлимфа в комплексном лечении пациенток с хроническим сальпингоофоритом повышается уровень нейтрофильных пептидов лейкоцитов в сыворотке крови, что в свою очередь активирует противомикробную защиту и регулирует механизмы врожденного и адаптивного иммунитета (рис. 2) [47].
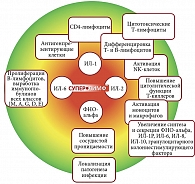
Цитокины (ИЛ-1, ИЛ-2, ИЛ-6, ФНО-альфа) активизируют хемотаксис нейтрофилов, усиливают адгезию гранулоцитов и моноцитов к эндотелию за счет увеличения экспрессии адгезионных молекул, в частности молекул межклеточной адгезии 1-го типа ICAM-1 (intercellular adhesion molecule 1) и молекул адгезии сосудистого эндотелия 1-го типа VCAM-1 (vascular cell adhesion molecule 1), с последующим их выходом из сосудистого русла в очаг повреждения, что приводит к бурной воспалительной реакции и быстрому уничтожению инфекционных агентов, поскольку:
- ИЛ-1 активирует антигенпрезентирующие клетки и CD4-лимфоциты, влияет на дифференцировку Т- и В-лимфоцитов, активирует цитотоксические Т-лимфоциты и NK-клетки, участвует в регуляции продукции других цитокинов;
- ИЛ-2 повышает цитолитическую функцию Т-киллеров и NK-клеток, активирует моноциты и макрофаги, которые повышают синтез и секрецию ФНО-альфа, ИЛ-1-бета, ИЛ-6, ИЛ-8, гранулоцитарного колониестимулирующего фактора;
- ИЛ-6 является кофактором пролиферации В-лимфоцитов и самостоятельным дифференцировочным фактором. Он равномерно стимулирует выработку иммуноглобулинов всех классов;
- лекарственный препарат активирует и контролирует дифференцировку и выживаемость В-лимфоцитов (этот путь активации В-лимфоцитов сопровождается усилением выброса кальция, фосфорилированием некоторых киназ, усилением эндоцитоза, синтеза иммуноглобулинов (M, A, G, D, E) и рассматривается как альтернативный путь активации В-лимфоцитов;
- под влиянием ФНО-альфа местно повышается сосудистая проницаемость, которая направлена на локализацию патогенеза инфекции у входных ворот и характеризуется классическими признаками воспаления (отек, болезненность, покраснение). Системные эффекты связаны с выработкой медиаторов воспаления (ИЛ-1, ИЛ-6, ИФН-гамма) (рис. 3) [46].
Так, применение Суперлимфа у больных хроническим бактериальным простатитом (ХБП)/синдромом хронической тазовой боли воспалительного характера эффективно в 72% случаев. При этом существенно изменяется уровень провоспалительных (ИЛ-6, ИЛ-8) и противовоспалительного (ИЛ-10) цитокинов в эякуляте, что свидетельствует о регуляции механизмов врожденного иммунитета в простате при использовании комплекса цитокинов в лечении больных ХБП [48, 49].
В современных работах показано, что в группе Суперлимфа увеличение активности противовоспалительных цитокинов (ИЛ-4, ИЛ-10, ИЛ-13) и снижение уровня провоспалительных цитокинов (ИЛ-2, ИЛ-12) влияют на более выраженное увеличение подвижности сперматозоидов на 42,3%, снижение уровня MAR-теста на 64,7%, окислительного стресса сперматозоидов на 56,1%, а также фрагментацию ДНК сперматозоидов на 25,6% по сравнению с группой без Суперлимфа [50].
В свою очередь у больных абактериальным хроническим простатитом в ассоциации с герпетической инфекцией Суперлимф демонстрирует хорошие непосредственные и отдаленные результаты, уменьшает выраженность клинических симптомов заболевания в более короткие сроки и положительно влияет на динамику воспалительного процесса [51, 52].
Тенденция к снижению ИЛ-8 отмечается также и в цервикальной слизи при хроническом эндометрите. Положительные значения изучаемого показателя наблюдаются у 100% обследованных. Уровни ИЛ-8 у пациенток, получающих Суперлимф, колеблются в пределах 1588–2100 пг/мл в отличие от первоначальных результатов – 2000–4000 пг/мл. Следовательно, Суперлимф оказывает иммунорегулирующее действие на уровень ИЛ-8, который стимулирует функциональную активность лейкоцитов и макрофагов в очаге инфекции [45, 47, 53].
Экзогенная цитокинотерапия, то есть применение Суперлимфа, при хроническом эндометрите способствует восстановлению процессов ангиогенеза в ткани эндометрия и улучшает показатели ее репродуктивной функции [44]. Эффективность подтверждена в проспективном рандомизированном плацебо-контролируемом ослепленном исследовании, в котором посредством иммуногистохимического изучения биоптатов эндометрия доказано статистически значимое снижение выраженности хронического эндометрита. В частности, добавление локальной цитокинотерапии в адъювантном режиме к противомикробной терапии хронического эндометрита приводило к более высокому удельному весу элиминации микробных агентов из полости матки [54].
В рандомизированном контролируемом исследовании с участием 2252 пациенток самым значимым доказательством иммунологических эффектов на органном маточном уровне в группе Суперлимфа по сравнению с группой без него стало увеличение показателей наступления беременности в 1,5 раза независимо от приема прогестерона. У пациенток с продолжительностью бесплодия пять лет и более частота наступления беременности увеличилась более чем в три раза, риск выкидышей в ранние сроки снизился в 6,3 раза, риск преждевременных родов – в 2,5 раза, риск преэклампсии, гипоксии и задержки роста плода – в два раза [55, 56].
Кроме того, под влиянием экзогенных цитокинов меняется собственный цитокиновый фон тканей, что индуцирует приток в очаг в основном мононуклеарных фагоцитов, в связи с чем воспалительная реакция приобретает локальный и менее выраженный характер. Это определяет системный уровень реализации противовоспалительного эффекта препарата и имеет большое значение при воспалении предстательной железы, когда наиболее выраженные изменения наблюдаются в системе врожденного иммунитета: страдает функциональная активность моноцитов/макрофагов, нейтрофилов, изменяется баланс про- и противовоспалительных цитокинов (рис. 4) [48].
Противовоспалительный компонент лекарственного средства, представленный противомикробными пептидами (протегрины), не позволяет процессу принять гиперергический характер с аутолизом неповрежденных тканей. Протегрины, будучи поверхностно-активными веществами, электростатически связываются с отрицательно заряженными структурами мембраны бактериальной клетки и образуют мультимерные поры, через которые осуществляется выход жизненно важных компонентов микроорганизма (ионов калия, фосфорсодержащих соединений, аминокислот, нуклеотидов, коферментов). В результате происходят подавление дыхания, окислительного фосфорилирования, репликации, транскрипции и синтеза белков, то есть ключевых метаболических процессов микробных клеток, и соответственно их гибель. Так, при воспалительных процессах мочеполовой системы коррекция иммунных нарушений и антибактериальное действие за счет противомикробных пептидов лекарственного препарата позволяют повысить эффективность элиминации патогенов, в том числе адгезированных, в слизистую оболочку урогенитального тракта и нормализовать уровень условно-патогенных возбудителей [41, 57, 58].
Действие Суперлимфа на микобактерии туберкулеза реализуется по крайней мере через два механизма. В случае с чувствительным штаммом Mycobacterium tuberculosis наблюдается прямое антимикобактериальное действие за счет противомикробных пептидов, входящих в состав препарата. В то же время эффект на резистентный штамм M. tuberculosis связан с регуляцией функций макрофагов, фагоцитировавших M. tuberculosis. В данном случае бактерицидная активность фагоцитов стимулируется цитокинами лекарственного препарата, что приводит к усилению выработки ими активных форм кислорода и азота, продукции аутологичных цитокинов и в целом способствует уничтожению внутриклеточных патогенов [59].
Вместе с тем лекарственный препарат оказывает прямое и опосредованное действие за счет цитокинов – активирует выход лизосомальных ферментов лейкоцитов, в частности катепсинов, которые лизируют бактерии и расщепляют захваченные в процессе фагоцитоза чужеродные агенты. Установлено прямое ингибирующее действие препарата на рост Staphylococcus aureus, Escherichia coli, на вирус простого герпеса 1-го и 2-го типов [43, 60].
Cуперлимф демонстрирует и антикандидозную активность в отношении музейных штаммов и клинических изолятов Сandida albicans. Нормоценоз наблюдается у 83% пациентов после семи дней терапии Суперлимфом совместно со стандартным лечением (66% в отсутствие Суперлимфа) и сохраняется у 70% в течение шести месяцев (52% без Суперлимфа).
Применение Суперлимфа в составе комплексной терапии хронического рецидивирующего цервицита позволяет добиться статистически значимых результатов в отношении элиминации вируса папилломы человека высокого онкогенного риска: у 93,02% пациенток рецидивы хронического цервицита в течение года отсутствуют [61, 62].
На фоне цитокинотерапии при дисплазии шейки матки у беременных вирусная нагрузка снижается в 1,2 раза для вируса папилломы человека онкогенного типа группы А9 и в 1,8 раза – для группы А7. Отмечается двукратное увеличение экспрессии ФНО-альфа и десятикратное – НBD-1 и TLR-9 и TLR-2 в цервикальном канале. В эпителии влагалища уровень TLR-9 возрастает в 5,3 раза [44, 63].
Особенностью терапевтического эффекта Суперлимфа является топическая физиологическая регуляция патологического процесса [64]. Физиологичность действия лекарственного препарата выражается в локальной (топической) стимуляции функциональной активности клеток фагоцитарного ряда (моноцитов и нейтрофилов). Препарат активирует фагоцитоз, выработку собственных цитокинов (ИЛ-1, ИЛ-6, ФНО-альфа), индуцирует противоопухолевую цитотоксичность макрофагов, способствует гибели внутриклеточных паразитов, регулирует миграцию клеток в очаг воспаления, не только увеличивает активность естественных киллеров, но и индуцирует выброс противовоспалительных цитокинов (ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-10), осуществляющих хелперную функцию формирования как клеточного, так и гуморального иммунитета. За счет противомикробных пептидов (эндогенных антибиотиков) лекарственный препарат снижает гиперразвитие воспалительных реакций, локализует очаг воспаления, стимулирует регенерацию и эпителизацию раневых дефектов, способствует ангиогенезу.
Эффективность препарата Суперлимф подтверждают результаты европейских исследований секретома, выделенного из мононуклеаров периферической крови. Такие данные получены в доклинических испытаниях на моделях животных и в клинических исследованиях с участием людей [65].
Фармакологические знания расширяются благодаря использованию современных научных методов, подтверждающих, что секретом мононуклеаров периферической крови изменяет сигнатуру транскриптома в сердце, печени и селезенке после экспериментального острого инфаркта миокарда [66], ослабляет активацию тучных клеток и базофилов [67], активирует проангиогенные и антипротеолитические процессы в клетках цельной крови и защищает эндотелиальный барьер [68], подавляет образование нейтрофильных внеклеточных ловушек [69], ослабляет гипертрофическое рубцевание кожи [70].
Заключение
Клиническая фармакология лекарственного препарата Суперлимф, являющегося стимулятором репарации тканей, иммуномодулятором с противомикробной активностью, при фармакотерапии заболеваний урогенитального тракта связана с реализацией его эффектов через рецепторный, генетический, клеточный, молекулярный, биохимический, субклеточный, органный и системный уровни.
T.A. Yushkova, PhD, Ye.V. Slabinskaya, A.A. Yakovlev
Perm State Pharmaceutical Academy
Contact person: Yelizaveta V. Slabinskaya, slabliza@yandex.ru
The article discusses the mechanisms of action of the drug Superlymph in accordance with the level of realization of its effect in diseases of the urogenital tract.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.