Провоспалительные аспекты патогенеза фульминантных постгипоксических изменений головного мозга у доношенных новорожденных, перенесших острую асфиксию в родах
- Аннотация
- Статья
- Ссылки
- English


Одним из самых грозных моментов при развитии острой асфиксии у доношенных новорожденных является формирование стромального мозга – фульминантной деструкции (ФД) мозгового вещества вследствие гипоксически-ишемического поражения, когда структура паренхимы представлена диффузным и обширным кистозным повреждением и выраженными атрофическими изменениями [1, 2]. Известно, что у доношенных этот процесс затрагивает поражение коры головного мозга и подкорковых структур [3–5]. В остром периоде оценить объем поражения при стандартном ультразвуковом исследовании не всегда возможно. Кроме того, есть ряд нерешенных вопросов, касающихся влияния инфекционных механизмов патогенеза при острой гипоксии у доношенных [6]. В связи с актуальностью данной проблемы возникла необходимость проанализировать условия возникновения подобных состояний.
За последние десять лет стандарты оказания помощи новорожденным в родильном зале и отделении реанимации значительно изменились, появились новые методы лечения, направленные на предотвращение патогенетических возможностей возникновения острых тяжелых поражений мозга [7]. Однако по-прежнему фиксируются неоднократные случаи возникновения ФД. Как правило, сопутствующий диагноз – инфекционная патология новорожденного, чаще внутриутробная пневмония, и неблагополучный в инфекционном плане анамнез матери (хориоамнионит, кольпит и др.). Возникает закономерный вопрос, существует ли связь между острой тяжелой асфиксией при рождении и внутриутробным инфицированием? Как эти факторы взаимно влияют на формирование постгипоксических деструктивных процессов в головном мозге в неонатальном периоде?
Одними из актуальных проблем в перинатальной неврологии являются ранняя диагностика и определение прогноза состояния у детей группы риска по развитию тяжелых гипоксических поражений центральной нервной системы (ЦНС) [8, 9]. Симптомы тяжелого повреждения нервной ткани могут проявляться не сразу, а спустя несколько часов и дней после рождения. При этом клиническая картина не всегда коррелирует со степенью тяжести заболевания. В связи с этим прижизненная оценка изменений нервной системы приобретает особую актуальность.
Цель – изучить концентрацию в сыворотке крови молекулы клеточной адгезии ALCAM, уровня маркера апоптоза, DR5, определить концентрацию цитокинов (интерлейкина (ИЛ) 8, ИЛ-4), фактора некроза опухоли (ФНО) альфа, интерферона (ИФН) альфа, ИФН-гамма и выявить их диагностическую значимость у доношенных детей с тяжелой асфиксией при рождении. Исходя из современных представлений, данные цитокины являются одними из основных звеньев патогенеза ишемического поражения головного мозга [10].
Материал и методы
Уровни в сыворотке крови исследуемых цитокинов: DR5, ALCAM, ИЛ-8, ИЛ-4, ФНО-альфа, ИФН-альфа, ИФН-гамма – определяли методом твердофазного иммуноферментного анализа (ИФА). Объектами обследования были пуповинная и периферическая кровь новорожденных в возрасте 24–72 часа жизни. Для определения уровня молекулы клеточной адгезии ALCAM применяли реактивы фирмы R&D (Англия). Пробы крови выполнялись трижды: до 48 часов жизни, на 5–7-е и 12–14-е сутки жизни. Анализ проводился по стандартному протоколу, в соответствии с инструкцией фирмы-производителя.
Статистический анализ результатов исследования выполнен в программе Statistica 10 (StatSoft, США). Количественные показатели оценивались на соответствие нормальному распределению, для чего использовался критерий Шапиро – Уилка. Данные в двух несвязанных группах сравнивали с помощью U-критерия Манна – Уитни. Внутри группы сравнение переменных проводилось знаково-ранговым методом Вилкоксона. Корреляционную зависимость вычисляли с помощью коэффициента ранговой корреляции Спирмена (R).
Всем детям выполняли нейросонографию (НСГ) в динамике с рождения и магнитно-резонансную томографию головного мозга до момента выписки из стационара в период от четырех до шести недель после рождения.
Контрольная группа (n = 60) была представлена здоровыми доношенными новорожденными. Пробы крови у детей контрольной группы забирали при проведении необходимых анализов в стационаре по показаниям (биохимические анализы, общий анализ крови). У новорожденных контрольной группы без поражения ЦНС не выявлено достоверных различий исследуемых антигенов в зависимости от гестационного возраста, а также времени определения.
В основную группу вошли 60 новорожденных (39 мальчиков, 21 девочка) со сроком гестации 38–41 неделя и средним весом при рождении 2732 ± 350 г (M ± SD) (интервал от 2890 до 4630 г). Оценка по шкале Апгар на первой минуте жизни составила в среднем 2,2 ± 0,7 балла (M ± SD) (интервал колебаний от 1 до 3 баллов), на пятой минуте – 5,14 ± 0,6 балла (M ± SD) (интервал от 4 до 7 баллов). Новорожденные основной группы были разделены на подгруппы с учетом внутриутробного инфицирования и его реализации. Первую подгруппу (I) составили 32 ребенка с тяжелой асфиксией при рождении без признаков инфекции, вторую (II) – 28 детей с тяжелой асфиксией и признаками инфекционного заболевания (внутриутробная пневмония, хориоамнионит у матери). В каждой подгруппе выявлялись новорожденные:
- без деструкции вещества головного мозга (А);
- с деструкцией вещества головного мозга (Б).
Дети первой и второй подгрупп были сравнимы по состоянию при рождении, изменениям на НСГ, сопутствующей соматической патологии и нарушениям в неврологическом статусе.
Состояние всех 60 (100%) детей основной группы при первичном осмотре в родильном доме расценивалось как тяжелое. Тяжесть состояния при рождении была обусловлена неврологической симптоматикой, выраженными расстройствами дыхания и гемодинамики на фоне интранатальной гипоксии, морфофункциональной незрелости, внутриутробной гипотрофии 1–2-й степени – 24 (40%) ребенка и 3-й степени – 6 (10%).
Гипоксически-ишемическое поражение ЦНС 3-й степени выявлено у 23 (38,3%) новорожденных, 2-й степени – у 37 (61,7%). На этапе родильного дома у детей этой группы синдром угнетения ЦНС имел место в 59 (98,3%) случаях. 6 (10%) новорожденных находились в коматозном состоянии (кома II и III – по три ребенка). Судорожный синдром диагностирован в 21 (35%) случае. Признаки внутричерепной гипертензии выявлены у 34 (56,6%) детей, двум (3,3%) из них впоследствии из-за острой окклюзии ликворных путей проводили шунтирующие операции. Изменения на НСГ в этой группе характеризовались сочетанными поражениями (внутрижелудочковые кровоизлияния (ВЖК) и перивентрикулярная лейкомаляция (ПВЛ)) – 13 (21,6%) новорожденных, ВЖК 2-й степени – 10 (3,3%), 3-й степени – 8 (16,7%), 4-й степени– 4 (6,7%). ПВЛ диагностирована у 11 (18,3%) новорожденных и без изменений на НСГ – у 14 (23,3%) детей. Смертность детей в данной группе составила 6,7% (четверо новорожденных).
В результате катамнестического исследования в подгруппе детей с тяжелой асфиксией при рождении без признаков инфекции деструкция вещества головного мозга выявлена у 9 (28%). В 72% случаев деструктивных изменений не обнаружено.
В подгруппе новорожденных с тяжелой асфиксией и признаками инфекционного заболевания (внутриутробная пневмония) деструкция вещества головного мозга выявлена в14 (50%) случаях. У 50% пациентов деструктивных изменений не зарегистрировано.
Результаты и обсуждение
Проводилось сравнение уровня концентрации ALCAM в зависимости от состояния детей при рождении, наличия внутриутробного инфицирования, в соответствии с оценкой по шкале Апгар на первой минуте жизни.
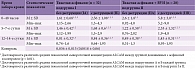
Максимальные показатели концентрации антигена отмечались в первые 48 часов жизни у всех обследованных новорожденных. Однако у детей с тяжелой острой асфиксией и внутриутробным инфицированием концентрация в первой пробе была выше у новорожденных с деструкцией вещества головного мозга – 5,8 ± 3,0 мкг/л, чем у новорожденных той же группы, но без деструктивных изменений вещества головного мозга (подгруппа А) – 2,6 ± 1,8 мкг/л. В подгруппе I эти показатели были практически в два раза ниже в соответствующие сроки сравнения. К 5–7-му дню жизни концентрация ALCAM снизилась до 1,22 ± 0,58 мкг/л в подгруппе IIА и 2,53 ± 1,32 мкг/л в подгруппе IIБ. В подгруппе I, без внутриутробного инфицирования, эти показатели составили 1,68 ± 0,6 и 1,46 ± 0,42 мкг/л соответственно. Необходимо отметить, что концентрация ALCAM оставалась повышенной и к концу второй недели наблюдения у всех новорожденных с острой асфиксией при рождении, максимальные значения отмечались у новорожденных подгруппы IIБ. Все данные достоверно отличались от контрольных значений при сравнении методом Манна – Уитни (табл. 1).
При изучении динамики уровня ALCAM в сыворотке крови у новорожденных с гипоксическим поражением ЦНС выявлено, что пик уровня исследуемого антигена имел место в первые 48 часов жизни, когда на клеточном уровне отмечались активное формирование цитотоксического отека, максимальная активность микроглии и миграция полиморфноядерных лейкоцитов. Эти изменения происходят на фоне нарушения проницаемости гематоэнцефалического барьера и изменений реологических свойств крови. Длительное сохранение воспалительных маркеров, влияющих на микроциркуляцию, у доношенных с острой тяжелой гипоксией при рождении, несомненно, воздействует на обмен в паренхиме мозга и является значимым фактором формирования необратимых структурных изменений.
При исследовании сывороточной концентрации маркера апоптоза DR5 у обследованных отмечалась прямая зависимость показателей проапоптотического фактора от наличия внутриутробного инфицирования (ВУИ), то есть DR5. Максимальные значения маркера апоптоза выявлены у новорожденных с деструктивными изменениями вещества головного мозга подгруппы IIБ (табл. 1). Значения достоверно отличались от контрольных (р < 0,001).
Исследование уровня маркера апоптоза DR5 в сыворотке крови у новорожденных с острой асфиксией подтвердило значимость процессов запрограммированной клеточной смерти в патогенезе постгипоксических изменений в тканях мозга. Зафиксировано повышение исследуемого антигена у всех новорожденных. Максимальные значения при сравнении наблюдались у новорожденных с деструктивными изменениями вещества головного мозга. Эти значения превышали контрольные более чем в 20 раз у новорожденных с ВУИ (табл. 2).
Концентрация ИФН-гамма в контрольной группе составила 1,78 ± 0,37 пг/мл. Выявлено статистически достоверное увеличение концентрации ИФН-гамма при асфиксии (при р < 0,001). В основной группе у новорожденных без признаков инфицирования и деструкции вещества головного мозга (IА) концентрация ИФН-гамма составила 22,5 ± 4,1 пг/мл, у новорожденных без признаков инфицирования с деструкцией вещества головного мозга (IБ) – 29,95 ± 4,81 пг/мл. У новорожденных с признаками инфекционного заболевания без деструкции вещества головного мозга (IIА) и детей с деструкцией вещества головного мозга (IIБ) этот показатель составил 39,15 ± 5,3 и 44,9 ± 6,7 пг/мл соответственно (р < 0,05).
Динамика значений концентрации ИЛ-8 аналогична. Концентрация ИЛ-8 в контрольной группе составила 10,41 ± 2,96 пг/мл. Показатели возрастали при наличии у новорожденных тяжелой асфиксии. У новорожденных без признаков инфицирования и деструкции (1А) концентрация ИЛ-8 достигла 12,13 ± 1,6 пг/мл, у новорожденных без признаков инфицирования с деструкцией вещества головного мозга (1Б) – 14,22 ± 1,8 пг/мл. У новорожденных с тяжелой асфиксией без деструкции вещества головного мозга (IIА) и детей с признаками инфекционного заболевания и деструкцией вещества головного мозга (IIБ) концентрация ИЛ-8 составила 18,1 ± 2,0 и 18,74 ± 2,1 пг/мл соответственно.
Концентрация ИЛ-4 в контрольной группе составила 0,86 ± 0,11 пг/мл. У новорожденных основной группы без признаков инфицирования и деструкции вещества головного мозга (1А) данный показатель составил 5,09 ± 0,6 пг/мл, у новорожденных без признаков инфицирования с деструкцией вещества головного мозга (1Б) – 5,46 ± 1,7 пг/мл. У новорожденных с тяжелой асфиксией и признаками инфекционного заболевания без деструкции вещества головного мозга (IIА) концентрация ИЛ-4 достигла 10,18 ± 3,2 пг/мл, у детей с деструкцией вещества головного мозга (IIБ) – 8,94 ± 2,9 пг/мл.
Концентрация ФНО-альфа в контрольной группе составила 7,18 ± 1,97 пг/мл, у большинства новорожденных основной группы этот показатель был существенно выше. У новорожденных без признаков инфицирования и деструкции вещества головного мозга (1А) концентрация ФНО-альфа достигла 9,9 ± 1,1 пг/мл, у детей без признаков инфицирования с деструкцией вещества головного мозга (1Б) – 12,4 ± 0,9 пг/мл, у новорожденных без деструкции вещества головного мозга (IIА) – 18,9 ± 1,9 пг/мл. У детей с тяжелой асфиксией и признаками инфекционного заболевания с деструкцией вещества головного мозга (IIБ) концентрация ФНО-альфа составила 25,7 ± 1,7 пг/мл. Полученные значения достоверно отличались от контрольных (р < 0,001).
Концентрация ИФН-альфа в контрольной группе составила 4,92 ± 3,24 пг/мл. В основной группе у новорожденных без признаков инфицирования и деструкции вещества головного мозга (1А) этот показатель достиг 10,92 ± 3,24 пг/мл, у новорожденных без признаков инфицирования с деструкцией вещества головного мозга (1Б) – 12,21 ± 4,4 пг/мл, у новорожденных с тяжелой асфиксией и признаками инфекционного заболевания без деструкции вещества головного мозга (IIА) – 19,9 ± 3,4 пг/мл, у детей с деструкцией вещества головного мозга (IIБ) – 22,74 ± 5,24 пг/мл (табл. 3). Выявленные значения достоверно отличались от контрольных (р < 0,01).
Заключение
При выявлении зависимости концентрации исследуемых факторов от состояния при рождении (оценка по шкале Апгар на первой минуте жизни) установлено, что у новорожденных с тяжелой асфиксией и ВУИ в первые сутки жизни уровни DR5 и ALCAM – деструктивных факторов в сыворотке крови достоверно выше, чем у детей с асфиксией без ВУИ. Тяжелая асфиксия приводит к статистически достоверному увеличению концентрации ИФН-альфа, ИФН-гамма и ИЛ-8 (p < 0,01). При тяжелой асфиксии концентрация противовоспалительного цитокина BK-4 возрастает.
Полученные данные свидетельствуют о том, что тяжесть асфиксии в родах – индуктор нарушения баланса в процессе реализации защитных и репаративных механизмов при гипоксии мозга. В условиях изменения целостности гематоэнцефалического барьера нарушения в системе исследуемых факторов присутствуют с первых часов жизни, но наиболее выраженными они становятся уже к 48 часам.
Полученные данные указывают на высокую вероятность повреждения ЦНС у новорожденных с острой асфиксией, но при наличии ВУИ вероятность деструктивных изменений головного мозга значительно возрастает. Это необходимо учитывать как при ведении беременных групп высокого риска, так и при оценке психомоторного развития детей, перенесших асфиксию.
Источник финансирования отсутствует.
Авторы заявляют об отсутствии конфликта интересов.
T.N. Belousova, PhD, G.S. Golosnaya, PhD, Prof., D.A. Holichev, PhD, N.A. Ermolenko, PhD, Prof., O.N. Krasnorutskaya, PhD, Prof.
Vidnovsky Perinatal Center
N.N. Burdenko Voronezh State Medical University
Contact person: Dmitry A. Holichev, holdima1981@yandex.ru
The aim of the work was to study the concentration in blood serum at various degrees of severity of asphyxia in childbirth of markers of CNS lesion. 120 newborns were examined. The children were divided into main (newborns with severe asphyxia) and control groups. As a result of the study, it was revealed that in newborns with severe asphyxia and IUI on the first day of life, the levels of DR5 and ALCAM – destructive factors in the blood serum were significantly higher than in children with asphyxia without intrauterine infection. Severe asphyxia leads to a statistically significant increase in the concentration of IFN-α, IFN-γ and IL-8 (p < 0.01). In severe asphyxia, the concentration of the anti-inflammatory cytokine IL-4 increases. The data obtained indicate that the severity of asphyxia in childbirth is an inducer of imbalance in the process of implementing protective and reparative mechanisms in brain hypoxia. In newborns with acute severe asphyxia, there is a high probability of damage to the central nervous system, but in the presence of IUI, the risk of developing destructive changes in the brain increases significantly. This should be taken into account both when managing pregnant women of high-risk groups, and when assessing the psychomotor development of children who have suffered asphyxia.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.