Клинический опыт применения аналога инсулина ультракороткого действия аспарт (НовоРапид®) – препарата для всех возрастов и периодов жизни
- Аннотация
- Статья
- Ссылки



В настоящее время инсулинотерапия – безальтернативный метод лечения сахарного диабета (СД) 1 типа и широко распространенный метод терапии пациентов с СД 2 типа. Значительный рост числа больных СД за последние 10–15 лет привел к тому, что вопросы инсулинотерапии приобретают важное значение в клинической практике не только эндокринологов, но и врачей общей практики, педиатров, акушеров-гинекологов, кардиологов и хирургов.
Целью создания инсулиновых аналогов было уменьшение побочных эффектов инсулинотерапии, улучшение качества гликемического контроля, а также обеспечение более комфортных условий лечения для пациентов. Одним из самых часто используемых сегодня прандиальных аналогов инсулина является аналог ультракороткого действия аспарт, зарегистрированный в России под коммерческим названием НовоРапид®.
Фармакокинетика инсулина НовоРапид®
Инсулин НовоРапид® – это аналог человеческого инсулина, полученный с помощью рекомбинантной ДНК-технологии путем замены аминокислоты пролин на аспарагиновую кислоту в позиции В28. На рисунке 1 представлена структура молекулы инсулина аспарт. Замена всего одной аминокислоты позволила сохранить структуру молекулы нативного человеческого инсулина на 98%, что практически не изменило антигенные свойства молекулы и способность связываться с инсулиновым рецептором и рецептором инсулиноподобного фактора роста (ИФР-1), но существенно изменило фармакокинетические свойства молекулы.
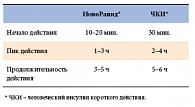
Транспортная форма гексамеров молекул инсулина стала быстрее диссоциировать на мономеры, а значит, быстрее всасываться из подкожно-жировой клетчатки и достигать максимальной концентрации в плазме крови по сравнению с человеческим инсулином. Для данной молекулы характерна более быстрая элиминация из организма по сравнению с человеческим инсулином (ЧИ) (табл. 1).
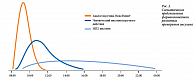
Быстрое нарастание концентрации и активности аналога инсулина максимально близко имитирует фармакокинетические свойства эндогенного инсулина. Пик наивысшей активности этого аналога инсулина совпадает с пиком постпрандиальной глюкозы. Все это позволяет делать инъекцию препарата за 0–5 минут перед едой или даже сразу после еды, исчезает необходимость в тридцатиминутном интервале между инъекцией инсулина и приемом пищи.
А более активная элиминация инсулинового аналога аспарт в сравнении с человеческим растворимым инсулином позволяет пациенту отказаться от дополнительных приемов пищи. Это свойство инсулинового аналога НовоРапид® предоставляет пациенту большую свободу в диете и образе жизни (рис. 2). Как следствие – значительное снижение риска гипогликемий в сравнении с ЧИ короткого действия, при этом более значительное снижение постпрандиальной гликемии.
Молекулярная безопасность
Важным аспектом безопасности инсулиновых аналогов является аффинность к рецептору инсулиноподобного фактора роста (ИФР-1), к инсулиновому рецептору, а также скорость диссоциации с инсулиновым рецептором. При сравнении с человеческим инсулином инсулин аспарт имеет более быструю диссоциацию с инсулиновым рецептором и меньшее сродство к рецептору ИФР-1, а значит, меньший митогенный потенциал, что определяет его абсолютную молекулярную безопасность (табл. 2) [1].
Применение инсулинового аналога НовоРапид® при СД 1 типа
Классическим подходом к терапии СД 1 типа является базисно-болюсный интенсивный режим инсулинотерапии. Эффективность этого режима в виде снижения частоты осложнений, связанных с диабетом, на 60–76%, а смертности – на 57% доказана в 17-летнем исследовании DCCT/EDIC (Diabetes Control and Complication Trial/Epidemiology of Diabetic Complications) [2]. Появление в клинической практике инсулиновых аналогов позволило достигать более жестких критериев гликемического контроля (HbA1c < 7%) с минимизацией риска гипогликемий [3]. Десятилетний опыт применения инсулина НовоРапид® при СД 1 типа, подтвержденный многочисленными исследованиями, доказал преимущества этого ультракороткого инсулинового аналога в сравнении с ЧИ короткого действия.
Преимущества инсулина НовоРапид® показаны в целом ряде контролируемых проспективных исследований. НовоРапид® обеспечивает лучший постпрандиальный контроль в течение 4 часов после приема пищи в сравнении с человеческим инсулином короткого действия. Уровень постпрандиальной гликемии на 22–38% ниже у пациентов на инсулине НовоРапид®, чем на ЧИ короткого действия. Как упоминалось выше, фармакодинамические свойства инсулина НовоРапид® позволяют вводить его как за 0–5 минут до еды, так и сразу после еды, сохраняя хороший гликемический контроль, что также было продемонстрировано в ходе клинических исследований [4, 5].
Лучший постпрандиальный контроль обеспечивает лучший долгосрочный гликемический контроль в целом. Динамика уровня HbA1c при переводе с ЧИ короткого действия на инсулин НовоРапид® составляет в среднем около 0,6% [6]. Немаловажным является также снижение риска гипогликемических эпизодов, в особенности частоты ночных гипогликемий. Данный результат был получен в двойном слепом перекрестном сравнительном исследовании ЧИ короткого действия и инсулина НовоРапид® [7]. Доказана клиническая эффективность инсулина НовоРапид® для лечения кетоацидоза в условиях стационара.
Скорость снижения гликемии и изменения параметров кислотно-щелочного состояния достоверно не различались между группами терапии ЧИ короткого действия и инсулином НовоРапид®. Не было получено достоверной разницы в длительности госпитализации и общей дозе инсулина до разрешения кетоацидоза. В 2008 г. Европейское агентство по лекарственным средствам (EMA – European Medicines Agency) одобрило применение инсулина НовоРапид® для внутривенного введения при лечении кетоацидоза [8]. Есть указание на применение инсулина НовоРапид® для внутривенного введения и в российской инструкции по применению препарата [9].
Применение инсулина НовоРапид® в помпе
Альтернативным способом введения инсулина при использовании режима многократных инъекций у пациентов с СД 1 типа может быть непрерывная подкожная инфузия инсулина (НПИИ). Первая система для НПИИ была разработана в 1976 г. Тогда использование данного способа доставки инсулина было ориентировано на пациентов, страдающих от тяжелых эпизодов гипогликемии, и пациентов с феноменом «утренней зари». В последние 15 лет терапия сахарного диабета с помощью инсулиновой помпы получила большое распространение. Во многом этому способствовало внедрение в клиническую практику аналогов инсулина ультракороткого действия, фармакодинамический профиль действия которых оказался близким внутривенному введению инсулина.
Недавние исследования показали, что инсулин НовоРапид® более совместим с инсулиновыми помпами, чем другие аналоги инсулина ультракороткого действия (инсулины лизпро и глулизин) [10, 11]. В многочисленных сравнительных исследованиях инсулин аспарт (НовоРапид®) в режиме НПИИ продемонстрировал более высокую скорость всасывания [10], более высокий процент достижения пациентами возрастных целевых значений HbА1с [12], лучшую стабильность постпрандиального гликемического контроля [13] и меньший риск развития гипогликемии, в том числе ночных эпизодов гипогликемии [14].
В исследованиях in vitro применение инсулина аспарт в помпе показало более высокую устойчивость этого аналога инсулина изоэлектрической преципитации [15, 16], а также более низкую частоту окклюзии катетера [17] по сравнению с другими аналогами инсулина ультракороткого действия. Так, по данным недавно опубликованных исследований, вероятность возникновения окклюзии при использовании инсулина НовоРапид® в режиме НПИИ не превышает 10%, тогда как риск окклюзии при использовании инсулина глулизин и инсулина лизпро составляет 41% и 16% соответственно [17].
Кроме того, последние исследования показали, что инсулин аспарт может длительно находиться в контейнере (до 6 суток), сохраняя свою физическую и химическую стабильность [11]. Таким образом, данные многочисленных исследований убедительно продемонстрировали, что при окончательном решении вопроса о выборе инсулина для использования в помпе следует учитывать: инсулин НовоРапид® имеет преимущества по сравнению как с ЧИ короткого действия, так и с другими аналогами инсулина ультракороткого действия, что обусловлено фармакокинетическими особенностями этого аналога инсулина, а также его высокой физико-химической стабильностью.
Применение инсулина НовоРапид® у детей и подростков
Лечение СД 1 типа в детском и подростковом возрасте имеет ряд особенностей, требует повышенного внимания и значительно отличается от терапии взрослых пациентов. Особенности режима сна и пищевого поведения, непредсказуемая двигательная активность, высокая чувствительность к инсулину, частые инфекционные заболевания, ограниченные места для инъекций у маленьких детей, необходимость активного участия родителей в процессе лечения и др. определяют высокие требования к применяемым препаратам инсулина.
Инсулиновые аналоги короткого действия, воссоздавая физиологический профиль инсулинемии, позволяют получить целый ряд преимуществ в терапии СД 1 типа у детей и подростков. Например, это возможность инъекции инсулина после приема пищи. Подбор дозы у многих детей, особенно в первые годы жизни, при препрандиальном введении инсулина затруднен в связи с непредсказуемым пищевым поведением.
В мультицентровом открытом перекрестном 12-недельном исследовании, в котором участвовало 26 детей в возрасте от 2,3 до 6,9 лет, сравнивалась эффективность и безопасность препрандиального введения человеческого инсулина короткого действия и постпрандиального введения инсулина НовоРапид®. Уровень HbA1c, равный 7,7%, сохранялся на протяжении всего исследования в обеих группах инсулинотерапии. Гликемический контроль при постпрандиальном введении инсулина НовоРапид® был аналогичным таковому при препрандиальном введении ЧИ короткого действия. Не было выявлено различий в общей частоте гипогликемий и в частоте тяжелых гипогликемических эпизодов. Вместе с этим большинство родителей отметили удобство и отдали предпочтение терапии инсулином аспарт, а также высказали желание продолжить терапию и дальше [18].
Таким образом, фармакокинетический профиль инсулина НовоРапид® у детей и подростков позволяет гибко адаптировать лечение к особенностям пищевого поведения. Действительно, клинические исследования у детей и подростков показывают эффективность и удобство постпрандиального введения инсулина аспарт, особенно в сравнении с простым человеческим инсулином. Постпрандиальное введение инсулина НовоРапид® в сравнении с препрандиальным введением простого инсулина было исследовано у детей раннего возраста – от 2 до 6 лет. Результаты исследования свидетельствуют о сходном метаболическом контроле, однако родители пациентов отдают предпочтение инсулину аспарт [18].
С марта 2005 г. инсулин НовоРапид® разрешен к применению у детей в возрасте с 2 лет [8, 9]. При решении вопроса о пре- или постпрандиальном введении инсулиновых аналогов короткого действия можно учитывать пищевые привычки пациентов, прием пищи в общественных местах или дома, предпочтения пациентов. В ходе открытого перекрестного 6-недельного исследования у 76 детей (в возрасте от 6 до 17 лет) в 9 европейских центрах гликемический контроль при постпрандиальном введении инсулина НовоРапид® был аналогичным таковому при препрандиальных инъекциях. Не было выявлено различий в общей частоте гипогликемий и в частоте тяжелых гипогликемических эпизодов [19]. У большинства пациентов доза инсулина короткого действия при переходе с простого человеческого инсулина на инсулин аспарт сопоставима. Коррекция дозы, как правило, требуется при необходимости улучшения гликемических показателей. В зависимости от уровня препрандиальной гликемии инсулин аспарт вводится либо непосредственно перед едой, либо не более чем за 15 минут до еды. При низких показателях гликемии, а также у маленьких детей, когда заранее неизвестно, какое количество углеводов съест ребенок и сколько времени будет затрачено на прием пищи, инсулин НовоРапид® вводится после еды.
В подростковом возрасте главное преимущество коротко действующих инсулиновых аналогов, кроме возможности вводить непосредственно перед едой, заключается в том, что нет необходимости больших перекусов (для данной возрастной категории это удобно). С другой стороны, при дополнительном приеме пищи, содержащей более 2 хлебных единиц, инъекция коротко действующих аналогов позволяет исключить постпрандиальную гипергликемию без риска развития последующей гипогликемии (спустя 2–3 часа после инъекции). Особенно это актуально в поздние вечерние часы. Обычно такая потребность возникает в старшей возрастной группе подростков в связи с дополнительными занятиями на курсах, работой либо встречей с друзьями в вечерние и ночные часы.
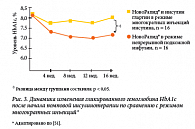
Элизабет Дойл (Elizabeth A. Doyle) и соавт. из Йельского университета докладывали о своем клиническом опыте использования инсулина аспарт в режиме непрерывной подкожной инфузии инсулина с использованием помпы по сравнению с применением инсулинов аспарт и гларгин в режиме многократных инъекций у детей и подростков с СД 1 типа [51]. Было отмечено статистически достоверное более значимое снижение уровня HbA1c с 8,2% до 7,3% в процессе проведения терапии в группе помповой терапии по сравнению с режимом многократных инъекций (рис. 3).
Институтом детской эндокринологии ФГУ ЭНЦ накоплен 6-летний опыт клинического использования инсулиновых помп (боле 170 пациентов с СД 1 типа в возрасте от 1,5 до 22 лет). Эффективность помповой инсулинотерапии у детей и подростков по сравнению с режимом множественных ежедневных инъекций изучена в двух группах пациентов с СД 1 типа в возрасте 5–22 лет (12,8 ± 5,4) и длительностью заболевания 3–14 лет (6,2 ± 2,9), группы не различались по возрасту, длительности заболевания и исходному уровню гликированного гемоглобина HbA1c. Первая группа получала непрерывную помповую инсулинотерапию (НПИИ) (n = 31), вторая группа – множественные инъекции инсулина (МИН) (n = 30).
Использовался аналог инсулина ультракороткого действия НовоРапид®. В группе MИН в качестве базального инсулина применялся аналог гларгин перед сном. Уровень HbA1c в группе МИН до начала терапии составлял 9,8 ± 2,0%, через 12, 24, 36, 48 месяцев – 9,1 ± 1,8%, 8,9 ± 2,6%, 9,2 ± 1,5%, 9,1 ± 1,6% соответственно. В группе НПИИ уровень HbA1c до начала терапии составлял 9,9 ± 1,77%, через 12, 24, 36, 48 месяцев – 8,9 ± 1,29% (p < 0,05), 9,2 ± 2,3%, 8,9 ± 1,94%, 8,9 ± 1,8% соответственно. Диабетический кетоацидоз имел место у двух пациентов в группе НПИИ вследствие окклюзии катетера и у двух пациентов в группе MИН вследствие вирусной инфекции. Проведенные нерандомизированные и рандомизированные исследования продемонстрировали эффективность и безопасность инсулина НовоРапид® при лечении СД 1 типа у детей и подростков как в качестве отличного прандиального регулятора, вводимого после еды при базисно-болюсной терапии, так и при использовании в инсулиновой помпе.
Интенсификация инсулинотерапии СД 2 типа с помощью инсулина НовоРапид®
Неуклонное снижение функции бета-клеток является важным патогенетическим аспектом сахарного диабета 2 типа, определяющим необходимость инсулинотерапии. Согласно современным рекомендациям ADA, EASD, AACE/ACE, а также Российским клиническим рекомендациям по оптимизации и интенсификации инсулинотерапии при СД 2 типа, в случае неэффективности изменения образа жизни и монотерапии метформином следующим этапом лечения может быть инсулинотерапия. Назначение базального инсулина в сочетании с метформином, двухфазного инсулинового аналога либо назначение многократных инъекций в виде болюсной и базисно-болюсной терапии – вопрос выбора врача и пациента. Основанием для выбора служит степень декомпенсации углеводного обмена, превалирование тех или иных вариантов нарушения гликемического контроля (гипергликемия преимущественно натощак, постпрандиальная гипергликемия или оба варианта), образ жизни пациента, его способность и возможности выполнять рекомендации.
При выборе режима инсулинотерапии также имеет значение собственный опыт врача по применению того или иного инсулина или схемы терапии [20, 21]. Истощение бета-клетки секретагогами происходит в течение относительно короткого периода времени, исчисляемого несколькими годами, что определяет необходимость назначения инсулинотерапии. Как показало 3-летнее исследование «4Т», старт инсулинотерапии при неэффективности таблетированных препаратов может осуществляться привычным назначением базального или двухфазного инсулиновых аналогов или прандиальной регуляцией гликемии с использованием ультракороткого аналога НовоРапид® [22]. Все три варианта старта инсулинотерапии эффективны с точки зрения снижения уровня гликированного гемоглобина. Однако в группе пациентов, применявших трехинъекционный прандиальный режим терапии инсулином НовоРапид®, снижение уровня НbА1с было наиболее значимым и достигло 1,4%. Необходимо также отметить, что именно в данной группе у наибольшего числа пациентов удалось достичь целевого параметра НbА1с ниже 7%.
Единственным недостатком данного варианта старта инсулинотерапии было несколько большее увеличение массы тела в сравнении с традиционными подходами, что ограничивает данный старт инсулинотерапии у пациентов с выраженной избыточной массой тела. Через год после начала исследования стало очевидным, что дальнейшее улучшение контроля диабета возможно только при интенсификации режима инсулинотерапии, что и было сделано во всех трех группах. При добавлении базального инсулинового аналога в качестве интенсификации инсулинотерапии было получено дополнительное снижение HbA1c на 0,4%. Число больных, достигших целевого уровня HbA1c менее 7%, было больше, чем в двух других группах, при минимальном числе гипогликемий. Сторонники старта инсулинотерапии при СД 2 типа с введения ультракороткого аналога перед максимальным либо каждым приемом пищи считают: в сравнении с базальной инсулинотерапией данный подход имеет ряд преимуществ:
- более выраженное снижение постпрандиальной гликемии;
- эффективное подавление глюконеогенеза в печени и, как следствие, уменьшение дозы препарата;
- снижение риска гипогликемий вследствие возможности постпрандиального введения;
- снижение инсулинорезистентности, подавление окислительного стресса и защита бета-клетки от апоптоза;
- улучшение сосудистой функции и снижение риска макрососудистых осложнений [23].
Данная схема старта инсулинотерапии не столь широко распространена в России, однако представляется целесообразным обсудить ее применение у пациентов с высоким уровнем постпрандиальной гликемии при относительно хорошей гликемии натощак на фоне приема метформина, а также у пациентов с активным образом жизни и нерегулярным питанием. В настоящее время наибольшей популярностью пользуется вариант интенсификации инсулинотерапии путем добавления прандиального инсулина к базальному. Эффективность этой схемы подтверждена многочисленными исследованиями и клиническим опытом эндокринологов. Добавление к базальному инсулину прандиального инсулинового аналога НовоРапид® позволяет улучшить контроль гликемии, дополнительно снижая уровень HbA1c на 0,5–1,2% [22, 24, 25], и позволяет достичь компенсации углеводного обмена (HbA1c ≤ 7%) более чем у 60% пациентов [22].
При этом в исследовании «4Т» был отмечен минимальный риск тяжелых и легких гипогликемий. Этот показатель составил 1,7 эпизода/пациента в год. В ряде европейских стран, а также США проведен фармакоэкономический анализ эффективности инсулина аспарт в базисно-болюсном режиме на основании данных исследования PREDICTIVETM. Анализ показал увеличение ожидаемой продолжительности качественной жизни и уменьшение случаев осложнений сахарного диабета при использовании инсулина аспарт в сравнении с человеческим инсулином. Как следствие – снижаются затраты на лечение пациентов [26].
Использование инсулина НовоРапид® у пожилых пациентов
Около 6% взрослого населения планеты страдают СД 2 типа, средний возраст больных СД 2 типа в России составляет 61 год. В связи с увеличением продолжительности жизни число людей пожилого возраста с этим заболеванием становится все больше, особенно в развитых странах мира. Клиническая симптоматика СД у пожилых людей настолько нетипична, что длительное время заболевание остается нераспознанным. Течение заболевания усугубляется психологическими и когнитивными нарушениями, а также сопутствующими заболеваниями, необходимостью приема многочисленных препаратов. Лечение пожилых людей с СД 2 типа имеет существенные отличия от классических подходов, применяемых в более молодом возрасте. Связано это, главным образом, с высоким риском развития макрососудистых осложнений. При выборе вида и целей лечения учитывается соотношение преимущества/риск. При этом оценивается риск развития гипогликемий, сопутствующая патология, возможность самостоятельного выполнения рекомендаций и ожидаемая продолжительность жизни.
При длительном течении СД и истощении функции бета-клетки только изменение образа жизни, соблюдение диеты и прием таблетированных сахароснижающих препаратов не позволяют достичь желаемого гликемического контроля, который у пожилых людей может быть менее жестким, чем рекомендуемый различными руководствами для популяции в целом, и составлять по уровню HbA1c до 7,5% [27]. Выбор инсулинотерапии у пожилых пациентов определяется не только способностью снижать уровень гликемии, но и минимизацией риска гипогликемий, представляющих особую опасность для данной категории пациентов. Особый интерес в связи с этим вызывает инсулиновый аналог НовоРапид®, быстрое начало и ультракороткое действие которого позволяет вводить его не только традиционно перед едой, но и во время еды или непосредственно после еды, что повышает комплаентность пациентов и исключает развитие гипогликемии вследствие превышения дозы относительно съеденных углеводов. Как следствие – минимальное увеличение веса и высокая удовлетворенность пациентов проводимым лечением [28].
При проведении двойного слепого плацебоконтролируемого перекрестного исследования с участием 19 пациентов с СД 2 типа в возрасте 70 лет с применением эугликемического клэмпа с инсулином НовоРапид® и человеческим инсулином короткого действия в дозе 0,3 Ед/кг были показаны фармакокинетические и фармакодинамические преимущества инсулина НовоРапид®. Данное исследование подтвердило более быстрое начало и меньшую продолжительность действия инсулина НовоРапид® в сравнении с ЧИ короткого действия у пожилых пациентов. Полученные результаты подтверждают возможность введения инсулина НовоРапид® непосредственно после еды у пожилых пациентов [29]. Основываясь на результатах клинических исследований, подтверждающих высокую эффективность и безопасность инсулина НовоРапид® у пожилых людей, в 2007 г. препарат был одобрен в Европе для лечения этой категории больных с СД 2 типа [30].
Применение инсулина НовоРапид® во время беременности
По данным американских исследователей, около 4% всех случаев беременности в США осложняются нарушениями углеводного обмена. Из них у 12% женщин диабет диагностируется еще до беременности, а у 88% заболевание возникает непосредственно на фоне беременности. Беременность, протекающая на фоне СД любого типа, ассоциируется с высоким риском развития различных осложнений как для самой беременной (самопроизвольный аборт, гестоз, артериальная гипертензия, пиелонефрит, многоводие, преждевременные роды, аномалии родовой деятельности, родовой травматизм, послеродовые осложнения, прогрессирование поздних осложнений СД) [31, 32, 33, 34, 35], так и для плода (эмбрио- и фетопатия, проявляющиеся врожденными пороками развития; хроническая гипоксия с последующими нарушениями функции ЦНС; макросомия; гипогликемия новорожденных; гибель плода) [33, 36, 37, 38], причиной которых является гипергликемия у матери.
Во избежание всех вышеперечисленных опасных, а иногда несовместимых с жизнью осложнений необходимо поддерживать идеальный гликемический контроль в течение всей беременности, а также до зачатия, поскольку врожденные пороки развития формируются в процессе органогенеза, то есть до 8-й недели беременности. Целью лечения беременных с СД является достижение и поддержание уровня гликемии, соответствующего показателям при физиологической беременности (табл. 3), обеспечение акетонурии и отсутствия симптоматической гипогликемии [39–41].
В идеале рекомендуется достичь и поддерживать уровень HbA1c < 6,5% (или < 7,0%, если женщина получает инсулинотерапию), при условии безопасного достижения такого контроля (IDF рекомендует уровень HbA1c < 6,0%) [39, 41]. Достижение компенсации СД до зачатия и на протяжении всей беременности резко снижает опасность любых неблагоприятных последствий этого заболевания как для матери, так и для плода, а большинству женщин позволяет их вообще избежать [41]. Для достижения при беременности стабильной целевой гликемии в течение всех суток необходимо постоянно поддерживать такой уровень инсулинемии, который сможет обеспечить близкую к норме базальную, пре- и постпрандиальную гликемию. Однако во время беременности это не так-то просто.
Важнейшим препятствием к достижению целевой гликемии во время беременности является кардинально отличный от физиологического путь поступления экзогенного инсулина в организм. При инъекционном введении человеческого короткодействующего инсулина невозможно обеспечить необходимую инсулинемию в печени для полноценной утилизации принятых с пищей углеводов. Следовательно, каждый прием пищи, особенно углеводистой, сопровождается более или менее выраженной постпрандиальной гипергликемией, подъем которой зависит от количества принятых углеводов и их гликемического индекса. Дальнейшая утилизация постпрандиальной глюкозы происходит в периферических тканях, а в печени не образуется должное количество гликогена, что в дальнейшем является причиной спонтанных гипогликемий, хронического глюконеогенеза и кетогенеза.
Другими причинами, затрудняющими достижение стабильной целевой гликемии, является несоответствие физиологическому ритму времени начала, пика и окончания действия инсулиновых препаратов, а также межиндивидуальная вариабельность и интравариабельность действия введенного инсулина, обусловленная различным временем его абсорбции из мест инъекций. Именно последнее обстоятельство нередко является причиной непрогнозируемых гипогликемий, которые опасны не только для матери, но и для ребенка, так как могут вызвать внутриутробную задержку развития плода. А частые, даже самые легкие, гипогликемии сопровождаются рикошетной длительной гипергликемией и являются причиной развития многоводия, отечного синдрома и макросомии плода. Это значит, что одним из условий успешного исхода беременности при СД является подбор оптимальной инсулинотерапии, сводящей к минимуму постпрандиальный прирост гликемии, вариабельность гликемии в течение суток, а также риск развития не только тяжелых, но и легких гипогликемий.
Особенности моторики ЖКТ во время беременности усугубляют несовершенство фармакокинетики и фармакодинамики препрандиальных препаратов человеческого инсулина и еще больше затрудняют достижение целевой гликемии после приема пищи. Так, пик действия человеческого короткого инсулина (ЧКИ) обычно наступает через 2–3 часа после его введения, тогда как у беременных самая высокая постпрандиальная гликемия регистрируется уже через 70–90 минут после приема пищи [42, 43]. Введение больших доз ЧКИ перед едой может привести к резкому снижению гликемии через 3–4 часа после приема пищи. Следовательно, во избежание гипогликемии в эти часы требуется дополнительный прием пищи, который может спровоцировать гипергликемию перед следующим приемом пищи, а также способствовать нежелательной прибавке в весе.
Кроме того, ЧКИ необходимо вводить за 20–30 минут, а во II и III триместрах – за 40–60 минут до приема пищи, что создает дополнительные неудобства для беременной и снижает качество ее жизни. Несовершенство фармакокинетики и фармакодинамики практически всех современных человеческих инсулиновых препаратов, особенно проявляющееся во время беременности, является объективной причиной значительной вариабельности гликемии. В настоящее время именно вариабельность гликемии, а особенно постпрандиальной, считается основной причиной развития макросомии плода и связанных с ней осложнений [44].Учитывая вышеизложенное, очевидно, что использование во время беременности аналогов инсулина ультракороткого действия имеет неоспоримые преимущества перед ЧКИ.
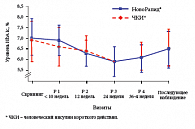
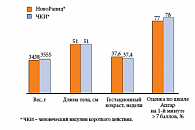
Инсулин НовоРапид® является первым аналогом инсулина ультракороткого действия, официально рекомендованным к применению у беременных женщин с гестационным и сахарным диабетом (в 2006 г. – в Европе, в 2007 г. – в США, в марте 2008 г. – в России). Безопасность и эффективность инсулина НовоРапид® подтверждена результатами многоцентрового (63 центра, 18 стран мира, в том числе Россия) рандомизированного контролируемого клинического исследования с участием 322 беременных женщин с СД 1 типа [45, 46]. Прежде всего, результаты исследования доказали, что сахаро-снижающая эффективность инсулина НовоРапид® аналогична ЧКИ (рис. 4). При этом около 80% женщин, получавших терапию инсулином НовоРапид®, достигли целевого уровня HbA1c < 6,5% [45].
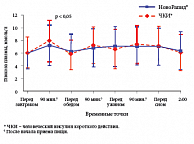
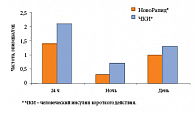
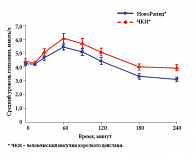
В отличие от ЧКИ, инсулин НовоРапид® можно вводить непосредственно перед приемом пищи, а при необходимости (ранний токсикоз беременных) – и после еды. Максимальное действие инсулина НовоРапид® приходится именно на пик постпрандиальной гипергликемии при беременности (70–90 минут от начала приема пищи), что, безусловно, эффективнее снижает постпрандиальную гликемию (рис. 5), прогностическое влияние которой на риск развития нежелательных исходов у плода более выражено, чем гипергликемии натощак. Меньшая продолжительность действия инсулина НовоРапид® позволяет снизить риск гипогликемии через 3–4 часа после приема пищи, а также риск ночных гипогликемий, особенно в I триместре беременности, когда из-за снижения глюконеогенеза сокращается потребность в инсулине. Так, риск тяжелых гипогликемий у беременных женщин, получавших терапию инсулином НовоРапид®, был на 28%, а риск тяжелых ночных гипогликемий – на 52% меньше, чем при терапии ЧКИ (рис. 6).
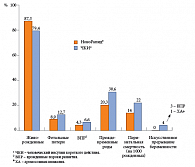
Данное сравнительное клиническое исследование безопасности и эффективности инсулина НовоРапид® и ЧКИ при лечении беременных женщин с СД 1 типа не выявило никакого неблагоприятного воздействия инсулина НовоРапид® на течение беременности (рис. 7) или здоровье плода и новорожденного (рис. 8). Так, терапия инсулином НовоРапид® привела к значимому увеличению числа живорожденных по сравнению с человеческим инсулином [46, 47]. Дополнительное клиническое исследование 27 пациенток с гестационным сахарным диабетом, получавших инсулин НовоРапид® (14 женщин) или ЧКИ (13 женщин), свидетельствует о сопоставимой безопасности и большей эффективности этого ЧКИ для коррекции постпрандиальной гликемии (рис. 9) [48].
Таким образом, применение аналога инсулина ультракороткого действия НовоРапид® для лечения нарушений углеводного обмена во время беременности по эффективности достижения гликемического контроля является достойной альтернативой терапии человеческим инсулином короткого действия (как в составе базисно-болюсной терапии, так и в помповой терапии). При этом аналог инсулина НовоРапид® имеет некоторые преимущества в отношении улучшения простпрандиального контроля гликемии, а также улучшенный профиль безопасности по сравнению с человеческим инсулином. А использование инсулина НовоРапид® в виде продленной подкожной инфузии инсулина является в прямом смысле «золотым стандартом» коррекции углеводного обмена у беременных с СД [49].
За 10 лет применения инсулиновый аналог ультракороткого действия НовоРапид® зарекомендовал себя как эффективный и безопасный препарат, что подтверждено многочисленными рандомизированными и нерандомизированными клиническими исследованиями. Инсулин НовоРапид® может применяться в разных возрастных группах на любом этапе жизни больного с сахарным диабетом 1 и 2 типов, обеспечивая максимальный контроль, не увеличивая риск развития побочных явлений.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.