Позиция экспертов по оптимизации персонифицированного подхода к ведению пациентов с сахарным диабетом 2 типа с использованием ингибиторов натрий-глюкозного котранспортера 2 с учетом опыта российских регионов
- Аннотация
- Статья
- Ссылки
Эксперты: Н.А. Петунина, член-корреспондент РАН, д.м.н., профессор, заведующая кафедрой эндокринологии ИКМ им. Н.В. Склифосовского ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, главный внештатный специалист-эндокринолог Минздрава России по Центральному федеральному округу, А.М. Мкртумян, д.м.н., профессор, заведующий кафедрой эндокринологии и диабетологии лечебного факультета и ФПДО ФГБОУ ВО «Российский университет медицины» Минздрава России, Т.П. Бардымова, д.м.н., профессор, заведующая кафедрой эндокринологии Иркутской государственной медицинской академии последипломного образования – филиала ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, главный внештатный специалист-эндокринолог Минздрава Иркутской области, И.А. Бондарь, д.м.н., профессор, заведующая кафедрой эндокринологии лечебного факультета ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, главный внештатный специалист-эндокринолог Минздрава России в Сибирском федеральном округе, Ф.В. Валеева, д.м.н., профессор, заведующая кафедрой эндокринологии ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России, заслуженный врач Республики Татарстан, главный внештатный эндокринолог Минздрава России по Приволжскому федеральному округу, И.Ю. Добрынина, д.м.н., профессор кафедры внутренних болезней Медицинского института БУ ВО «Сургутский государственный университет», главный внештатный эндокринолог Департамента здравоохранения Ханты-Мансийского автономного округа – Югры, С.А. Догадин, д.м.н., профессор кафедры госпитальной терапии и иммунологии с курсом ПО ФГБОУ ВО «Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого» Минздрава России, главный внештатный специалист-эндокринолог Минздрава Красноярского края, И.В. Мисникова, д.м.н., профессор кафедры эндокринологии ФУВ, ведущий научный сотрудник отделения терапевтической эндокринологии ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», главный эндокринолог Московской области, Л.А. Суплотова, д.м.н., профессор кафедры терапии с курсами эндокринологии, функциональной и ультразвуковой диагностики Института клинической медицины ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, главный внештатный эндокринолог Департамента здравоохранения Тюменской области, Л.А. Руяткина, д.м.н., профессор кафедры неотложной терапии с эндокринологией и профпатологией факультета повышения квалификации и профессиональной переподготовки врачей ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Л.Г. Стронгин, д.м.н., профессор кафедры эндокринологии и внутренних болезней, директор Института терапии ФГБОУ ВО «Приволжский исследовательский медицинский университет» Минздрава России, Л.Т. Бареева, главный внештатный специалист-эндокринолог Минздрава Республики Татарстан, Л.Н. Боева, к.м.н., заведующая отделением амбулаторной эндокринологической помощи КГБУЗ «Краевая клиническая больница», О.И. Горощеня, заведующая отделением эндокринологии БУЗ «Омская городская поликлиника № 13», А.М. Итинсон, главный внештатный эндокринолог Минздрава Курской области, М.В. Кочергина, к.м.н., главный внештатный эндокринолог Минздрава Свердловской области, Е.В. Князькина, главный внештатный специалист-эндокринолог Минздрава Пензенской области, Т.Г. Медина, к.м.н., ГБУЗ ПК «Ордена „Знак Почета“ Пермская краевая клиническая больница», главный внештатный эндокринолог Минздрава Пермского края, А.Д. Насыртдинова, главный внештатный специалист-эндокринолог Минздрава Республики Башкортостан, С.А. Прилепа, главный эндокринолог Тульской области, Л.Ю. Радионова, главный внештатный специалист-эндокринолог Минздрава Омской области, Л.А. Скакун, главный внештатный эндокринолог Управления здравоохранения администрации Челябинска, Л.В. Твердова, главный эндокринолог Рязанской области, А.В. Тюгаева, главный внештатный эндокринолог Минздрава Саратовской области, В.Л. Тюльганова, к.м.н., главный внештатный специалист-эндокринолог Минздрава Челябинской области, М.И. Харахулах, к.м.н., главный внештатный специалист-эндокринолог Департамента здравоохранения Томской области, А.С. Чижова, главный внештатный специалист-эндокринолог Департамента здравоохранения Ивановской области, О.Ю. Шабельникова, к.м.н., ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», главный внештатный эндокринолог Минздрава Новосибирской области, М.Е. Яновская, к.м.н., главный эндокринолог Ярославской области.
Эксперты: Н.А. Петунина, член-корреспондент РАН, д.м.н., профессор, заведующая кафедрой эндокринологии ИКМ им. Н.В. Склифосовского ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, главный внештатный специалист-эндокринолог Минздрава России по Центральному федеральному округу, А.М. Мкртумян, д.м.н., профессор, заведующий кафедрой эндокринологии и диабетологии лечебного факультета и ФПДО ФГБОУ ВО «Российский университет медицины» Минздрава России, Т.П. Бардымова, д.м.н., профессор, заведующая кафедрой эндокринологии Иркутской государственной медицинской академии последипломного образования – филиала ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, главный внештатный специалист-эндокринолог Минздрава Иркутской области, И.А. Бондарь, д.м.н., профессор, заведующая кафедрой эндокринологии лечебного факультета ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, главный внештатный специалист-эндокринолог Минздрава России в Сибирском федеральном округе, Ф.В. Валеева, д.м.н., профессор, заведующая кафедрой эндокринологии ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России, заслуженный врач Республики Татарстан, главный внештатный эндокринолог Минздрава России по Приволжскому федеральному округу, И.Ю. Добрынина, д.м.н., профессор кафедры внутренних болезней Медицинского института БУ ВО «Сургутский государственный университет», главный внештатный эндокринолог Департамента здравоохранения Ханты-Мансийского автономного округа – Югры, С.А. Догадин, д.м.н., профессор кафедры госпитальной терапии и иммунологии с курсом ПО ФГБОУ ВО «Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого» Минздрава России, главный внештатный специалист-эндокринолог Минздрава Красноярского края, И.В. Мисникова, д.м.н., профессор кафедры эндокринологии ФУВ, ведущий научный сотрудник отделения терапевтической эндокринологии ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», главный эндокринолог Московской области, Л.А. Суплотова, д.м.н., профессор кафедры терапии с курсами эндокринологии, функциональной и ультразвуковой диагностики Института клинической медицины ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, главный внештатный эндокринолог Департамента здравоохранения Тюменской области, Л.А. Руяткина, д.м.н., профессор кафедры неотложной терапии с эндокринологией и профпатологией факультета повышения квалификации и профессиональной переподготовки врачей ФГБОУ ВО «Новосибирский государственный медицинский университет» Минздрава России, Л.Г. Стронгин, д.м.н., профессор кафедры эндокринологии и внутренних болезней, директор Института терапии ФГБОУ ВО «Приволжский исследовательский медицинский университет» Минздрава России, Л.Т. Бареева, главный внештатный специалист-эндокринолог Минздрава Республики Татарстан, Л.Н. Боева, к.м.н., заведующая отделением амбулаторной эндокринологической помощи КГБУЗ «Краевая клиническая больница», О.И. Горощеня, заведующая отделением эндокринологии БУЗ «Омская городская поликлиника № 13», А.М. Итинсон, главный внештатный эндокринолог Минздрава Курской области, М.В. Кочергина, к.м.н., главный внештатный эндокринолог Минздрава Свердловской области, Е.В. Князькина, главный внештатный специалист-эндокринолог Минздрава Пензенской области, Т.Г. Медина, к.м.н., ГБУЗ ПК «Ордена „Знак Почета“ Пермская краевая клиническая больница», главный внештатный эндокринолог Минздрава Пермского края, А.Д. Насыртдинова, главный внештатный специалист-эндокринолог Минздрава Республики Башкортостан, С.А. Прилепа, главный эндокринолог Тульской области, Л.Ю. Радионова, главный внештатный специалист-эндокринолог Минздрава Омской области, Л.А. Скакун, главный внештатный эндокринолог Управления здравоохранения администрации Челябинска, Л.В. Твердова, главный эндокринолог Рязанской области, А.В. Тюгаева, главный внештатный эндокринолог Минздрава Саратовской области, В.Л. Тюльганова, к.м.н., главный внештатный специалист-эндокринолог Минздрава Челябинской области, М.И. Харахулах, к.м.н., главный внештатный специалист-эндокринолог Департамента здравоохранения Томской области, А.С. Чижова, главный внештатный специалист-эндокринолог Департамента здравоохранения Ивановской области, О.Ю. Шабельникова, к.м.н., ГБУЗ НСО «Государственная Новосибирская областная клиническая больница», главный внештатный эндокринолог Минздрава Новосибирской области, М.Е. Яновская, к.м.н., главный эндокринолог Ярославской области.



Значимые коморбидности у пациента с СД 2 типа
Заболеваемость сахарным диабетом (СД) 2 типа характеризуется неуклонным ростом и уже носит характер неинфекционной пандемии. Согласно оценкам экспертов Международной федерации диабета, за последние 25 лет количество пациентов с СД в возрасте 20–79 лет в мире увеличилось в четыре раза и достигло 588,7 млн [1, 2]. И несмотря на внедрение инновационных антидиабетических препаратов и совершенствование лечебной стратегии, к 2050 г. прирост числа больных СД 2 типа может составить 45%, достигнув 852,5 млн человек [2]. По оценкам экспертов, наибольший вклад в увеличение распространенности заболевания вносят ожирение (49,6%) и демографические факторы (50,4%) [3].
Россия не является исключением из этой тенденции. Так, согласно «Базе данных клинико-эпидемиологического мониторинга СД на территории РФ», на 1 января 2024 г. распространенность СД в нашей стране составила 5 547 879 человек, из них 93% – взрослые с СД 2 типа [4]. Однако реальные цифры как минимум в два раза выше, что дает основание говорить о недостаточной диагностике столь грозного заболевания.
Высокая медико-социальная значимость СД 2 типа определяется не только ростом заболеваемости, но и высоким риском развития микро- и макрососудистых осложнений. Согласно оценкам экспертов, у 23,7% больных СД 2 типа имеет место диабетическая нейропатия, у 19,1% – диабетическая нефропатия, у 12,3% – диабетическая ретинопатия, у 4,1% – цереброваскулярные заболевания, у 3,4% – инфаркт миокарда, у 5,0% – атеросклероз, у 3,5% – диабетическая катаракта, у 1,9% – синдром диабетической стопы [5]. Примерно у 55% лиц с нарушением углеводного обмена выявляется неалкогольная жировая болезнь печени (НАЖБП), более чем у 50% больных СД 2 типа имеет место ожирение. Установлено, что у пациентов с СД 2 типа и сопутствующими заболеваниями сердца и почек ожидаемая продолжительность жизни сокращается [6–8].
С учетом того что СД 2 типа рассматривается как классическая модель коморбидности, а также с учетом сложной взаимосвязи многочисленных патогенетических механизмов заболевания в виде нарушений углеводного и липидного обменов, атерогенеза, приводящих к поражению сердечно-сосудистой системы, почек и печени, данные пациенты особенно нуждаются в многофакторном и мультидисциплинарном подходе с целью снижения частоты развития осложнений, увеличения продолжительности и улучшения качества жизни.
Современная терапия СД 2 типа предполагает комплексный подход и должна быть направлена не только на снижение гипергликемии, но и на управление кардиометаболическими рисками с целью сокращения риска развития сердечно-сосудистых осложнений и преждевременной смерти. Принятые экспертами Всемирной организации здравоохранения глобальные цели в отношении СД к 2030 г. предусматривают помимо улучшения диагностики заболевания с целью его выявления у 80% лиц с СД достижение хорошего контроля гликемии и артериального давления (АД) у 80% пациентов с диагностированным СД и применение статинов у 60% пациентов с СД старше 40 лет [9]. Эти задачи также нашли отражение в российском федеральном проекте «Борьба с сахарным диабетом» на 2023–2025 гг., разработанном Минздравом России совместно с Национальным медицинским исследовательским центром эндокринологии им. академика И.И. Дедова.
Среди современных антидиабетических средств ключевая роль в управлении кардиометаболическими рисками отводится ингибиторам натрий-глюкозного котранспортера 2 (иНГЛТ-2) и агонистам рецепторов глюкагоноподобного пептида 1 (арГПП-1). С учетом многофакторного патогенеза СД 2 типа и наличия полиморбидности у пациентов считается, что ранняя комбинированная терапия с использованием этих инновационных препаратов уже в дебюте заболевания может иметь преимущества как в отношении долгосрочного удержания гликемического контроля, так и в отношении снижения риска возникновения неблагоприятных сердечно-сосудистых и метаболических исходов.
Появление иНГЛТ-2 существенно расширило возможности управления СД 2 типа и уменьшения риска развития различных неблагоприятных исходов. Этот инновационный класс препаратов со сходной химической структурой и механизмом действия, которые изначально были отнесены к сахароснижающим препаратам, обладает доказанными класс-специфическими негликемическими эффектами в отношении массы тела, АД, сердечной недостаточности (СН), почечных и других исходов [10]. Обширная и быстро пополняющаяся доказательная база в отношении иНГЛТ-2 привела к изменению парадигмы клинических представлений о месте данных препаратов в терапии СД 2 типа. Многочисленные крупномасштабные рандомизированные клинические исследования (РКИ), исследования в условиях реальной практики, систематические обзоры и метаанализы позволяют утверждать, что применение препаратов этого класса является эффективным способом улучшения контроля гликемии у пациентов с СД 2 типа независимо от длительности заболевания и функциональной активности β-клеток, а также предупреждения и замедления прогрессирования диабетических микро- и макрососудистых осложнений. При этом защитные сердечно-сосудистые и почечные эффекты иНГЛТ-2, по-видимому, не зависят от их сахароснижающего эффекта.
Убедительные основания, позволившие рассматривать терапию иНГЛТ-2 как способную значимо снижать риск почечных и некоторых сердечно-сосудистых исходов, обусловили возможность рекомендовать их в качестве терапии первой линии (вместе с метформином) для лечения СД 2 типа у некоторых категорий пациентов: с наличием или высоким риском развития атеросклеротических сердечно-сосудистых заболеваний (ССЗ), хронической сердечной недостаточности (ХСН) и хронической болезни почек (ХБП) [11, 12]. В опубликованном в 2020 г. международном манифесте эндокринологов определено, что недостаточное использование иНГЛТ-2 не позволяет пациентам с СД получать жизненно важное лечение, а также подвергает их большему риску госпитализации по поводу СН и прогрессирования почечной недостаточности [13]. Несмотря на усилия профессиональных сообществ по разработке и внедрению новых подходов к лечению СН и ХБП, основанных на доказательствах высшего уровня, наблюдается клиническая инерция в назначении пациентам с СД 2 типа инновационных препаратов.
Особое внимание эксперты обратили на недостаточную информированность врачей в отношении доказанных клинических преимуществ отдельных представителей иНГЛТ-2, особенно тех из них, которые не представлены в США и Европе и, соответственно, не включены в клинические рекомендации профессиональных сообществ этих стран. В Российской Федерации врачи имеют более широкий выбор иНГЛТ-2 для лечения СД 2 типа у взрослых. Так, на сегодняшний день в России помимо дапаглифлозина, канаглифлозина и эмпаглифлозина рекомендованы ипраглифлозин и лусеоглифлозин, причем ипраглифлозин с 2021 г. включен в перечень льготных препаратов [14].
Антидиабетическая, кардио- и нефропротективная активность иНГЛТ-2
По оценкам экспертов, только у 42% пациентов с СД 2 типа уровень гликированного гемоглобина (HbA1c) составляет менее 7% [4]. Данные многочисленных РКИ, наблюдательных постмаркетинговых программ и метаанализов убедительно доказывают, что, подавляя реабсорбцию глюкозы в почках и увеличивая выведение глюкозы с мочой, что, как следствие, приводит к снижению ее уровня в крови, иНГЛТ-2 существенно улучшают гликемический контроль на всех стадиях СД 2 типа без увеличения риска развития тяжелых гипогликемий. Так, метаанализ 13 РКИ с участием 2535 пациентов с СД 2 типа продемонстрировал значимое улучшение гликемического контроля (по уровню HbA1c и глюкозы плазмы натощак (ГПН)) при применении ипраглифлозина в дозе 50 мг/сут, как в виде монотерапии, так и при добавлении к другим сахароснижающим препаратам, при неэффективности ранее проводимой фармакотерапии СД 2 типа [15].
Обсуждая обобщенный региональный опыт, а также отдельные клинические случаи, эксперты рассмотрели различные аспекты эффективности и безопасности длительной терапии СД 2 типа с использованием ипраглифлозина (препарата Суглат). Так, на примере многоцентрового исследования реальной клинической практики STELLA-LONG TERM было продемонстрировано, что препарат Суглат способствовал значимому и устойчивому улучшению гликемического контроля на протяжении трех лет [16]: через 36 месяцев наблюдения среднее снижение уровня HbA1c составило 0,7%, уровня ГПН – 1,6 ммоль/л. При этом эффективность терапии препаратом Суглат не зависела от предшествующей терапии и возраста больных СД 2 типа. Через 36 месяцев наблюдения у пациентов моложе 65 лет среднее снижение уровня HbA1c составило 0,74%, у пациентов старше 65 лет – 0,65% [17].
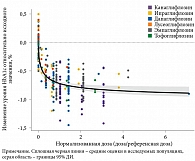
Эксперты отметили, что, согласно данным оценки сахароснижающей эффективности шести иНГЛТ-2, после нормализации дозы различные иНГЛТ-2 демонстрируют сопоставимый сахароснижающий эффект (рис. 1) [18].
Поскольку СД 2 типа часто сопряжен с повышенным риском развития сердечно-сосудистых заболеваний, которые являются одной из основных причин смерти больных, с 2008 г. при регистрации новых сахароснижающих препаратов для пациентов с СД 2 типа одним из ключевых требований является подтверждение их длительной (не менее двух лет) сердечно-сосудистой безопасности. Именно поэтому анализ частоты и риска сердечно-сосудистых событий стал предметом особого внимания в программах клинических исследований иНГЛТ-2. Итоги уже первого крупного исследования одного из представителей иНГЛТ-2 эмпаглифлозина (исследование EMPA-REG OUTCOME) показали не только отсутствие неприемлемого увеличения сердечно-сосудистого риска, но даже улучшение некоторых сердечно-сосудистых исходов, а также снижение сердечно-сосудистой и общей смертности пациентов с СД 2 типа [19]. Результаты последующих РКИ – CANVAS Program, CREDENCE, DECLARE-TIMI 58, SOLOIST-WHF, SCORED – подтвердили данные, полученные в исследовании EMPA-REG OUTCOME, что позволило говорить о класс-специфическом эффекте иНГЛТ-2 в отношении снижения риска госпитализаций по поводу СН, а также обратить внимание на замедление прогрессирования дисфункции почек у больных СД 2 типа [20, 21]. При этом было отмечено, что «драматическое» улучшение сердечно-сосудистых исходов не зависит от иногда «скромного» сахароснижающего эффекта иНГЛТ-2. Позже экспериментальные данные подтвердили гипотезу об универсальном кардиоренопротективном действии глифлозинов, выходящем за рамки лечения нарушений углеводного обмена [22].
В клинических исследованиях ипраглифлозина фаз II и III частота неблагоприятных сердечно-сосудистых исходов была низкой: риск больших сердечно-сосудистых событий (Major Adverse Cardiovascular Events, MACE) составил 0,41 (95%-ный доверительный интервал (ДИ) 0,15–1,01), что соответствовало рекомендованным критериям долгосрочной сердечно-сосудистой безопасности (верхний порог двустороннего 95% ДИ относительного риска (ОР) в пререгистрационных РКИ не должен превышать 1,8, в постмаркетинговых исследованиях – 1,3) и не требовало проведения отдельного клинического исследования. Это послужило основанием признания приемлемости профиля сердечно-сосудистой безопасности препарата Суглат (ипраглифлозина) при его регистрации как в Японии в 2014 г., так и в России в 2019 г.
Данные постмаркетингового наблюдательного исследования STELLA-LONG TERM также подтвердили низкую частоту сердечно-сосудистых событий при длительном лечении ипраглифлозином. Так, частота МАСЕ (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт) через три года составила 0,15%, расширенного МАСЕ (плюс сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт, нестабильная стенокардия) – 0,18%, инфаркта миокарда – 0,05%, инсульта (в том числе транзиторной ишемической атаки) – 0,11%, госпитализаций по поводу СН – 0,01%, фибрилляции предсердий – 0,01% [23, 24]. Кроме того, не было зафиксировано увеличения частоты сердечно-сосудистых событий при повышении дозы и длительности лечения.
Не менее впечатляющими оказались результаты исследования ренопротективного потенциала иНГЛТ-2. Согласно разным оценкам, распространенность ХБП среди лиц с СД в четыре раза выше, чем в общей популяции. Кроме того, у пациентов с СД и болезнью почек совокупная десятилетняя смертность выше, чем у лиц без признаков поражения почек [25]. Помимо этого в исследовании DAPA-CKD было показано, что дапаглифлозин по сравнению с плацебо снижает риск достижения комбинированного почечного исхода в виде стойкого снижения расчетной скорости клубочковой фильтрации (рСКФ) на ≥ 50%, риск развития терминальной стадии заболевания почек или наступления смерти от почечных или сердечно-сосудистых причин у пациентов с ХБП независимо от состояния углеводного обмена и функции почек, а также риск госпитализаций по поводу СН, сердечно-сосудистой смерти и смерти от всех причин [26]. Исследование эмпаглифлозина у пациентов с ХБП также показало, что терапия иНГЛТ-2 ассоциируется с улучшением комбинированного почечного исхода (риск прогрессирования заболевания почек или смерти от сердечно-сосудистых причин) как у пациентов с СД, так и без него [27]. Приведенные данные свидетельствуют об универсальных ренопротективных эффектах иНГЛТ-2 у широкого круга пациентов с СД 2 типа и ХБП.
Согласно данным проспективного многоцентрового исследования у пациентов с исходной рСКФ ≥ 60 мл/мин/1,73 м2 терапия препаратом Суглат приводила к незначительному снижению рСКФ [28], что свидетельствует об уменьшении патологической гиперфильтрации за счет увеличения доставки натрия к macula densa в дистальных канальцах нефрона, активирующей тубулогломерулярную обратную связь, что приводит к сужению артериол, уменьшению внутриклубочковой гипертензии и альбуминурии. В то же время у лиц с низкой рСКФ (от ≥ 30 до < 60 мл/мин/1,73 м2) терапия ипраглифлозином значимо увеличивала этот показатель с последующим длительным (до двух лет) удержанием его на достигнутом уровне [28].
Эксперты согласились, что перечисленные эффекты свидетельствуют о нефропротективном влиянии ипраглифлозина у пациентов с СД 2 типа. Вместе с тем, по мнению экспертов, более «скромное» влияние иНГЛТ-2 на гликемический контроль у пациентов со сниженной функцией почек является не неожиданностью, а вполне закономерным явлением, учитывая, что гипогликемический эффект этих препаратов связан с экскрецией глюкозы с мочой. При этом было отмечено, что, согласно результатам исследования по оценке эффективности ипраглифлозина у пациентов с СД 2 типа и ХБП, терапия ипраглифлозином снижала уровень HbA1c во всех группах, в том числе в группе пациентов с нарушенной функцией почек [29].
Важным вопросом, обсуждаемым в рамках прошедших встреч, была проблема сравнительной сердечно-сосудистой безопасности и почечных эффектов различных иНГЛТ-2. Особый интерес у экспертов вызвали результаты представленных прямых сравнительных исследований шести различных иНГЛТ-2 с использованием популяционной базы данных о медицинских осмотрах и претензиях. Анализ сердечно-сосудистых исходов показал, что риск развития сердечно-сосудистых событий, включая СН, инфаркт миокарда, стенокардию и фибрилляцию предсердий, был сопоставим между отдельными представителями иНГЛТ-2 (эмпа-, дапа-, кана- и ипраглифлозином) [30]. Ипраглифлозин также продемонстрировал незначительное преимущество перед эмпаглифлозином в качестве референсного препарата в снижении риска наступления сердечно-сосудистых событий (рис. 2). Так, при использовании ипраглифлозина риск возникновения СН был ниже на 8%, инфаркта миокарда – на 35%, фибрилляции предсердий – на 38% по сравнению с применением эмпаглифлозина (во всех случаях статистически не значимо).
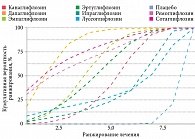
Анализ почечных исходов у пациентов с СД 2 типа, получавших терапию разными иНГЛТ-2 (n = 25 000, 2573 из которых получали эмпаглифлозин в качестве референсного препарата, 2214 – дапаглифлозин, 2100 – канаглифлозин, 2636 – ипраглифлозин, 1110 – лусеоглифлозин и 1467 – тофоглифлозин), также не выявил значимых различий не только в отношении прогрессирования дисфункции почек, определяемой по рСКФ (рис. 3), но и в отношении риска достижения комбинированных почечных исходов (снижения рСКФ на 30% и более и/или начала заместительной почечной терапии) при приеме разных иНГЛТ-2 [31].
Эксперты согласились, что результаты завершенных исследований и доступные экспериментальные данные о кардиоренальных механизмах действия иНГЛТ-2 свидетельствуют о выходе эффекта данных препаратов за рамки контроля метаболизма глюкозы. Неслучайно данный класс препаратов оказался столь востребован кардиологами и нефрологами для лечения СН и продвинутых стадий ХБП.
Между тем остаются открытыми вопросы первичной профилактики CCЗ и ХБП. Текущие проблемы с недостатком доказательств в отношении новых классов препаратов нашли отражение в Консенсусе международных экспертов о важности гликемического контроля 2024 г. Они касаются недостаточной изученности сердечно-сосудистых эффектов иНГЛТ-2 и арГПП-1 у пациентов с СД 2 типа из групп низкого и умеренного риска, влияния этих препаратов на риск развития микрососудистых осложнений, неравномерной эффективности в отношении отдельных компонентов МАСЕ, отсутствия долгосрочных РКИ и подтверждения экономической эффективности комбинации иНГЛТ-2 и арГПП-1 по сравнению с ранним многофакторным управлением СД 2 типа [32].
Роль иНГЛТ-2 в коррекции кардиометаболических факторов риска
В многочисленных исследованиях иНГЛТ-2 продемонстрировали дополнительные положительные эффекты на суррогатные конечные точки.
Установлено, что у 80–90% пациентов с СД 2 типа имеет место избыточный вес или ожирение, что обусловливает дополнительный повышенный риск развития серьезных осложнений и наступления преждевременной смерти [33].
Роль ожирения как фактора риска развития СД 2 типа не вызывает сомнений. Кроме того, ожирение сопровождается многочисленными сочетанными заболеваниями, включая НАЖБП, желчнокаменную болезнь, сердечную недостаточность, инсульт и апноэ во сне. Известно, что гипертрофическая жировая ткань ассоциируется с метаболической дисфункцией, резистентностью к инсулину и воспалением [34]. Согласно данным метаанализа 55 клинических исследований, у пациентов с СД 2 типа применение иНГЛТ-2 приводило к уменьшению массы тела в среднем на 1,5–2,0 кг с тенденцией к повышению эффективности терапии при использовании более высоких доз препаратов. Данные завершенных исследований ипраглифлозина при лечении СД 2 типа также показали, что применение ипраглифлозина как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами значимо снижало массу тела – в среднем на 2,31 кг (от -1,09 до -2,93 кг соответственно) [35–42]. В длительном популяционном наблюдательном исследовании STELLA-LONG TERM добавление к предшествующей терапии СД 2 типа ипраглифлозина способствовало значимому и устойчивому уменьшению массы тела на 3,33 кг через 36 месяцев [16]. Отмечалось также уменьшение индекса массы тела (ИМТ) (-1,24 кг/м2 через 36 месяцев) и окружности талии – суррогатного маркера висцерального ожирения.
Неслучайно, согласно междисциплинарным рекомендациям «Лечение ожирения и коморбидных состояний», пациентам с избыточной массой тела или ожирением и сопутствующим СД 2 типа показаны иНГЛТ-2 наряду с арГПП-1 [43].
Среди механизмов, лежащих в основе влияния иНГЛТ-2 на массу тела, наиболее часто отмечают снижение реабсорбции глюкозы в почечных канальцах и, соответственно, увеличение экскреции глюкозы почками [34, 36]. Индуцируемая глюкозурия приводит к снижению уровней глюкозы и инсулина в крови, увеличению секреции глюкагона натощак и постпрандиально с увеличением образования кетоновых тел и сдвигом в сторону использования липидов в качестве источника энергии [44].
Кроме того, обсуждается прямое влияние иНГЛТ-2 на количество и функциональную активность висцеральной жировой ткани.
В отдельных клинических исследованиях у пациентов с СД 2 типа было продемонстрировано уменьшение объема абдоминального висцерального жира на фоне применения ипраглифлозина. Так, в исследовании PRIME-V терапия ипраглифлозином по сравнению с терапией метформином, проводимая в течение 24 недель, статистически значимо уменьшала не только массу тела (р = 0,0004), но и объем висцерального (р = 0,04) и подкожного (р = 0,004) жира, тогда как в группе метформина эти показатели повысились [45].
Особое внимание уделяется эктопическому накоплению жира. Помимо метаболических нарушений, отложение жировой ткани во внутренних органах, в частности перикардиально и периваскулярно, ассоциировано с гуморальной активностью за счет секреции биологически активных веществ. Воспалительные цитокины и адипокины представляют собой весьма важные компоненты сердечно-сосудистого ремоделирования [6–9]. Получены убедительные данные, что накопление эпикардиального жира приводит к прогрессированию коронарного атеросклероза, развитию артериальной гипертензии и СН независимо от традиционных факторов сердечно-сосудистого риска [35–37, 46, 47]. Поэтому вполне возможно, что уменьшение объема эктопического жира в дополнение к снижению массы тела может быть связано с улучшением сердечно-сосудистых исходов.
Так, 12-недельная терапия ипраглифлозином у пациентов с СД 2 типа с висцеральным ожирением привела к значимому уменьшению объема эпикардиального жира по данным магнитно-резонансной томографии (р = 0,008) [48]. Уменьшение объема эпикардиального жира и площади жировой ткани при ингибировании НГЛТ-2 было связано с изменениями чувствительности к инсулину и секреции адипокинов (снижению уровня лептина и повышению сывороточного уровня адипонектина), что в конечном итоге может способствовать дополнительному снижению сердечно-сосудистого риска у пациентов с СД 2 типа.
Создается впечатление, что ипраглифлозин должен эффективно снижать и инсулинорезистентность, являющуюся ключевым звеном в патогенезе СД 2 типа. Так ли это? В исследовании EMIT было продемонстрировано преимущество ипраглифлозина по сравнению с плацебо в отношении достоверного (р < 0,001) и более значимого снижения уровня инсулина натощак (-1,34 против -0,35 мкЕд/мл) и лептина (-0,80 против -0,23 нг/мл), а также в повышении уровня адипонектина (+0,47 против + 0,02 мкг/мл) [38].
Одной из частых коморбидностей при СД 2 типа является артериальная гипертензия. В большинстве клинических исследований с иНГЛТ-2 было показано снижение систолического и диастолического АД в среднем на 3–5 и 1–2 мм рт. ст. соответственно независимо от наличия артериальной гипертензии и приема каких-либо гипотензивных препаратов [49]. Данный эффект сохраняется в полном объеме независимо от снижения почечной функции [50].
Считается, что снижение АД является класс-специфическим эффектом иНГЛТ-2. Данные отдельных исследований и метаанализ РКИ ипраглифлозина также демонстрируют благоприятное влияние препарата, принимаемого как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами, на АД у пациентов с СД 2 типа.
Среди механизмов гипотензивного эффекта иНГЛТ-2 отмечают снижение веса и уменьшение висцерального ожирения, натрийурез и осмотический диурез, снижение активности симпатической нервной системы, влияние на артериальную жесткость и эндотелиальную функцию [51–54].
Одним из независимых факторов сердечно-сосудистого риска у больных с СД 2 типа является атерогенная дислипидемия, которая, как известно, напрямую связана с инсулинорезистентностью. Инсулинорезистентность способствует повышению уровня циркулирующих свободных жирных кислот и их поступлению в печень, продукции богатых триглицеридами (ТГ) липопротеинов очень низкой плотности (ЛПОНП), снижению катаболизма ЛПОНП, уровня циркулирующих липопротеинов высокой плотности (ЛПВП) и увеличению уровня ТГ в плазме крови [55].
Согласно анализу данных по Ярославской области, в структуре коморбидности у пациентов с СД 2 типа дислипидемия является одной из наиболее частых патологий наряду с ожирением и артериальной гипертензией. Поэтому не вызывает сомнений обоснованность рекомендации Всемирной организации здравоохранения об обязательном применении гиполипидемической терапии – статинов у большинства пациентов с СД 2 типа. Аналогичная позиция представлена в клинических рекомендациях, разработанных Российской ассоциацией эндокринологов. Так, наряду с достижением целевой гликемии указывается на необходимость достижения целевого уровня ЛПНП. В то же время метаанализ 26 РКИ (n = 170 000) продемонстрировал, что снижение уровня ЛПНП на 1,0 ммоль/л ассоциируется со снижением ОР наступления сердечно-сосудистых событий на 22%. В то же время на фоне терапии статинами относительный остаточный риск серьезных сосудистых осложнений составлял 78% [56]. В то же время одним из ведущих компонентов диабетической атеросклеротической триады, которая вносит наибольший вклад в развитие коморбидных осложнений, в первую очередь ассоциированных с атеросклерозом ССЗ, является гипертриглицеридемия. Установлено, что высокий уровень ТГ связан с повышением сердечно-сосудистого риска и затрат здравоохранения [57].
На примере регионального анализа медицинских данных пациентов с СД Ярославской области продемонстрировано улучшение показателей липидного спектра у пациентов, получающих иНГЛТ-2. Так, 56,3% больных достигли уровня общего холестерина менее 5,2 ммоль/л, 47,2% – уровня ЛПВП более 1,0 ммоль/л. В то же время у 92,6% пациентов имел место нецелевой уровень ЛПНП и ТГ – более 1,4 и 1,7 ммоль/л соответственно.
В этом контексте применение препарата Суглат является наиболее оптимальным, поскольку он воздействует на все компоненты атерогенной дислипидемии [39, 58, 59]. Так, объединенный анализ шести РКИ показал, что использование ипраглифлозина при СД 2 типа улучшает липидный профиль крови. Ипраглифлозин в отличие от плацебо более выраженно снижал уровень ЛПНП (-0,4%), повышал уровень ЛПВП (+7,2%) и значимо снижал уровень ТГ (-12,3%) [59] по сравнению с исходными уровнями.
Кроме того, согласно данным отдельного 12-недельного исследования, добавление ипраглифлозина к терапии СД 2 типа ассоциировалось со статистически значимым снижением уровня ЛПНП, в том числе мелких плотных частиц ЛПНП, по сравнению с контрольной группой – - 4,3 и -1,3 против +9,7 и +2,8 мг/дл соответственно [59].
Анализ медицинских данных пациентов с СД Ярославской области «Матрица корреляций: ипраглифлозин (50 мг) и показатели липидного спектра» за период 2021–2025 гг. показал положительное влияние препарата Суглат на уровень холестерина, ЛПВП/ЛПНП и ТГ у пациентов с СД 2 типа. Так, согласно проведенному анализу, в группе больных СД 2 типа отмечены статистически значимая (р < 0,05) отрицательная корреляция средней силы между применением препарата Суглат в дозе 50 мг/сут и уровнем общего холестерина у мужчин (r = -0,66), а также прямая положительная корреляция между приемом ипраглифлозина и уровнем α-холестерина у женщин (r = 0,64). Таким образом, длительная терапия препаратом Суглат сопровождалась повышением уровня ЛПВП с тенденцией к снижению уровня общего холестерина.
Еще одним из значимых факторов риска поражения сердечно-сосудистой системы у пациентов с СД 2 типа является гиперурикемия, которая ассоциируется с артериальной гипертензией, повреждением сосудистой стенки, развитием гломерулосклероза и нарушением функции почек [60]. Имеются данные о том, что СД 2 типа ассоциируется с более высокой распространенностью подагры, а также о более высокой распространенности СД 2 типа у лиц с бессимптомной гиперурикемией, что свидетельствует о двустороннем негативном влиянии нарушений углеводного и пуринового обменов [61–66]. Сочетание СД 2 типа и гиперурикемии тесно взаимосвязано с повышенным риском неблагоприятных сердечно-сосудистых и почечных событий. Коррекция гиперурикемии может быть полезна для замедления прогрессирования ХБП и снижения сердечно-сосудистого риска [4, 65].
В некоторых исследованиях иНГЛТ-2 продемонстрировали способность снижать уровень мочевой кислоты (МК) [67] в крови в среднем на 5,9–17,8% от исходного у лиц с СД 2 типа [68], что может иметь дополнительные кардиоренальные преимущества [65]. Метаанализ плацебо-контролируемых РКИ также продемонстрировал благоприятное влияние ипраглифлозина на уровень МК [69]. В сравнительном исследовании N-ISM ипраглифлозин показал более значимый эффект в отношении снижения веса, уровня С-пептида и МК, выбранных в качестве вторичных конечных точек, чем ситаглиптин [51].
Гепатопротекторная активность глифлозинов
Согласно экспертной оценке, подавляющее большинство (до 85%) пациентов с СД 2 типа имеют коморбидные заболевания, среди которых наиболее частыми являются ожирение, дислипидемия, сердечно-сосудистые заболевания, ХБП и НАЖБП [70].
Распространенность НАЖБП в мире в целом и в России в частности составляет 25% [71, 72]. Она выявляется у 70–80% пациентов с СД 2 типа [73]. Особое опасение вызывает способность НАЖБП значимо повышать риск развития сердечно-сосудистых заболеваний, который при НАЖБП, согласно метаанализу шести исследований (n = 7 042), в среднем увеличивается в четыре раза: у мужчин – в 3,5 раза, у женщин – более чем в 7,0 раза [74].
Поскольку кардиометаболические риски НАЖБП угрожают жизни пациента уже на стадии стеатоза, необходимо активное выявление этого заболевания и раннее начало терапии, направленной на снижение кардиометаболических факторов риска [75].
В 2023 г. была принята новая номенклатура болезни печени – метаболически ассоциированная жировая болезнь печени (МАЖБП). МАЖБП/НАЖБП ассоциируется с повышенным риском наступления сердечно-сосудистых событий, развития ХБП, злокачественных новообразований, печеночной недостаточности, гепатоцеллюлярной карциномы.
Диагностическими критериями МАЖБП являются сочетание стеатоза печени (5% и более), выявленного визуализационными или гистологическими методами, с одним или более из следующих факторов кардиометаболического риска: ИМТ > 25 кг/м2 (европейцы) или окружность талии > 94 см у мужчин и > 80 см у женщин, уровень ГПН > 5,6 ммоль/л или постпрандиальной глюкозы > 7,8 ммоль/л, уровень HbA1c > 5,7% либо лечение СД 2 типа, АД > 130/85 мм рт. ст. или гипотензивная терапия, уровень ТГ ≥ 1,7 ммоль/л, уровень ЛПВП < 1,0 ммоль/л (для мужчин) и < 1,3 ммоль/л (для женщин) или гиполипидемическая терапия.
Согласно рекомендациям совместного консенсуса Европейской ассоциации по изучению болезней печени, Европейской ассоциации по изучению диабета и Европейской ассоциации по изучению ожирения 2024 г., для лиц с МАЖБП следует выбирать фармакологическое лечение в зависимости от сопутствующих заболеваний и стадии болезни.
В свою очередь эксперты Американской ассоциации клинических эндокринологов взрослым пациентам с СД 2 типа и подтвержденным биопсией неалкогольным стеатогепатитом (НАСГ), а также пациентам с повышенной вероятностью развития НАСГ на основании повышенного уровня трансаминаз и результатов неинвазивных тестов рекомендуют пиоглитазон или арГПП-1. Кроме того, пациентам с СД 2 типа и НАЖБП показано применение арГПП-1, пиоглитазона или иНГЛТ-2 вследствие их кардиометаболической пользы [76].
Российские клинические рекомендации по лечению неалкогольной жировой болезни печени 2024 г. также рассматривают пиоглитазон, аналоги ГПП-1 и иНГЛТ-2 в качестве приоритетных препаратов для лечения СД 2 типа у пациентов с НАЖБП [77].
Эксперты обсудили экспериментальные и клинические данные, свидетельствующие, что иНГЛТ-2 оказывают ряд общих эффектов, а именно уменьшают воспаление и окислительный стресс, а также стеатоз печени, предотвращают прогрессирование фиброза печени и даже обратные фиброзные изменения в паренхиме печени, возможно препятствуют опухолевой трансформации. С учетом высокой коморбидности при НАЖБП применение иНГЛТ-2 имеет ряд преимуществ по сравнению с использованием других сахароснижающих препаратов в отношении снижения риска неблагоприятных сердечно-сосудистых и почечных исходов как у пациентов СД 2 типа, так и без него [78–80].
Представленные данные продемонстрировали благоприятное влияние терапии ипраглифлозином не только на контроль гликемии, но и на массу тела и количественное содержание жира в организме и профиль липидов в крови (включая уменьшение уровня ТГ). Применение препарата Суглат у пациентов с СД 2 типа и НАЖБП также сопровождалось снижением сывороточной активности печеночных ферментов: аланинаминотрансферазы (АЛТ) – на 24 МЕ/л, аспартатаминотрасферазы (АСТ) – на 9 МЕ/л, γ-глютамилтранспептидазы (ГГТ) – на 15 МЕ/л [81]. В отдельном исследовании было показано, что ипраглифлозин сопоставим с пиоглитазоном в отношении благоприятного воздействия на НАЖБП и массу тела [52]. Помимо этого, терапия препаратом Суглат у пациентов СД 2 типа и НАЖБП сопровождалась уменьшением выраженности признаков стеатоза печени (по Fatty Liver Index) [82].
В исследовании STELLA-LONG TERM также было показано, что длительная терапия ипраглифлозином улучшает течение НАЖБП, значимо снижая уровень печеночных ферментов и стеатоз печени [83].
Согласно результатам многоцентрового рандомизированного исследования в параллельных группах, у пациентов с СД 2 типа и НАЖБП терапия ипраглифлозином приводила к значимому уменьшению выраженности баллонной дистрофии у 66,7%, уменьшению гистологических признаков фиброза (как минимум на одну степень) у 57% пациентов (рис. 4), а также уменьшению сывороточной активности печеночных трансаминаз (АЛТ, АСТ) и гГТ и предупреждению новых случаев НАСГ у 100% пациентов с отсутствием стеатогепатита в анамнезе [44].
Резюмируя вышесказанное, эксперты согласились, что с учетом двунаправленного влияния СД 2 типа и НАЖБП профилактика развития и снижение риска прогрессирования последней являются одной из важных задач лечения коморбидных пациентов с СД 2 типа. Результаты представленных исследований убедительно демонстрируют способность ипраглифлозина уменьшать выраженность воспаления и фиброза печени, а также предупреждать развитие НАСГ. Это позволяет говорить о том, что препарат Суглат является перспективным для лечения и профилактики развития НАСГ, а также для улучшения контроля гликемии и ожирения у пациентов с СД 2 типа и НАЖБП, что необходимо учитывать при выборе сахароснижающего препарата для лечения больных СД 2 типа с данной коморбидностью.
Безопасность терапии иНГЛТ-2
С учетом необходимости длительного применения сахароснижающих препаратов важное практическое значение придается благоприятному профилю безопасности препарата Суглат. Согласно данным трехлетнего постмаркетингового наблюдательного исследования STELLA-LONG TERM в условиях реальной клинической практики, у пациентов с СД 2 типа терапия с использованием препарата Суглат сопровождалась низкой частотой развития нежелательных явлений (НЯ), в том числе гипогликемий. Наиболее частыми НЯ были события, обусловленные гиповолемией [16].
Данные постмаркетингового мониторинга безопасности свидетельствуют об отсутствии повышения риска переломов и ампутаций нижних конечностей на фоне лечения препаратом Суглат. Среди потенциальных преимуществ ипраглифлозина перед другими представителями данного класса выделяют низкий риск развития инфекций мочевыводящих путей и генитальных инфекций, что подтверждают данные метаанализа 113 РКИ (n = 105 293) (рис. 5) [17].
Заключение
Подводя итог, профессор Н.А. Петунина отметила большую значимость затронутых проблем, а также возможность обсуждения их с позиции доказательной медицины и накопленного регионального опыта. В настоящее время не вызывает сомнений тот факт, что СД 2 типа представляет собой модель коморбидности и требует многофакторного терапевтического подхода с целью снижения риска развития осложнений.
Уникальность иНГЛТ-2, в частности ипраглифлозина, заключается не только в благоприятном воздействии на гликемию и ее вариабельность, но и в способности оказывать органопротективные эффекты. Многочисленные исследования и опыт применения препарата Суглат в клинической практике при лечении пациентов с СД 2 типа убедительно демонстрируют, что ипраглифлозин позволяет более эффективно управлять гликемией, не повышая риск гипогликемий, а также оказывает комплексное воздействие на многочисленные модифицируемые факторы кардиометаболического риска – снижает АД, уровень МК в крови, альбуминурию, массу тела, ИМТ, улучшает липидный профиль, демонстрирует позитивное влияние как на провоспалительные и проатерогенные адипокины, так и на фиброз печени, что сопряжено с регрессом НАЖБП, а также уменьшает риск неблагоприятных сердечно-сосудистых исходов и прогрессирования дисфункции почек у пациентов с ХБП. Эксперты пришли к соглашению, что немаловажным является низкий риск развития нежелательных реакций, что, несомненно, является преимуществом препарата Суглат и способствует повышению приверженности пациентов к лечению СД 2 типа. Участники встреч согласились, что перечисленные преимущества препарата Суглат позволяют рекомендовать его для более широкого применения при лечении пациентов с СД 2 типа в клинической практике и первичной профилактике развития коморбидных заболеваний.
Источник финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Все авторы принимали участие в совете экспертов по оптимизации персонифицированного подхода к ведению пациентов с сахарным диабетом 2 типа с использованием ингибиторов натрий-глюкозного котранспортера 2 с учетом опыта российских регионов. Мероприятие было проведено при поддержке ООО «Астеллас Фарма Продакшен». Обсуждаемые во время заседаний вопросы легли в основу данного материала.
Участие авторов. Концепция, редактирование и утверждение финального варианта рукописи – Н.А. Петунина и А.М. Мкртумян.
Подготовка материала, редактирование и утверждение финального варианта – Т.П. Бардымова, И.А. Бондарь, Ф.В. Валеева, И.Ю. Добрынина, С.А. Догадин, И.В. Мисникова, Л.А. Суплотова, Л.А. Руяткина, Л.Г. Стронгин, Л.Т. Бареева, Л.Н. Боева, О.И. Горощеня, А.М. Итинсон, М.В. Кочергина, Е.В. Князькина, Т.Г. Медина, А.Д. Насыртдинова, С.А. Прилепа, Л.Ю. Радионова, Л.А. Скакун, Л.В. Твердова, А.В. Тюгаева, В.Л. Тюльганова, М.И. Харахулах, А.С. Чижова, О.Ю. Шабельникова, М.Е. Яновская.
Все авторы внесли значимый вклад в написание рукописи и подготовку ее к печати.
Благодарность. Авторы выражают благодарность Я.Г. Алексеевой, представителю ООО «Астеллас Фарма Продакшен», за помощь в подготовке материала к публикации.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.