Клиника, диагностика и лечение височной эпилепсии
- Аннотация
- Статья
- Ссылки

Височная эпилепсия является, по-видимому, самой распространенной формой ФЭ у взрослых. Так, по данным F. Semah и соавт. (1998 г.), среди всех пациентов, обратившихся в Парижскую клинику эпилепсии в течение 7 лет, у половины была диагностирована височная эпилепсия, а у четверти – гиппокампальный склероз (ГС) (14). Мезиальная височная эпилепсия (МВЭ) с ГС – самый распространенный и единственный в ряду ФЭ эпилептический синдром, имеющий четкие клинические, нейропсихологические, электроэнцефалографические и нейровизуализационные критерии, что делает ее «идеальной» моделью для изучения симптоматических ФЭ. Латеральная (неокортикальная) височная эпилепсия (ЛВЭ) встречается существенно реже, составляя, очевидно, менее 10% среди всех случаев ВЭ (13). Несмотря на большое количество посвященных этой проблеме научных работ, распространенность различных форм ВЭ, а также эффективность их медикаментозной терапии и прогноз остаются недостаточно изученными.
Целью нашего исследования было изучение распространенности, клинических особенностей, эффективности лечения и прогноза у взрослых пациентов с различными формами ВЭ.
Материалы и методы
Среди 536 пациентов с ФЭ, обратившихся за специализированной помощью, было выявлено 136 больных с четкой клинической, электроэнцефалографической и нейровизуализационной картиной ВЭ, 66 мужчин и 70 женщин в возрасте от 17 до 79 лет. Возраст дебюта заболевания варьировал от первых дней жизни до 60 лет, длительность активной эпилепсии – от 2 до 47 лет. Обследование включало клинический и неврологический осмотр, рутинную ЭЭГ и/или ЭЭГ-видеомониторинг, МРТ головного мозга, лабораторные анализы. Катамнез сроком от 1 года до 5 лет (в среднем 3 года) был отслежен у 110 больных. Всем пациентам была назначена впервые или подвергнута коррекции текущая терапия антиэпилептическими препаратами (АЭП). Эффективность лечения оценивалась на основании дневников приступов, самостоятельно заполняемых больными. Ремиссия была констатирована при полном отсутствии приступов за все время катамнестического наблюдения, улучшение – при снижении частоты приступов на 50% и более, в остальных случаях терапия расценивалась как неэффективная.
Результаты и обсуждение
ВЭ была диагностирована у 1/4 обследованных пациентов (136 из 536). Следует отметить, что реальная распространенность различных форм ФЭ в популяции не может быть оценена вследствие недостаточной информативности используемых в настоящее время диагностических методик или противоречия полученных с их помощью данных клинической картине приступов. В нашем исследовании ФЭ с неустановленной локализацией зоны начала приступов были констатированы у 296 пациентов из 536. Можно предположить, что у ряда пациентов из этой группы в действительности имела место нераспознанная по вышеуказанным причинам ВЭ.
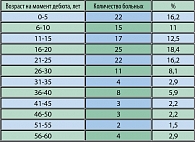
У 82,4% обследованных дебют заболевания приходился на 3 первых десятилетия жизни (таблица 1).
Согласно авторитетному мнению ряда экспертов, эпилепсия дебютирует до 16 лет в 75% случаев (1). По нашим данным, пик заболеваемости ВЭ приходится на 2-е десятилетие жизни. Объяснением этому может служить, с одной стороны, то, что больные с тяжелыми органическими поражениями головного мозга и дебютом резистентной ФЭ в младенческом и раннем детском возрасте не попадают в поле зрения «взрослых» эпилептологов вследствие смерти или глубокой инвалидизации, с другой – более тщательным обследованием лиц подросткового возраста в связи с призывом на военную службу или началом профессиональной деятельности.
Начало заболевания с фебрильных судорог (ФС), характерное для МВЭ с ГС, отмечалось лишь у 7 (5,1%) пациентов. Нельзя исключить, что реальная распространенность ФС среди обследованных была более высокой, однако в ряде случаев пациенты и/или их родители не знали или забывали о связанных с гипертермией приступах, произошедших в раннем детском возрасте, начиная отсчет заболевания с появления драматических афебрильных припадков.
Взаимосвязь ФС с ГС, впервые описанная M. Falconer в 1971 г. как причинно-следственная, и в настоящее время остается не до конца изученной, так, лишь у 2/3 пациентов с МВЭ с ГС в анамнезе имеются указания на ФС, а экспериментальные приступы у животных, спровоцированные гипертермией, не ведут к развитию ГС (3, 4, 6, 7, 11). По нашему мнению, атипичные ФС в анамнезе у лиц с МВЭ следует считать спровоцированными лихорадкой эпилептическими приступами, с которых дебютирует данная форма заболевания, превращаясь, после длительного латентного периода, в резистентную фокальную эпилепсию с афебрильными пароксизмами.
Начало приступов с ауры отмечалось у 62 (45,6%) больных. Согласно данным J. French и соавт. (1993), при МВЭ с ГС аура встречается более чем в 90% случаев. Наиболее частым ее видом является трудноописываемое висцеральное ощущение в эпигастральной области, затем «поднимающееся» к голове («восходящее эпилептическое ощущение»). Другой типичный вид ауры при МВЭ с ГС – кратковременный (обычно не более секунды) страх. Реже встречаются ощущения déjà vu, jamais vu, макро- и микропсия, обонятельные галлюцинации, деперсонализация (7). В ряде случаев аура не имеет аналогов в предшествующей жизни, и больные затрудняются ее описать. Одновременное вовлечение в приступ различных областей височной доли объясняет схожесть аур при разных формах ВЭ, тем не менее среди пациентов с «чистой» МВЭ отсутствуют составляющие ауру ЛВЭ слуховые, сложные зрительные галлюцинации, а также головокружение (13).
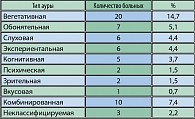
Все многообразие предприступных ощущений, описываемых больными, было разделено нами на когнитивные (насильственно возникающие мысли, воспоминания), экспериентальные (основанные на ранее пережитом, к ним относятся ощущения déjà vu, jamais vu и т.д.), зрительные, слуховые, обонятельные, психические (экстаз, страх, дереализация), вегетативные (жар, неприятные ощущения, дискомфорт, тошнота, потливость), комбинированные (сочетание нескольких ощущений одновременно, например déjà vu и жар, запах и дереализация), а также неклассифицируемые ауры (ощущение приближения приступа, описать которое пациент не может) (таблица 2).
Низкая, относительно данных литературы, частота выявления ауры в нашем исследовании может объясняться ее ретроградной амнезией, на что указывает, в частности, J. Engel (1989), описывающий подобный феномен у больных ВЭ и отмечающий, что ретроградная амнезия ауры порождает неправильное суждение о характере приступов (5). Наиболее типичными видами ауры были различные вегетативные проявления, включающие, помимо «восходящего эпилептического ощущения», целый ряд трудноописуемых феноменов в виде жара, дискомфорта, приливов, потливости, тошноты. Клиническая практика показывает, что в некоторых случаях врачи, регулярно спрашивая больных о «предвестниках приступов» провоцируют последних на «обнаружение» у себя тех или иных предприступных ощущений, отсутствующих в действительности. Это требует относиться к сведениям, сообщаемым пациентами, с определенной долей скептицизма. Следует различать предприступные дисфорические расстройства и/или изменения общего самочувствия больных от собственно ауры, так как первые, очевидно, не имеют существенного локализационного значения при ФЭ.
По мнению А. Ray и Р. Kotagal (2005), возрастная эволюция приступов при ВЭ отмечается до 10-летнего возраста, когда клиническая картина становится неотличимой от взрослых. У детей до 3 лет преобладают тонические и клонические моторные проявления, затем приступы носят обычно гипокинетический характер, частота встречаемости аутомоторных приступов при этом неуклонно нарастает с возрастом (12).
В нашем исследовании у 99 обследованных (72,8%) констатировалось сочетание фокальных и вторично генерализованных приступов, изолированные фокальные или вторично генерализованные пароксизмы встречались соответственно у 20 (14,7%) и у 17 (12,5%) пациентов. Среди разных видов фокальных приступов большинство составляли диалептические – у 38 больных (27,9%) и аутомоторные – у 44 (32,3%). Диалептические приступы представляют собой застывание, взгляд в одну точку (starring) и расширение зрачков. Если приступы заканчиваются на этом, их нередко путают с абсансами (височные абсансы). Уровень сознания во время подобных пароксизмов может флюктуировать. Клиническая практика показывает, что подобные эпизоды часто не осознаются больными как эпилептические приступы, и для их выявления необходим целенаправленный расспрос.
Аутомоторные приступы, как правило, являются продолжением диалептических и проявляются ороалиментарными (облизывание губ, чмоканье, жевание и т.д.) или двигательными автоматизмами (жестикуляция, ощупывание и перебирание предметов). Иногда автоматизмы имеют вид осмысленной реакции на происходящее (приготовление пищи, мытье посуды), также отмечается вокализация, плевание, педалирующие движения ногами (последнее нередко встречается и при приступах из лобной доли) (16). Среди обследованных больных наиболее часто наблюдались ороалиментарные автоматизмы (включая иктальную вокализацию) – у 14 (10,3%), пароксизмы, имитирующие осмысленную деятельность, – у 11 (8,1%), двигательные автоматизмы – у 7 (5,1%). У 12 (8,8%) пациентов аутомоторные приступы носили сложный характер, представляя собой сочетание ороалиментарных автоматизмов с моторными феноменами или имитацией осмысленных движений.
Височные синкопы, характерные для МВЭ с ГС, эпилептические приступы, имитирующие классические ваго-вазальные обмороки – встречались лишь у 4 (2,9%) обследованных.
При приступах, начинающихся в височных долях мозга, может наблюдаться распространение иктальной активности на сопредельные корковые области с развитием соответствующих приступных проявлений (впрочем, подобный феномен описан и для любых других форм ФЭ). Среди обследованных вовлечение в приступ лобных долей отмечалось у 5 (3,7%) пациентов, что клинически проявлялось гиперкинетическими приступами – у 2 больных, фокальными моторными клоническими – у 1, тоническими – у 1 и сенсорными джексоновскими – у 1. Распространение патологического возбуждения на затылочные доли констатировалось у 4 (2,9%) пациентов, что во всех случаях проявлялось элементарными зрительными галлюцинациями. У 1 больного иктальная боль знаменовала вовлечение в приступ теменных долей мозга. Приступные феномены, характерные для экстратемпоральных очагов эпилепсии, могут служить причиной ошибок в диагностике локализационной формы ФЭ, что категорически недопустимо у пациентов – кандидатов на нейрохирургическое лечение. Кроме того, различные направления распространения патологической иктальной активности от приступа к приступу у одного и того же больного могут привести к ошибочному мнению о наличии у такого пациента мультифокальной эпилепсии. Очевидно, что при недостаточной информативности инструментального исследования следует обращать особенно пристальное внимание на клинические особенности приступов: в пользу ВЭ говорит наличие специфической ауры, характерная кинематика аутомоторных пароксизмов, наличие постиктальной спутанности, прогрессирующие мнестические нарушения.
Прекращение приступов на период, в несколько раз превышающий обычный межприступный интервал (но составляющий не менее 6 месяцев), с последующим рецидивом – нетерминальная ремиссия (НТР) – наблюдалось в анамнезе у 14 (10,3%) пацентов. Однако лишь у 6 из них НТР была следствием назначения или коррекции терапии АЭП. Во всех остальных случаях прекращение приступов у больных было спонтанным. Самопроизвольные НТР у больных с ФЭ были описаны С. Spooner и соавт. (2006), которые при длительном катамнестическом наблюдении 62 детей с впервые выявленной ВЭ у 15 (24,2%) из них констатировали в общей сложности 22 НТР длительностью от 1 года до 7 лет (15). Феномен НТР является весьма типичным для МВЭ с ГС, при которой, вслед за ФС, происходящими в раннем детстве, после длительного «немого» периода, занимающего около 10 лет, в подростковом или раннем взрослом возрасте приступы рецидивируют, и формируется резистентный к лечению эпилептический синдром (7, 10). Однако в нашем исследовании вышеописанный патоморфоз приступов отмечался лишь у 2 из 8 больных. В остальных случаях было констатированно самопроизвольное прекращение афебрильных приступов, причем у 3 пациентов из 6 ремиссия наступала в младшем школьном возрасте, а рецидив – в возрастном интервале 16-19 лет. Можно предположить, что прекращение приступов у детей 5-10 лет обусловлено процессами созревания головного мозга, так, по данным R. Jacobs и соавт. (2007 г.), повреждения головного мозга, полученные в среднем детском возрасте, отличаются наиболее благоприятным прогнозом, что объясняется большими возможностями для компенсации в этот период, характеризующийся пиком синаптогенеза и развитием дендритного дерева (8). С другой стороны, период отсутствия приступов, называемый также латентным периодом или периодом эпилептогенеза, очевидно характеризуется множественными структурными и функциональными изменениями в веществе мозга, которые не могут быть изучены у людей. Это объясняется тем, что для анализа обычно доступны лишь удаленные на операции ткани мозга у больных с уже сформировавшейся резистентной эпилепсией (9).
По результатам ЭЭГ отсутствие патологических изменений было констатировано у 33 пациентов (24,3%), региональное замедление в височных областях выявлялось у 22 (16,2%), фокальная эпилептиформная активность той же локализации – у 75 (55,1%) пациентов, нелокализованная эпилептиформная активность – у 6 (4,4%).
Проведение ночного ЭЭГ-видеомониторинга позволило выявить эпилептиформную активность в височных отведениях у 26 больных из 27, у 3 пациентов в процессе исследования были зарегистрированы ночные эпилептические приступы.
Согласно авторитетному мнению M. Brodie и S. Schachter (2001), информативность рутинной ЭЭГ у взрослых не достигает 50% (2). В нашем исследовании патология по данным рутинной ЭЭГ обнаруживалась у 3/4 пациентов, что, возможно, объясняется длительным течением заболевания и высокой частотой приступов у большинства обследованных. Подтверждением диагноза ВЭ может служить, помимо типичной эпилептиформной активности, и региональное замедление в височных отведениях.
МРТ не обнаружило патологических изменений головного мозга у 50 пациентов (36,8%), неэпилептогенные изменения (гидроцефалия, ретроцеребеллярные кисты и т.д.) были диагностированы у 17 (12,5%), умеренно эпилептогенные (постинсультные и посттравматические кисты, очаги глиоза и т.д.) – у 42 (30,9%), высокоэпилептогенные – у 14 (10,3%), в т.ч. гиппокампальный склероз – у 8 (5,9%).
Можно предположить, что реальная распространенность ГС среди обследованных больных существенно выше. Клиническая практика показывает, что у пациентов с резистентной ФЭ в значительном числе случаев нейровизуализация не обнаруживает имеющихся эпилептогенных повреждений, что связано, в первую очередь, с недостаточной подготовкой нейрорентгенологов в области эпилептологии. На это указывают, в частности, J. Van Oetzen и соавт. (2002 г.), по данным которых около 60% больных с резистентной ФЭ получают ложноотрицательные заключения (17).
В результате обследования криптогенная ВЭ была диагностирована у 82 (60,3%) больных, симптоматическая – у 54 (39,7%) пациентов. Среди различных локализационных форм ВЭ преобладала МВЭ – у 75 (55,1%) больных, ЛВЭ констатировалась у 17 (12,5%), у 44 (32,3%) пациентов точное отнесение очага эпилепсии к мезиальной или латеральной височной коре было невозможным.
Семейный анамнез по эпилепсии был отягощен у 6 больных (4,4%), причем у 2 из них наличие эпилепсии у родственников сочеталось с ГС по данным нейровизуализации, ФС в анамнезе и «классической» клинической картиной МВЭ, что позволяет предположить у этих пациентов одну из редких форм идиопатической фокальной эпилепсии – семейную МВЭ.
В результате назначения или коррекции терапии АЭП по результатам катамнестического наблюдения ремиссия была констатирована у 31 (28,2%) пациентов, улучшение – у 36 (32,7%), отсутствие эффекта – у 43 (39,1%). Согласно авторитетному мнению ведущих мировых экспертов, препаратами первой очереди выбора для лечения височной эпилепсии являются карбамазепин и окскарбазепин. По нашему мнению, лечение ВЭ целесообразно начинать с окскарбазепина (Трилептал®), который отличается от карбамазепина достоверно лучшей переносимостью и меньшим потенциалом межлекарственных взаимодействий при сопоставимой эффективности. Титрование дозы Трилептала мы рекомендуем начинать с 600 мг с последующим увеличением на 600 мг через каждые 7 дней по приведенной ниже схеме (таблица 3).
Эффективная доза Трилептала у взрослых составляет 600-2400 мг/сут., по нашим данным, выраженный клинический эффект наблюдается при приеме 600-1200 мг/сут. у большинства пациентов.
С отсутствием эффекта от терапии коррелиловали эпилептогенные изменения мозга по данным МРТ (r = 0,28; p < 0,05), а также большая продолжительность заболевания (r = 0,2; p < 0,05). Принадлежность пациента к определенной локализационной форме ВЭ (МВЭ или ЛВЭ), а также возраст дебюта заболевания, частота приступов, наличие и характер патологических изменений на ЭЭГ не оказывали статистически значимого влияния на исход лечения (p > 0,05).
Выводы и заключение
ВЭ является самой распространенной формой ФЭ у взрослых, причем в клинической практике наиболее часто встречаются пациенты с криптогенной ВЭ, дебютировавшей на 2-м десятилетии жизни.
Классические признаки МВЭ с ГС – ФС в анамнезе, а также ГС по данным МРТ были выявлены нами лишь у 7 и 8 пациентов соответственно, что, очевидно, является следстием невозможности сбора полноценного анамнеза у взрослых пациентов, пришедших на прием без родителей, а также недостаточной информативностью использующихся в настоящее время методов нейровизуализации.
Предшествующая приступам аура была выявлена у 45,6% обследованных, причем наиболее часто пациенты описывали «восходящее эпилептическое ощущение» и другие вегетативные феномены (жар, тошноту, неприятные ощущения в теле и т.д.). У 7,4% больных аура носила сложный характер, представляя собой комбинацию вегетативных ощущений со слуховыми и зрительными галлюцинациями или ощущением déjà vu.
В подавляющем большинстве случаев у взрослых с ВЭ заболевание проявляется сочетанием вторично генерализованных и фокальных (парциальных) приступов, среди последних преобладают аутомоторные – у 32,3% и диалептические – у 27,9%. Точная верификация имеющихся типов приступов должна базироваться, помимо опроса пациентов, на результатах их видеофиксации (наиболее предпочтительно – при проведении видео-ЭЭГ-мониторинга).
Наблюдающееся у ряда больных с ВЭ самопроизвольное длительное прекращение приступов – нетерминальная ремиссия – должно настораживать лечащего врача в отношении возможности рецидива приступов, наиболее часто приходящегося на юношеский возраст.
Повторные регистрации рутинной ЭЭГ позволяют выявить эпилептиформную активность у пациентов с ВЭ в 3/4 случаев, при этом чем в более раннем возрасте сделана запись, тем больше вероятность выявления патологических изменений, что является следствием преобладания возбуждения над торможением в развивающемся мозге ребенка. При неинформативности рутинной ЭЭГ наиболее целесообразно направление больных на ночной видео-ЭЭГ-мониторинг, обладающий наибольшей информативностью в отношении выявления эпилептиформной активности и ее клинических коррелятов.
Эпилептогенные структурные изменения головного мозга в нашем исследовании выявлялись менее чем у 1/2 больных и служили предиктором отсутствия эффекта от терапии АЭП. Очевидно, что по мере совершенствования методик нейровизуализации все большее число случаев ВЭ будет относиться к разряду симптоматических, однако для суждения об эпилептогенности обнаруженных изменений необходимо, помимо знания их морфологии, получение новых данных о патогенезе симптоматических ФЭ.
Медикаментозная ремиссия среди включенных в исследование пациентов была достигнута лишь в 28,2% случаев, что подтверждает мнение о том, что ВЭ не только самая распространенная форма ФЭ у взрослых, но и одна из самых труднокурабельных. Очевидно, что повысить эффективность лечения ВЭ позволит своевременное направление медикаментозно резистентных пациентов на хирургическое лечение, позволяющее, при условии правильного отбора кандидатов на оперативное вмешательство, добиться прекрасных результатов в 60-80% случаев.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.