Клинико-иммунологическая эффективность применения иммуномодулятора галавит у больных немелкоклеточным раком
- Аннотация
- Статья
- Ссылки







Накопленные многочисленные данные свидетельствуют о том, что одним из важных факторов, определяющих высокий риск развития рака легкого, является иммуносупрессия (5).
Немелкоклеточный рак легкого представляет собой морфологически неоднородную группу, включающую в основном плоскоклеточный рак (70-75%), аденокарциному (20-25%) различной дифференцировки и другие редкие формы рака. Они объединены в одну группу немелкоклеточного рака по органному принципу и близким отдаленным результатам. Единственным радикальным методом лечения немелкоклеточного рака легкого остается хирургический (2). В настоящее время основной контингент больных, подвергающихся хирургическому лечению – это больные с II–III стадией опухолевого процесса. При проведении хирургического лечения у больных немелкоклеточным раком легкого одним из осложнений является пневмония, которая чаще встречается у пациентов старше 60 лет (8,4%) по сравнению с возрастной группой моложе 60 лет (1,6%). Летальность при этом осложнении по различным литературным данным составляет до 66,7%.
Оперативное вмешательство и развивающиеся в послеоперационном периоде осложнения приводят к значительной иммуносупресии. Целью данной работы явилось исследование клинико-иммунологической эффективности применения иммуномодулятора Галавит у больных немелкоклеточным раком легкого II-III стадии в послеоперационном периоде.
Материалы и методы
Препарат Галавит представляет собой производное аминофталгидразида, он обладает выраженным противовоспалительным и иммуномодулирующим действием. С 1997 года препарат разрешен к клиническому применению приказом МЗ РФ (3). Курсовая доза Галавита составляет 2000 мг (8). Дизайн исследования: препарат применяем в дозе 100 мг внутримышечно в течение 3-х дней до хирургического вмешательства, включая день операции, в течение 2-х дней после операции и далее каждые 3 дня до 51-х суток после операции (таблица 1).
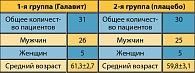
Больные были обследованы рандомизированным двойным слепым плацебо-контролируемым методом. В исследование был включен 61 пациент, находившийся на лечении в хирургическом торакальном отделении НУЗ ЦКБ №2 им. Н.А. Семашко ОАО «РЖД» в период с 2000 по 2004 гг. Диагноз «плоскоклеточный рак легкого» был верифицирован до оперативного лечения. Рандомизация больных осуществлялась путем распределения в основную группу (Галавит) и группу сравнения (плацебо) по четным и нечетным годам рождения пациентов, отобранных для исследования.
Характеристика групп пациентов, включенных в исследование, представлена в таблице 2.
В зависимости от распространенности опухолевого процесса хирургическое лечение производилось в различных объемах (таблица 3), однако частота применения разных видов операций в сравниваемых группах практически не различалась.
Иммунный статус пациентов в обеих группах оценивался до оперативного лечения, на 1-е и 51-е сутки после операции. Сравнительному анализу подвергались абсолютное и относительное содержание CD3, CD4, CD8, CD16, CD20, HLA-DR-лимфоцитов, а также содержание IgA, IgM, IgG-иммуноглобулинов (6,1).
Результаты исследования и их обсуждение
При сравнительном анализе результатов иммунологического исследования у всех пациентов непосредственно перед началом лечения выявляли значительное снижение относительного содержания CD3, CD4, CD8, CD20 – лимфоцитов, CD16 клеток и HLA-DR – лимфоцитов.
У пациентов группы сравнения, получавших плацебо, непосредственно перед операцией абсолютное содержание лимфоцитов составило 2100 ± 180 кл /мкл крови. Относительное содержание CD3 , CD4, CD8, CD16, CD20, HLA-DR лимфоцитов в крови представлены в таблице 4 .
В первые сутки после хирургического вмешательства у пациентов второй группы, получавших плацебо, как и первой группе, получающей Галавит, наблюдали увеличение дефицита относительного содержания HLA-DR и CD20, CD4 лимфоцитов. При сравнении полученных данных с показателями иммунограмм, полученных на 51-е сутки после хирургического лечения, достоверных различий средних величин значений абсолютного и относительного содержания субпопуляций лимфоцитов у больных данной группы по сравнению с результатами первых суток выявлено не было, что отражено в представленных данных таблицы 4. При проведении индивидуального анализа результатов больных отмечена нормализация показателей лишь у части больных данной группы: CD3 у 6 больных (20%); CD4 у 9 больных (30%); CD8 у 9 больных (30%); CD16 у 7 больных (23,3%); CD20 у 11 больных (36,6%); HLA-DR у 18 больных (60%).
При анализе содержания сывороточных иммуноглобулинов до операции у пациентов второй группы, получавших плацебо, так же, как и в первой группе, получавшей Галавит, отмечено значительное увеличение IgA, незначительное увеличение IgG и снижение IgM по отношению к норме (таблица 5).
При анализе изменения содержания сывороточных иммуноглобулинов в первые сутки после оперативного вмешательства достоверных различий выявлено не было по сравнению с предыдущим наблюдением в данной группе пациентов.
На 51-е сутки после хирургического лечения отмечено достоверное снижение среднегрупповых показателей IgA до 243 ± 12 (р≤0,05), содержание же IgM по сравнению с предыдущей иммунограммой, равно как и содержание IgG, достоверно не изменилось. Однако у небольшого числа пациентов отмечена нормализация показателей: IgA – у 3-х больных (10%); IgM – у 6 больных (20%); IgG – у 18 больных (60%).
В первой группе пациентов, получавших Галавит непосредственно перед операцией, абсолютное содержание лимфоцитов в среднем составило 2400 ± 190 кл/мкл крови, что не отличалось от средних значений показателей больных группы сравнения. Относительное содержание субпопуляций лимфоцитов представлено в таблице 6.
На первые сутки после хирургического вмешательства у пациентов первой группы, получавших Галавит, наблюдали отсутствие существенных изменений в соотношении фенотипов клеток по сравнению с исходными данными.
При последующем исследовании иммунного статуса, на 51-е сутки после оперативного вмешательства, были выявлены существенные изменения. Так, зарегистрировано значительное увеличение относительного и абсолютного содержания NK-клеток (CD16) и нормализация других субпопуляций лимфоцитов в среднем по группе (таблица 6). При этом нормализация показателей отмечена у большинства больных данной группы: CD3 – у 28 больных (90,3%); CD4 – у 25 больных (80,6%); CD8 – у 17 больных (54,8%); CD16 – у 14 больных (45,2%); CD20 – у 19 больных (61,3%); HLA-DR – у 20 больных (64,5%).
При оценке уровня сывороточных иммуноглобулинов до операции у пациентов первой группы при применении Галавита выявлено увеличение содержания IgA , содержание же IgM и IgG было снижено (таблица 7). На первые сутки после хирургического вмешательства у пациентов первой группы больных, получавших Галавит, содержание IgA оставалось повышенным и составляло 332 ± 10, содержание IgM и IgG продолжало оставаться ниже нормы: 122 ± 13 и 126 ± 11 соответственно.
В дальнейшем, на 51-е сутки после хирургического лечения, отмечали нормализацию содержания всех трех классов сывороточных иммуноглобулинов: IgA – у 25 больных (80,6%); IgM – у 28 больных (90,3%); IgG – у 26 больных (83,9%).
Сравнение положительных изменений показателей иммунного статуса у больных разных групп на 51-й день после операции представлены в таблице 8.
В процессе исследования отмечено, что в группе больных, получавших плацебо, пневмония, являющаяся одним из грозных осложнений хирургического лечения рака легкого, возникала в 68,9% случаев, причем её длительность в среднем составила 10-12 дней на фоне антибактериальной терапии. В группе больных, получавших Галавит, пневмония была констатирована только у 25,8% пациентов, т.е. наблюдалась в 2,5 раза реже и купировалась в среднем за 5-7 дней (в два раза реже) на фоне аналогичной антибактериальной терапии.
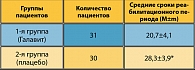
Большое значение в лечении рака легкого имеет длительность реабилитационного периода – время от момента оперативного вмешательства до выписки из стационара (таблица 9).
Полученные результаты позволяют сделать вывод о том, что включение в комплексное лечение больных в послеоперационном периоде препарата Галавит позволяет достоверно (р <0,05) сократить длительность реабилитационного периода.
Заключение
Таким образом, при использовании иммуномодулятора Галавит в комплексной терапии у больных с II–III стадией немелкоклеточного рака легкого после оперативного лечения на фоне применяемой стандартной терапии, значительно чаще наблюдается нормализация показателей клеточного и гуморального иммунитета, более чем вдвое уменьшается частота возникновения послеоперационных осложнений, что положительно влияет на течение послеоперационного и реабилитационного периодов, а следовательно и на качество жизни пациентов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.