Предикторы непосредственной эффективности неоадъювантной иммунохимиотерапии у больных операбельными формами немелкоклеточного рака легкого. Данные реальной клинической практики НМИЦ онкологии им. Н.Н. Блохина
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить непосредственные результаты применения неоадъювантной иммунохимиотерапии (ИХТ) у больных операбельными формами НМРЛ.
Материал и методы. В анализ включены 60 больных операбельными формами НМРЛ IB–IIIB стадий (TNM8), получавших комбинированное лечение с 2019 по 2023 г. в объеме предоперационной лекарственной терапии с последующим хирургическим вмешательством в условиях НМИЦ онкологии им Н.Н. Блохина. Исследуемый режим лекарственной терапии заключался в проведении трех курсов комбинированного лечения по схеме: пембролизумаб 200 мг + платиносодержащая ХТ на выбор исследователя, 1 раз в 21 день. В последующем все пациенты были подвергнуты радикальному хирургическому вмешательству с обязательным патоморфологическим исследованием операционного материала. В рамках работы оценивалась частота достижения большого и полного патоморфологических ответов, проанализировано влияние исходных клинико-морфологических характеристик на результаты лечения.
Результаты. Частота достижения полного патоморфоза среди всех пациентов составила 41,7% (25/60), большой патоморфологический ответ был достигнут в 60% (36/60) наблюдений. Достоверное преимущество в отношении частоты больших патоморфозов отмечено у больных с позитивным статусом курения (66,7%; p = 0,0049). Тенденция к более высоким показателям также наблюдалась у пациентов с отсутствием драйверных мутаций (62,8%, p = 0,0607). Различия в частоте достижения патоморфологических ответов в зависимости от стадии заболевания и уровня экспрессии PD-L1 не достигли статистической значимости.
Заключение. Предоперационное применение ИХТ демонстрирует высокую непосредственную эффективность, подтверждая целесообразность рассмотрения данного подхода в качестве нового стандарта лечения, в первую очередь для пациентов с отсутствием драйверных мутаций и положительным статусом курения. Выявленные закономерности требуют дальнейшего изучения, в том числе анализа отдаленных результатов.
Цель – оценить непосредственные результаты применения неоадъювантной иммунохимиотерапии (ИХТ) у больных операбельными формами НМРЛ.
Материал и методы. В анализ включены 60 больных операбельными формами НМРЛ IB–IIIB стадий (TNM8), получавших комбинированное лечение с 2019 по 2023 г. в объеме предоперационной лекарственной терапии с последующим хирургическим вмешательством в условиях НМИЦ онкологии им Н.Н. Блохина. Исследуемый режим лекарственной терапии заключался в проведении трех курсов комбинированного лечения по схеме: пембролизумаб 200 мг + платиносодержащая ХТ на выбор исследователя, 1 раз в 21 день. В последующем все пациенты были подвергнуты радикальному хирургическому вмешательству с обязательным патоморфологическим исследованием операционного материала. В рамках работы оценивалась частота достижения большого и полного патоморфологических ответов, проанализировано влияние исходных клинико-морфологических характеристик на результаты лечения.
Результаты. Частота достижения полного патоморфоза среди всех пациентов составила 41,7% (25/60), большой патоморфологический ответ был достигнут в 60% (36/60) наблюдений. Достоверное преимущество в отношении частоты больших патоморфозов отмечено у больных с позитивным статусом курения (66,7%; p = 0,0049). Тенденция к более высоким показателям также наблюдалась у пациентов с отсутствием драйверных мутаций (62,8%, p = 0,0607). Различия в частоте достижения патоморфологических ответов в зависимости от стадии заболевания и уровня экспрессии PD-L1 не достигли статистической значимости.
Заключение. Предоперационное применение ИХТ демонстрирует высокую непосредственную эффективность, подтверждая целесообразность рассмотрения данного подхода в качестве нового стандарта лечения, в первую очередь для пациентов с отсутствием драйверных мутаций и положительным статусом курения. Выявленные закономерности требуют дальнейшего изучения, в том числе анализа отдаленных результатов.




Введение
Немелкоклеточный рак легкого (НМРЛ) – крайне агрессивное заболевание, характеризующееся высокой митотической активностью и ранним метастазированием. Лишь в 20–30% случаев впервые выявленного НМРЛ возможно проведение потенциально излечивающей операции [1]. При этом впоследствии в 30–55% наблюдений диагностируется рецидив заболевания, зачастую в виде отдаленного метастазирования, преимущественно в первые два года после радикального вмешательства, что указывает на необходимость системного воздействия [2–4].
Длительное время основным методом системного лечения являлась цитотоксическая терапия с включением препаратов платины, продемонстрировавшая скромное улучшение отдаленных результатов. Проведение адьювантной химиотерапии (ХТ), по данным метаанализа исследования LACE, позволило увеличить 5-летнюю выживаемость на 5,4% [5]. Сопоставимые результаты были получены при изучении предоперационного подхода. При метаанализе 15 рандомизированных исследований абсолютное возрастание пятилетней выживаемости достигло 5%, а снижение относительного риска смерти составило 13% [6]. Проведение неоадъювантной ХТ не сопровождалось увеличением частоты послеоперационных осложнений и смертности, а в ряде случаев приводило к уменьшению объема опухоли и, соответственно, к повышению резектабельности и частоты R0 резекций. Перенос системного лечения на предоперационный этап также позволяет напрямую оценить чувствительность опухоли к проведенной терапии, что важно для последующего выбора оптимальной тактики лечения [7]. Достижение полного (pCR, отсутствие остаточной инвазивной опухоли) и большого патоморфологического ответов (MPR, наличие ≤ 10% жизнеспособных опухолевых клеток) после проведенной предоперационной ХТ достоверно и значительно снижает риск прогрессирования. Так, в рамках проведенного метаанализа 33 исследований отношение рисков (ОР) составило 0,49 (95% CI 0,43–0,56) для общей выживаемости (ОВ) и 0,50 (95% доверительный интервал (ДИ) 0,40–0,62) для бессобытийной выживаемости (БСВ) в зависимости от достижения pCR. Схожие результаты были получены для статуса MPR [8]. Медианная частота достижения pCR в исследованиях неоадъювантной ХТ составила 4% (размах 0–16), что говорит об ограниченной противоопухолевой эффективности стандартной цитотоксической терапии [9].
Следующий этап совершенствования стратегии комбинированного подхода стал возможен благодаря развитию двух стратегических направлений – молекулярно-направленной терапии и иммуноонкологии. Открытие фундаментального механизма «ускользания» опухоли от иммунитета в результате активации пути PD1/PD-L1 привело к разработке препаратов, блокирующих «контрольные точки иммунного ответа» (анти-PD1 и анти-PD-L1 МКА) [10]. Исследования показали, что применение иммунотерапии (ИТ) может позволить иммунной системе реализовывать выраженный длительный противоопухолевый ответ как в рамках паллиативного лечения диссеминированных форм [11, 12], так и в качестве консолидирующего лечения больных нерезектабельным НМРЛ после химиолучевой терапии (PACIFIC) [13]. Последующая интеграция анти-PD1/PD-L1 препаратов в адъювантный поход также продемонстрировала улучшение отдаленных результатов у пациентов с НМРЛ II–IIIA стадий с PD-L1 TC ≥ 50%, перенесших радикальную операцию с последующей адъювантной ХТ [14].
Все вышеперечисленное послужило основанием для проведения ряда исследований, посвященных изучению безопасности и эффективности предоперационного применения иммунотерапии. Так, в исследовании Checkmate 816 [15, 16] была оценена роль добавления ниволумаба к стандартной неоадъювантной платиносодержащей ХТ у больных первично-резектабельным НМРЛ IB–IIIA стадий, со статусом ECOG 0/1 и с отсутствием альтераций в генах EGFR и ALK. Согласно дизайну исследования 358 пациентов были рандомизированы 1 к 1: в исследовательскую группу пациентов (иммунохимиотерапии – ИХТ), получавших три курса предоперационной платиносодержащей ХТ с включением ниволумаба, и контрольную группу пациентов (ХТ), получавших три курса платиносодержащей ХТ с последующим проведением хирургического вмешательства. В качестве первичной конечной точки выбрана частота достижения полных патоморфозов и БСВ. По результатам исследования проведение комбинированного режима сопровождалось достоверным улучшением непосредственной эффективности. При анализе всей исследуемой популяции частота pCR в группе ИХТ составила 24,0% (43/179) против 2,2% (4/179) в группе ХТ; отношение шансов (ОШ) 13,94 (99% ДИ 3,49–55,75; p < 0,001). Среди пациентов, завершивших запланированный объем лечения, pCR достигло 30,5% (43/141) и 3,2 % (4/126) в группе ИХТ и ХТ соответственно. Частота достижения MPR также была выше в исследовательской группе и составила 36,9% (66/179) в сравнении с 8,9% (16/179) в группе ХТ, ОШ 5,7 (95% ДИ 3,16–10,26; p < 0,001).
Преимущество наблюдалось во всех ключевых подгруппах, однако стоит отметить тенденцию к большей частоте достижения pCR среди пациентов с ранними стадиями, положительной экспрессией PD-L1 и позитивным статусом курения (рис. 1, 2). Анализ отдаленных результатов позволил подтвердить прогностическую роль достижения pCR и MPR после проведенной ИХТ. При минимальном наблюдении в 21 месяц медиана БСВ не достигнута в группах больных с большим и полным патоморфологическим ответом и составила 27,8 месяца у не достигших pCR (HR 0,18 (96% ДИ 0,07–0,46)) и 26,2 месяца у не достигших MPR (HR 0,26 (96% ДИ 0,14–0,50)).
Успехи терапии ниволумабом не могли остаться незамеченными, что вылилось в инициацию целого ряда схожих по дизайну работ, направленных на улучшение выживаемости пациентов за счет интенсификации периоперационной лекарственной терапии (табл. 1). Несмотря на некоторые различия в дизайне и исследуемых препаратах, перечисленные исследования демонстрируют схожий характер улучшения непосредственных результатов комбинированного подхода [17]. Периоперационное проведение ИХТ приводит к достоверному увеличению частоты достижения pCR и MPR. Разница в конкретных значениях может заключаться в преобладании определенных подгрупп пациентов, и тем ценнее данные подгрупповых анализов, которые могут натолкнуть на определенный портрет пациента.
В НМИЦ онкологии им Н.Н. Блохина инициировано схожее с Checkmate 816 по дизайну исследование. Обратимся к его результатам.
Материал и методы
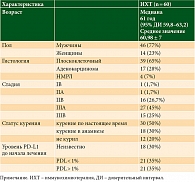
В настоящей работе изучены непосредственные результаты лечения 60 больных операбельными формами НМРЛ IB–IIIB стадий, получавших комбинированное лечение с 2019 по 2023 г. в объеме предоперационной лекарственной терапии с последующим хирургическим вмешательством в условиях НМИЦ онкологии им. Н.Н. Блохина. Подробные характеристики пациентов отражены в табл. 1.
Медиана возраста составила 61 год (95% ДИ 59,8–63,2). В исследовании преобладали пациенты мужского пола (77%). В 80% случаев больные имели позитивный статус курения.
По результатам цитологического (23,3%) и гистологического (76,7%) исследований плоскоклеточный рак был верифицирован в 65% наблюдений, аденокарцинома – в 28%, в 7% был установлен НМРЛ без фенотипа ввиду ограниченного объема материала (в последующем эта группа достигла полного патоморфоза). Мутационный статус исследован в 13 из 17 случаев аденокарцином: альтерация выявлена у девяти пациентов, дикий тип генов имеют четыре. Экспрессия PD-L1 оценена у 42 (70%) пациентов: соотношение PD-L1 ≥ 1 и PD-L1 < 1 составило 1 к 1.
Исследуемый режим лекарственной терапии заключался в проведении трех курсов комбинированной ИХТ по схеме: пембролизумаб 200 мг + платиносодержащая ХТ на выбор исследователя, 1 раз в 21 день. По окончанию неоадъювантной терапии проводилась рентгенологическая оценка эффекта согласно критериям RECIST 1.1. При отсутствии противопоказаний выполнялось радикальное оперативное вмешательство в объеме: анатомическая резекция легкого (лобэктомия 57%, билобэктомия 15%, пневмонэктомия 28%) с систематической ипсилатеральной медиастинальной лимфодиссекцией. Затем проводилась патоморфологическая оценка операционного материала согласно текущим рекомендациям (IASCLC 2020). В рамках работы оценивались непосредственные результаты неоадъювантной терапии в виде частоты достижения pCR и MPR, проводилась оценка процента жизнеспособных опухолевых клеток. Непараметрические данные анализировались с использованием точного критерия Фишера. Различия считали значимыми при p < 0,05.
Результаты
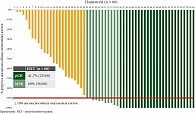
При морфологическом исследовании операционного материала в каждом случае оценивалась глубина патоморфологического ответа в первичной опухоли и лимфоузлах (рис. 3). Частота достижения pCR среди всех пациентов составила 41,7% (25/60), частота MPR достигла 60% (36/60).
Для анализа непосредственных результатов в зависимости от исходных клинико-морфологических характеристик нами были выделены следующие критерии сравнения: клиническая стадия, мутационный статус опухоли, экспрессия PD-L1 и статус курения. Данные по частоте достижения pCR и MPR в сравниваемых подгруппах представлены на рис. 4–11.
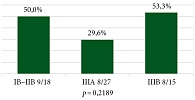
Рисунки 4 и 5 отражают частоту достижения pCR и MPR в зависимости от стадии заболевания. Пациенты были разделены на три подгруппы: IB–II стадии (n = 18), IIIA (n = 27) и IIIB (n = 15).
Наибольшая частота pCR наблюдалась у пациентов с IIIB стадией (53,3%) и IB–IIВ (50%), в то время как восемь больных IIIA стадии (29,6%) достигли полного патоморфологического ответа. Статистический анализ не выявил значимых различий между подгруппами (p = 0,2189). Частота MPR была также выше среди пациентов IIIB (73,3%) и IB–II стадий (67%) и составила 48,1% у больных IIIA стадии (p = 0,2583).
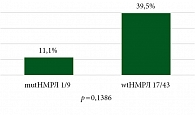
На рис. 6 и 7 представлены данные о частоте достижения pCR и MPR в зависимости от мутационного статуса опухоли. В подгруппу пациентов с диким типом генов (wtНМРЛ, n = 43) были включены больные плоскоклеточным раком легкого (n = 39), а также случаи аденокарциномы с отстуствием альтераций по данным молекулярно-генетического тестирования (n = 4). Драйверные мутации были идентифицированы у девяти больных аденокарциномой легкого, которые были включены в подгруппу mutНМРЛ (n = 9). Пациенты с неустановленным фенотипом НМРЛ (n = 4), а также больные аденокарциномой с неизвестным мутационным статусом (n = 4) были исключены из анализа.
В группе пациентов с диким типом генов частота pCR составила 39,5% (17/43) против 11,1% (1/9) в группе с драйверными мутациями (p = 0,1386); частота MPR в группе wtНМРЛ достигла 62,8% (27/43), что было выше, чем в группе mutНМРЛ 22,2% (2/9). Однако наблюдаемые различия между подгруппами не достигли статистической значимости (p = 0,0607) и мы можем говорить лишь о тенденции к большей частоте достижения MPR среди пациентов с диким типом генов.
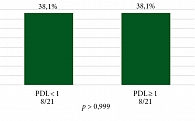
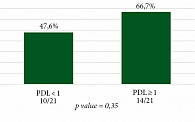
Рисунки 8 и 9 отражают частоту достижения pCR и MPR в зависимости от уровня экспрессии PD-L1. Пациенты были распределены следующим образом: у 21 больного отсутствовала экспрессия PD-L1 в опухоли, в 21 случае выявлен PD-L1 ≥ 1, неизвестный статус маркера был у 18 больных, среди которых четверо имели исходно ограниченный объем материала и в последующем достигли полного патоморфоза. Нами были проанализированы результаты лечения в группах только с известным статусом PD-L1.
Частота достижения pCR в обеих группах составила 38,1% (8/21). Частота MPR была выше в группе с позитивной экспрессией PD-L1 (66,7%, 14/21) и достигла 47,6% (10/21) в группе PD-L1 < 1. Однако наблюдаемые различия не достигли статистической значимости (p = 0,35).
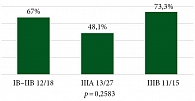
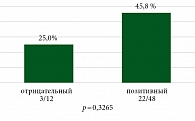
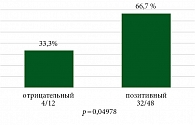
На рис. 10 и 11 представлены данные о частоте достижения pCR и MPR в зависимости от статуса курения. Пациенты были разделены на две группы: с отрицательным 20% (n = 12) и положительным статусом курения 80% (n = 48), что согласовывается с эпидемиологическими данными о больных НМРЛ.
В группе пациентов, которые никогда не курили, частота pCR составила 25,0% (3/12), тогда как в группе курильщиков – 45,8% (22/48), p = 0,3265. В отношении частоты достижения MPR наблюдались статистически значимые различия: частота MPR была выше в группе больных с позитивным статусом курения (66,7%) по сравнению с никогда не курившими пациентами (33,3%), p = 0,04978.
Обсуждение
В рамках проведенного исследования на базе НМИЦ онкологии им. Н.Н. Блохина были получены данные, свидетельствующие о высокой частоте достижения полного (41,7%, 25/60) и большого патоморфологического ответов (60%, 36/60) среди пациентов, получавших неоадьюватную терапию в виде комбинации пембролизумаба с платиносодержащей ХТ с последующим проведением оперативного вмешательства. Эти показатели, в некоторой степени превосходящие данные рандомизированных исследований, подтверждают общую концепцию крайне высокой эффективности периоперационного применения ИХТ.
При углубленном анализе непосредственной эффективности в зависимости от исходных клинико-морфологических характеристик (стадия, мутационный статус, экспрессия PD-L1 и курение) статистически значимых различий в отношении частоты достижения pCR не выявлено. Однако стоит отметить тенденцию к большей частоте достижения pCR среди пациентов с отстуствием драйверных альтераций. Достоверное преимущество в отношении частоты достижения MPR отмечено у больных с позитивным статусом курения (p = 0,0049). Более высокие показатели MPR также наблюдались у пациентов с диким типом генов, однако различия не достигли статистической значимости (p = 0,06). Для уточнения этих закономерностей необходимы дальнейшие исследования.
Выводы
Предоперационное применение ИТ в комбинации со стандартной платиносодержащей ХТ продемонстрировало высокую непосредственную эффективность как в рамках рандомизированных международных исследований, так и по данным анализа наших наблюдений. Данный подход должен стать новым стандартом лечения операбельных форм НМРЛ.
V.A. Kuzmina, Ye.S. Denisova, M.S. Ardzinba, PhD, V.V. Breder, PhD, N.A. Kozlov, PhD, K.K. Laktionov, PhD, P.V. Kononec, PhD, I.S. Stilidi, PhD
N.N. Blokhin National Medical Research Center of Oncology
N.I. Pirogov Russian National Research Medical University
Rosunimed
Russian Medical Academy of Continuous Professional Education
Contact person: Valeriya A. Kuzmina, emerallld@yandex.ru
Perioperative platinum-based chemotherapy provides modest improvement in long-term outcomes following radical surgical treatment in patients with non-small cell lung cancer (NSCLC). Neoadjuvant chemotherapy is associated with a relatively low rate of achieving complete and major pathological response, which are positively correlated with improved long-term outcomes. In recent years, significant progress has been made with the introduction of immuno-oncological agents, particularly checkpoint inhibitors. The success of their application in the treatment of advanced stages of lung cancer, both as monotherapy and in combination with chemotherapy, has laid the foundation for exploring their efficacy in earlier stages of the disease.
Purpose. To evaluate the pathological response to neoadjuvant immunochemotherapy in patients with operable non-small cell lung cancer.
Material and methods. This study included 60 patients with resectable NSCLC (stages IB–IIIB TNM8) who underwent preoperative systemic therapy followed by radical surgical resection between 2019 and 2023 in the N.N. Blokhin National Medical Research Center of Oncology. The neoadjuvant treatment regimen consisted of three cycles of combination therapy: pembrolizumab (200 mg) plus platinum-based chemotherapy, administered every 21 days at the investigator’s discretion. Following neoadjuvant therapy, all patients underwent radical surgical resection with histopathological examination of the resected specimens. The study assessed the rates of major pathological response and complete pathological response and analyzed the impact of baseline clinicopathological factors on treatment outcomes.
Results. The rate of complete pathological response among all patients was 41.7% (25/60), while the major pathological response was achieved in 60% (36/60) of cases. A significant advantage in MPR frequency was observed in patients with a positive smoking status (66.7%; p = 0.0049). A trend towards higher MPR rates was also noted in patients without driver mutations (62.8%; p = 0.0607). Differences in the frequency of pathological responses based on disease stage and PD-L1 expression levels did not reach statistical significance.
Conclusion. Neoadjuvant immunochemotherapy demonstrates high pathological response outcomes, supporting its consideration as a new standard of care for resectable NSCLC, particularly for patients with a positive smoking status and without driver mutations. The identified trends warrant further investigation, including an analysis of long-term outcomes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.