Клинико-нейровизуализационное сопоставление данных диффузионно-тензорной магнитно-резонансной томографии головного мозга и показателей функционирования пациентов в раннем восстановительном периоде острого ишемического инсульта
- Аннотация
- Статья
- Ссылки
- English
Цель – провести клинико-нейровизуализационное сопоставление данных, полученных при неврологическом осмотре, с показателями диффузионно-тензорной магнитно-резонансной томографии (МРТ) головного мозга у пациентов в раннем восстановительном периоде ишемического инсульта.
Материал и методы. В исследование были включены 105 пациентов в возрасте 20–94 лет. В экспериментальную (основную) группу вошли 76 пациентов (41 мужчина и 35 женщин) с двигательным дефицитом после перенесенного церебрального инсульта. Контрольную группу составили 29 пациентов без церебрального инсульта в анамнезе. Всем участникам исследования были проведены клинические и параклинические (МРТ) исследования по единому протоколу. В основной группе средний показатель по шкале NIHSS (National Institutes of Health Stroke Scale) составил 6,0 [3,0–11,0] балла, среднее значение показателей по шкале Рэнкина (Rankin Scale) – 3,0 [1,75–4,25], индекс мобильности Ривермид (Rivermead Mobility Index) – 8,0 [3,75–13,00], индекс ходьбы Хаузера (Hauser Ambulation Index) – 3,0 [1,0–5,0].
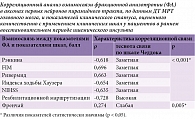
Результаты. В исследовании установлена тесная взаимосвязь между показателями фракционной анизотропии в волокнах центральных нейронов кортикоспинальных трактов, по данным МРТ головного мозга, и клиническими показателями, оцененными с применением указанных количественных шкал: по шкале Рэнкина (в баллах) – 0,618 (заметная теснота связи по шкале Чеддока), по шкале FIM – 0,696 (заметная теснота), по шкале Ривермид – 0,663 (заметная теснота), по шкале NIHSS – -0,635 (заметная теснота), по шкале реабилитационной маршрутизации – -0,728 (высокая теснота связи по шкале Чеддока).
Выводы. Полученные данные указывают на статистически значимые корреляционные связи между показателями, полученными при использовании нейровизуализационных методов, и показателями, полученными при клиническом обследовании. Дальнейшие исследования динамики восстановления двигательных функций пациентов, перенесших ишемический инсульт, с применением диффузионно-тензорной МРТ головного мозга для морфологической оценки целостности кортикоспинальных трактов в совокупности с клиническими показателями являются перспективным направлением для более точного и персонифицированного прогнозирования эффективности реабилитационных мероприятий.
Цель – провести клинико-нейровизуализационное сопоставление данных, полученных при неврологическом осмотре, с показателями диффузионно-тензорной магнитно-резонансной томографии (МРТ) головного мозга у пациентов в раннем восстановительном периоде ишемического инсульта.
Материал и методы. В исследование были включены 105 пациентов в возрасте 20–94 лет. В экспериментальную (основную) группу вошли 76 пациентов (41 мужчина и 35 женщин) с двигательным дефицитом после перенесенного церебрального инсульта. Контрольную группу составили 29 пациентов без церебрального инсульта в анамнезе. Всем участникам исследования были проведены клинические и параклинические (МРТ) исследования по единому протоколу. В основной группе средний показатель по шкале NIHSS (National Institutes of Health Stroke Scale) составил 6,0 [3,0–11,0] балла, среднее значение показателей по шкале Рэнкина (Rankin Scale) – 3,0 [1,75–4,25], индекс мобильности Ривермид (Rivermead Mobility Index) – 8,0 [3,75–13,00], индекс ходьбы Хаузера (Hauser Ambulation Index) – 3,0 [1,0–5,0].
Результаты. В исследовании установлена тесная взаимосвязь между показателями фракционной анизотропии в волокнах центральных нейронов кортикоспинальных трактов, по данным МРТ головного мозга, и клиническими показателями, оцененными с применением указанных количественных шкал: по шкале Рэнкина (в баллах) – 0,618 (заметная теснота связи по шкале Чеддока), по шкале FIM – 0,696 (заметная теснота), по шкале Ривермид – 0,663 (заметная теснота), по шкале NIHSS – -0,635 (заметная теснота), по шкале реабилитационной маршрутизации – -0,728 (высокая теснота связи по шкале Чеддока).
Выводы. Полученные данные указывают на статистически значимые корреляционные связи между показателями, полученными при использовании нейровизуализационных методов, и показателями, полученными при клиническом обследовании. Дальнейшие исследования динамики восстановления двигательных функций пациентов, перенесших ишемический инсульт, с применением диффузионно-тензорной МРТ головного мозга для морфологической оценки целостности кортикоспинальных трактов в совокупности с клиническими показателями являются перспективным направлением для более точного и персонифицированного прогнозирования эффективности реабилитационных мероприятий.

Введение
Инсульт остается второй по значимости причиной смерти и третьей по значимости причиной смерти и инвалидности в совокупности в мире [1]. Более чем у 70% больных в раннем восстановительном периоде после первого инсульта выявляются двигательные нарушения [2]. Постинсультные двигательные нарушения, в частности паралич или парез верхних либо нижних конечностей, наблюдаются примерно у 88% пациентов с инсультом в острой стадии. В долгосрочной перспективе лишь у 12% пациентов отмечается полное функциональное восстановление моторного дефицита [3].
Согласно данным клинических исследований, инвалидность у пациентов, переживших инсульт, снижает качество их жизни как в целом, так и по физическим и психоэмоциональным составляющим. Кроме того, ухудшается качество жизни лиц, осуществляющих уход за больными [4].
Во многих клинических исследованиях оценивали возможности прогнозирования степени нарушения регуляторных функций уже в ранние сроки ишемического инсульта с помощью клинических методик. На основании результатов исследований ряд авторов сделали вывод, что суммарный балл по шкале NIHSS (National Institutes of Healf Stroke Sale) позволяет определить течение заболевания как в остром, так и в отдаленном периоде [5]. Согласно клиническим рекомендациям Минздрава России по ишемическому инсульту и транзиторной ишемической атаке у взрослых 2021 г. [6], обязательны к применению следующие клинметрики: «трехложечная проба», шкала комы Глазго, TOAST, шкала Рэнкина, индекс Ривермид и NIHSS. Помимо этих шкал используются шкала оценки двигательного дефицита Фугл-Майера и Индекс активности в повседневной жизни Бартел. Показатели шкал Фугл-Мейера и NIHSS в остром периоде ишемического инсульта могут быть использованы для построения прогностической модели исхода инсульта [7].
Дополнительными информативными методами морфологической оценки поражения головного мозга на сегодняшний день являются нейровизуализационные методы, позволяющие прогнозировать шансы на восстановление уже в остром периоде. Перспективной представляется оценка структурных изменений корково-спинномозгового пути при возникновении двигательных нарушений у пациентов с ишемическим инсультом [8]. Однако с помощью традиционных протоколов магнитно-резонансной томографии (МРТ) невозможно достоверно оценить целостность белого вещества головного мозга [9]. Сегодня наиболее информативным из нейровизуализационных методов прижизненной оценки проводящих путей головного мозга считается диффузионно-тензорная (ДТ) МРТ [10]. Применение ДТ МРТ при обследовании больных в остром периоде ишемического инсульта помогает понять характер патологического процесса и дополняет имеющиеся данные о возможности прогнозировать течение восстановительного периода ишемического церебрального инсульта у конкретного пациента [11].
Результаты клинических исследований указывают на то, что целостность проводящих путей имеет решающее значение для перспектив восстановления двигательных функций у пациентов, перенесших ишемический инсульт [9]. С помощью ДТ МРТ можно оценить фракционную анизотропию (ФА), степень которой отражает целостность и уровень организации волоконных пучков в мозге [12]. Например, в одном из исследований вовлечение в зону инфаркта заднего бедра внутренней капсулы в первые 12 часов от начала инсульта продемонстрировало наихудшую степень восстановления двигательных функций через три месяца [13].
Ограничение или утрата двигательных функций не только значительно снижает качество жизни пациентов, но и ведет к психоэмоциональным расстройствам. В исследовании Л.С. Хутиевой и соавт. показано, что у пациентов, перенесших ишемический инсульт, симптомы депрессии отмечаются значительно чаще, чем у пациентов без церебрального инсульта в анамнезе [14]. Психоэмоциональные расстройства могут усугубляться тем, что реабилитация пациентов не всегда быстро дает ожидаемые результаты. В связи с этим важно иметь возможность наиболее точно прогнозировать восстановление двигательных функций у пациентов, перенесших инсульт, уже в остром периоде заболевания, чтобы подобрать в каждом конкретном случае необходимую реабилитационную программу.
Цель – провести клинико-нейровизуализационное сопоставление данных, полученных при неврологическом осмотре, с показателями ДТ МРТ головного мозга у пациентов в раннем восстановительном периоде ишемического инсульта.
В статье рассматривается перспектива оценки кортикоспинального тракта (КСТ) с помощью ДТ МРТ для оценки инвалидизации и определения тактики реабилитации пациентов с моторным дефицитом после инсульта.
Материал и методы
В исследование были включены 105 пациентов в возрасте 20–94 лет. Наблюдение проводилось в Клинике Башкирского государственного медицинского университета (Уфа, Россия). Пациенты были разделены на две группы. В экспериментальную (основную) группу вошли 76 пациентов (41 мужчина и 35 женщин) с двигательным дефицитом после перенесенного церебрального инсульта. Контрольную группу составили 29 пациентов без перенесенного церебрального инсульта в анамнезе. Все участники исследования обследовались клинически и параклинически с применением ДТ МРТ на аппарате OPTIMA 360 (GE) с напряженностью магнитного поля 1,5 Т. Использовалась 16-канальная поверхностная квадратическая катушка для головного мозга. Стандартный протокол, согласно клиническим рекомендациям, включал в себя набор программ с получением T1- и T2-взвешенных изображений, а также изображений T2-FLAIR с подавлением сигнала от свободной воды и диффузионно-тензорных изображений с коэффициентами диффузии b0 и b1000 с/мм2.
Трактографию выполняли в 25 направлениях с первичным получением цветовой карты ФА и последующим объемным моделированием КСТ. Реконструкция полученных изображений осуществлялась с помощью пакета рабочих программ Volume Viewer 7. Анализ DTI проводился на рабочей станции AW Volume Share 7 через программное обеспечение READY View. На полученных изображениях оценивались значения ФА, плотность пирамидных трактов, показатели радиальной и аксиальной диффузии, значения среднего коэффициента диффузии.
В клиническом обследовании применялись шкалы NIHHS, индексы ходьбы Хаузера (Hauser Ambulation Index), Ривермид (Rivermead Mobility Index), шкала комы Глазго, шкала Рэнкина (Rankin Scale). Для описательной статистики использовалась программа Excel.
Критерием включения в исследование для пациентов контрольной группы служило подписание информированного добровольного согласия (ИДС) на участие в исследовании, критерием исключения – перенесенный церебральный инсульт в анамнезе или другое заболевание головного мозга, при котором морфологически пострадали пирамидные пути на церебральном уровне. Для основной группы критериями включения были наличие одного или нескольких эпизодов острого нарушения мозгового кровообращения по типу ишемического инсульта в анамнезе в течение 12 месяцев до осмотра, ИДС на участие в исследовании. Общая характеристика включенных в данную выборку пациентов представлена в табл. 1.
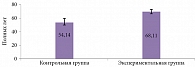
Пациенты основной группы были несколько старше пациентов контрольной (p < 0,001) (рисунок) (используемый метод: t-критерий Уэлча).
Результаты и обсуждение
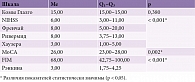
В основной группе церебральный инсульт диагностирован в левом полушарии головного мозга у 36 (47,4%) пациентов, в правом – у 40 (52,6%). Все пациенты находились в ясном (15 баллов по шкале комы Глазго) сознании и дали ИДС на участие в исследовании. При клиническом обследовании выявлены следующие данные: медиана значений по NIHSS в основной группе составила 6, первый квартиль – 3, третий квартиль – 11, по шкале Фрэнчай – 8, первый квартиль – 5, третий – 20, шкале Ривермид – 8, первый квартиль – 3,75, третий – 13, шкале Рэнкина – 3, первый квартиль – 1,75, третий – 4,25. При анализе индекса ходьбы Хаузера медиана значений составила 3 [1,0–5,0], по шкале FIM (Functional Independence Measure) – 68 [42,75–100,00]. Все показатели имели статистически значимые различия (p < 0,001) (используемый метод: U-критерий Манна – Уитни). В исследовании также использовалась Монреальская шкала оценки когнитивных функций (MоCA). Медиана значений составила 26, первый квартиль – 23, третий – 28, что свидетельствует об отсутствии в данной выборке деменции и позволяет использовать данные самооценки состояния пациентом. Клинические характеристики пациентов основной группы (инсульт в каротидном бассейне слева – 36 (47,4%) пациентов, справа – 40 (52,6%) больных) представлены в табл. 2.
После обследования пациентов с оценкой по указанным выше шкалам и проведения МРТ КСТ строились в ручном режиме по зонам интереса как в левом, так и в правом полушарии головного мозга. Был проведен анализ диффузионных метрик в пострадавшем при инсульте и непораженном полушариях головного мозга и определены различия (дельта) показателей между данными ипсилатерального и контралатерального полушарий. Медиана дельты ФА у пациентов основной группы составила 0,97, контрольной – 1,0 (p < 0,001).
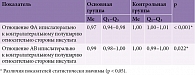
Кроме того, нами рассчитаны отношения показателей ФА в КСТ непораженного и пораженного полушарий (табл. 3).
При оценке связи средней скорости диффузии и ФА в ишемизированном полушарии головного мозга и полушарии, контралатеральном зоне инсульта, установлена прямая связь умеренной тесноты.
Проведен корреляционный анализ взаимосвязи показателей ФА и полученных результатов функционального состояния, оцененного с применением клинических шкал (в баллах). При сопоставлении данных результатов установлена обратная связь заметной тесноты (табл. 4). Это свидетельствует о том, что полученные клинические данные тесно ассоциированы с цифровыми показателями ФА пирамидных путей, по данным ДТ МРТ головного мозга. При выполнении корреляционного анализа взаимосвязи между средней скоростью диффузии, по данным трактографии, и показателями, полученными в результате клинического обследования, не выявлено.
На сегодняшний день диффузионно-тензорная визуализация представляет собой перспективную возможность детальной оценки белого вещества головного мозга, в частности КСТ, и может быть использована в сочетании с клиническими данными для прогнозирования исходов церебрального инсульта. Корреляция результатов клинического и параклинического исследований позволяет точнее предсказать вероятность восстановления двигательных функций у пациентов, перенесших церебральный инсульт, и подобрать персонифицированную тактику реабилитации, особенно в случае массивного перерыва КСТ, когда сложно ожидать достаточного восстановления движений в паретичных конечностях и скорее всего потребуется терапия, направленная на активизацию движений здоровыми конечностями с помощью вспомогательных средств.
Тесная связь результатов диффузионно-тензорной визуализации и клинического обследования позволяет предположить, что нейровизуализационные методы можно использовать для персонификации реабилитационных программ у пациентов с моторным дефицитом после инсульта. Однако пока единых методик и протокола исследования для применения нейровизуализации в диагностических и прогностических целях нет.
Выводы
При сравнении показателей ФА КСТ в полушарии очага инсульта и контралатеральном полушарии с показателями клинического осмотра с количественной оценкой состояния по валидизированным шкалам установлена заметная корреляционная связь. Взаимосвязь показателей ФА и показателей по шкале реабилитационной маршрутизации (в баллах) в группе пациентов, перенесших церебральный инсульт, составила 0,728 (высокая теснота связи по шкале Чеддока), по NIHSS – -0,635 (заметная теснота), шкале Рэнкина – 0,618 (заметная теснота), FIM – 0,696 (заметная теснота), шкале Ривермид – 0,663 (заметная теснота связи по шкале Чеддока). Тесная взаимосвязь между данными диффузионных метрик, полученных при проведении ДТ МРТ, и баллами по клиническим шкалам позволяет предположить возможность прогнозирования, исходя из этих данных, восстановления двигательных функций у пациентов, перенесших церебральный инсульт. Эти данные можно использовать при подборе индивидуальной программы медицинской реабилитации с учетом степени морфологического повреждения КСТ.
R.R. Gizatullin, L.R. Akhmadeeva, PhD, Prof., D.E. Baikov, PhD, M.V. Savchenko, E.N. Akhmadeeva, PhD, Prof.
Bashkir State Medical University
Clinical Hospital ‘Russian-Railroads-Medicine’, Ufa
Contact person: Leila R. Akhmadeeva, Leila_ufa@mail.ru
Stroke and its consequences today are among the most significant medical and social problems. In more than 70% of patients at an early stage after the first stroke motor disorders are detected. They can further reduce the overall physical and psycho-social quality of life of patients and people caring for these patients. In the long term, only 12% of patients show full functional recovery after stroke. Therefore, it is important to predict motor function recovery in cerebral stroke patients.
Purpose of this study was to compare the effectiveness of traditional clinical scales and diffusion-tensor MRI in predicting the recovery of patients with motor deficits after stroke.
Material and methods. The study included 105 patients aged 20 to 94 years. The experimental group included 76 patients (41 men and 35 women) with motor deficit after cerebral stroke. The control group consisted of 29 patients without a history of cerebral stroke. All of them underwent clinical and paraclinical (MRI) studies according to a single protocol. In the main group, the average NIHSS (National Institutes of Health Stroke Scale) score was 6.0 [3.0–11.0] points, the average Rankin Scale score was 3.0 [1.75–4.25], the Rivermead Mobility Index was 8.0 [3.75–13.00], and the Hauser Ambulation Index was 3.0 [1.0–5.0].
Results. In this study, a close relationship was demonstrated between the fractional anisotropy (FA) indices in the fibers of the central neurons of the corticospinal tracts according to brain MRI data and the clinical indices assessed using the above-mentioned quantitative scales. The relationship between the FA indices and the Rankin scale assessment results (in points) was - 0.618 (noticeable tightness of the relationship according to the Chaddock scale), the relationship with the results according to the FIM scale was 0.696 (noticeable tightness of the relationship according to the Chaddock scale), according to the Rivermead scale – 0.663 (noticeable tightness of the relationship according to the Chaddock scale), according to the NIHSS scale – -0.635 (noticeable tightness of the relationship according to the Chaddock scale), according to the rehabilitation routing scale (RRS) – -0.728 (high tightness of the relationship according to the Chaddock scale).
Conclusions. These data indicate statistically significant correlations between the data obtained using neuroimaging methods and the data obtained during clinical examination. Further studies of the dynamics of motor function recovery in patients who have suffered an ischemic stroke using diffusion tensor MRI of the brain for morphological assessment of the integrity of the corticospinal tracts in combination with clinical indicators is a promising direction for more accurate and personalized prediction of their rehabilitation outcomes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.