Возможности применения энтеропротективной комбинации VERIS (пектин + инулин) + СЭР (солевой энтеральный раствор) для коррекции нарушения функции кишечника на фоне полихимиотерапии
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Критерии тяжести гастроинтестинального мукозита NТCI-CTC (версия 3.0) [1]:](/upload/resize_cache/iblock/483/195_350_1/Yakovenko1.jpg)


Введение
В лечении онкологических больных необходим мультидисциплинарный подход, так как применение хирургических, физических и медикаментозных методов может вызывать большое количество нежелательных реакций, вследствие возникновения которых должный объем терапии может быть сокращен, что ставит под угрозу выживаемость пациентов. Одним из самых распространенных побочных эффектов лечения рака является мукозит [1]. Мукозит представляет собой сложную воспалительную реакцию на фоне химиолучевой терапии и может встречаться на любом уровне желудочно-кишечного тракта (ЖКТ), объединяя в себе и оральный мукозит, и эзофагит, и энтерит, при этом клинические проявления различаются в зависимости от специфичности строения и функций слизистой различных его отделов [2, 3]. Наиболее чувствительны к действию химиопрепаратов быстро делящиеся ткани организма, в числе которых одним из лидирующих является эпителий кишечника. Частота встречаемости гастроинтестинальной токсичности у больных, получающих химиотерапию, составляет 90% [4, 5].
Мукозиты существенно осложняют лечение онкологических больных в связи с необходимостью прерывания или отмены лечения, увеличением сроков госпитализации, потребностью в дополнительной нутритивной поддержке, медикаментозной терапии с привлечением смежных специалистов и значительным ухудшением качества жизни пациента [6, 7]. В некоторых исследованиях показано, что развитие мукозита третьей-четвертой степени в два раза увеличивает риск необходимости перевода пациентов в отделения реанимации и интенсивной терапии и способствует увеличению продолжительности госпитализации после курса химиотерапии на одну неделю [8].
Тяжелый мукозит может привести к летальному исходу больного по причине тяжелой нутритивной недостаточности или вторичного инфицирования вплоть до развития сепсиса [9, 10].
Для оценки степени тяжести гастроинтестинального мукозита оценивают выраженность диареи, энтероколита или мукозита нижних отделов ЖКТ (табл. 1) [1].
Факторами риска развития мукозита у пациентов, получающих полихимиотерапию (ПХТ), являются [1]:
- возраст пациента (доминирует у пожилых больных);
- пол (чаще у женщин);
- ослабленное общее состояние (ECOG ≥ 2);
- локализация опухоли в кишке (особенно нейроэндокринный характер опухоли);
- сопутствующие заболевания кишечника (колит, синдром мальабсорбции и др.);
- нарушение пассажа желчи;
- комбинированная химиолучевая терапия органов брюшной полости;
- сопутствующая терапия препаратами, индуцирующими диарею (препараты магния, антибактериальная терапия, соли желчи и др.). Чаще отмечается развитие диареи при использовании еженедельных и ежедневных режимов введения препаратов и при длительных инфузиях цитостатиков [11];
- ослабленность онкопациентов (изначальное нарушение нутритивного статуса).
Патогенез развития мукозита достаточно сложен и зависит от механизма воздействия того или иного цитостатика, однако общую модель можно представить в виде стадийного процесса повреждения слизистой [1]. Воздействие повреждающего фактора приводит к гибели эпителиоцитов с образованием свободных радикалов, оказывающих прямое цитотоксическое действие [12]. Далее в этой зоне развивается ответ на возникшее повреждение в виде воспаления с участием иммунных клеток и провоспалительных цитокинов – фактора некроза опухоли альфа, интерлейкина (ИЛ) 6, ИЛ-1β. Это приводит к появлению дефектов слизистой от эрозий до обширных, глубоких язв, обычно покрытых псевдомембраной, состоящей из разрушенных клеток и фибрина [1]. Данная стадия является наиболее благоприятной для присоединения и колонизации бактериальной флоры, что ведет к вторичной инфекции, а также транслокации кишечной флоры и развитию сепсиса [12].
Транслокация кишечных бактерий происходит вследствие повреждения на фоне мукозита эпителиальных клеток, в результате чего бактерии легко проникают в кровоток через данные участки кишечного эпителия [13].
Важно отметить, что явление бактериальной транслокации с развитием сепсиса возникает чаще у пациентов при приоритете парентерального питания, результатом которого становятся дефицит энтерального питания, вынужденное голодание и, как следствие, повреждение кишечной стенки [14].
Токсическое воздействие цитостатических препаратов на слизистую оболочку ЖКТ приводит к неспецифическому повреждению ДНК быстро делящихся клеток, которыми являются не только опухолевые, но и нормальные клетки организма (в частности, эпителий ЖКТ) [15]. В результате фармакологического эффекта иммунодепресcантов происходит прекращение процессов физиологической регенерации слизистой и нарушение ее нормального функционирования с последующими интестинальной недостаточностью и снижением резорбции жидкости в кишечнике. Повреждение ткани кишечника является фактором, благоприятствующим изменению характера пристеночной микрофлоры, в норме выполняющей барьерную функцию, в сторону увеличения количества штаммов условно-патогенной и появления патогенной флоры. В клиническом исследовании, посвященном изучению патогенов, являющихся причиной острой диареи, выявлены несколько наиболее важных из них: ротавирус, аденовирус, эховирус, криптоспоридии, Clostridioides difficile (токсин+) и сальмонелла [16]. Патогенная флора кишечника способствует активации циклического аденозинмонофосфата энтероцитов с последующим развитием секреторной диареи [12, 17].
Нарушение микрофлоры кишечника практически всегда усиливает диарейный синдром. Частота развития диареи, которая у пациентов после химиотерапии была связана непосредственно с инфекцией, вызванной C. difficile, по данным разных источников, колеблется от 5 до 15% [18]. Причиной клинических проявлений C. difficile-ассоциированной диареи является секреция токсинов. Токсин A влияет на эпителий кишечника, вызывая выраженную секрецию жидкости. Токсин В оказывает выраженное цитотоксическое воздействие и приводит к гибели кишечного эпителия [19]. Важно отметить нарушение процессов микроциркуляции кишечной стенки в период химиотерапии и, как следствие, развитие неокклюзионной формы нарушения мезентериального кровоснабжения [20, 21]. Ранее явления кишечной ишемии активно изучались преимущественно у пациентов в послеоперационном периоде [22, 23]. Литературные данные свидетельствуют о развитии деструкции кишечной стенки, связанной с развитием ишемии у больных с кишечной непроходимостью [6, 14, 25]. Однако ввиду увеличения количества онкологических больных и широкого применения химио- и лучевой терапии стоит уделить большее внимание рискам развития данного состояния на фоне цитостатической терапии [24].
Нарушение микроциркуляции в стенке кишечника вносит колоссальный вклад в развитие такого осложнения, как парез кишечника [26, 27].
Основными клиническими проявлениями поражения ЖКТ на фоне химиолучевой терапии являются боль и сухость во рту, невозможность адекватного приема пищи, боль в различных отделах живота, вздутие и тяжесть, профузная диарея и запоры, желудочно-кишечное кровотечение, парез кишечника и развитие острой кишечной непроходимости [1].
Для купирования проявлений мукозитов в стандартных схемах лечения применяют немедикаментозные и медикаментозные методы. Для купирования тошноты и рвоты применяют антагонисты 5-HT3-рецепторов (ондансетрон, гранисетрон, трописетрон, палоносетрон), антагонисты NK1-рецепторов (апрепитант, фосапрепитант, нетупитант), блокаторы рецепторов допамина: бензамиды (метоклопрамид, итоприд), фенотиазины (хлорпромазин или аминазин), бутирофеноны (дроперидол, галоперидол) [28]. Возможно назначение ингибиторов протонной помпы при наличии диспепсических явлений. Для коррекции диареи на фоне химиотерапии назначают лоперамид, механизм которого обусловлен торможением повышенной перистальтики кишечника и подавлением избыточной секреции. Дополнительно к лоперамиду внутрь назначают противовоспалительные вяжущие и одновременно калоформирующие средства. Высокие дозы лоперамида применяют при лечении диареи, вызванной 5-фторурацилом, у пациентов с колоректальным раком [29].
Литературные данные свидетельствуют о том, что токсические эффекты ПХТ реализуются в большем количестве случаев системно у пациентов с фоновым неблагополучием состояния ЖКТ – метабoлическим синдромом, нарушениями микроциркуляции. Отмечены благоприятные эффекты назначения препаратов из группы пре- и пробиотиков пациентам в период, предшествующий проведению химиотерапии.
Цель исследования – продемонстрировать возможности использования энтеропротективной комбинации VERIS (пектин + инулин) + СЭР (солевой энтеральный раствор) и ее положительные эффекты на примере клинического случая пациентки с мукозитом ЖКТ на фоне химиотерапии. Позитивное воздействие данной комбинации на всасывательную и моторную функции кишечника, нормализацию водно-электролитного баланса, улучшение микроциркуляции стенки кишечника, а также в органах и тканях всего организма прямым образом влияет на успешный результат терапии у пациентов после осложнений ПХТ.
СЭР (солевой энтеральный раствор), производимый компанией ООО «Внешпромфарм» (Россия), – это химусоподобный продукт специализированного лечебного питания для использования в процессе осуществления нутритивной поддержки больных. СЭР обладает слабокислой средой и содержит восемь макроэлементов. Состав на 1 л воды: Na+ – 2,75 г, K+ – 1 г, Сa2+ – 0,675 г, Mg2- – 0,313 г, Сl- – 4,725 г, (HPO4)2- – 1,875 г, (SO4)2- – 1,25 г, СH3COO- – 0,375 г. СЭР является продуктом, поддерживающим гомеостаз энтероцита/колоноцита [30, 31].
Основные цели применения СЭР в отделении реанимации и интенсивной терапии [31–36]:
- восстановление пропульсивной, всасывательной и барьерной функций кишечника;
- восстановление микроциркуляции в стенке кишечника, а также в органах и тканях всего организма;
- восстановление водно-электролитного обмена;
- нормализация микрофлоры кишечника (слабокислая среда (pH 5,2–5,8) неблагоприятна для условно-патогенной микрофлоры, но способствует восстановлению и росту комменсальной сапрофитной микрофлоры);
- профилактика транслокации бактерий из кишечника в системный в кровоток;
- снижение маркеров эндогенной интоксикации.
В рутинной клинической практике применяется в реанимационных отделениях, отделении гастроэнтерологии, онкологии и радиолучевой терапии, отделении нейрореабилитации Научно-исследовательского института – Краевой клинической больницы № 1 им. профессора С.В. Очаповского (НИИ-ККБ № 1) для лечения паллиативных пациентов, пациентов с нейротравмой, неопределенным колитом, антибиотик-ассоциированной диареей, язвенным колитом и болезнью Крона [37].
VERIS – пребиотик, который содержит пектин и инулин (производится компанией ООО «Внешпромфарм», Россия). Сочетание данных компонентов имеет широкий спектр фармакологических эффектов и действует в первую очередь как пребиотик и бактерицидный энтеросорбент. Также имеются данные о влиянии этого препарата на уровень липидов, глюкозы и функциональную способность почек [38].
Получено информированное согласие пациентки на публикацию данного клинического наблюдения. Данные пациентки деперсонализированы.
Клинический случай
Пациентка А. 62 лет была госпитализирована в отделение онкологии для проведения очередного этапа ПХТ по поводу отдаленных метастазов рака молочной железы. До момента госпитализации в течение предыдущих курсов отмечала эпизоды боли в животе, учащения жидкого стула, тошноты, рвоты, получала симптоматическое лечение – прокинетики, диоктаэдрический смектит. В остальное время в периоды между лечением жалобы на диспепсический синдром сохранялись: постоянное снижение аппетита; тошнота при виде пищи; вздутие живота; неустойчивый характер стула; периодически неоформленный стул без патологических примесей, обычной окраски, чередование с запорами и усилением метеоризма; боль во всех отделах живота. Принимала по назначению лечащего врача-онколога диоктаэдрический смектит, ферментозаместительную терапию – панкреатин 25 000 ЕД во время приема пищи, спазмолитики по требованию. В период последней госпитализации на второй день лечения отметила учащение стула до 12 раз в сутки, острую спастическую боль во всех отделах живота, метеоризм. Была выписана под наблюдение участкового терапевта. Состояние было интерпретировано как функциональная диспепсия после проведения ПХТ и реакция на диетические погрешности, амбулаторно был продолжен прием спазмолитика и диоктаэдрического смектита, ферментозаместительная терапия препаратами панкреатина. Лечение было безуспешным, боль в животе усилилась, сохранялась диарея до 10 раз в сутки, в порядке самообращения 07.11.2023 была доставлена в приемное отделение НИИ-ККБ № 1.
На данный момент имеет диагноз: с-r правой молочной железы pT1N1M0, II A st., после комплексного лечения 2012 г., pr.pr. mts S6 печени, после атипичной резекции печени (01.10.2020), pr.pr. mts в печень, кости, после симптоматической дистанционной лучевой терапии на кости таза справа, 2 кл. гр. Около 10 лет страдает гипертонической болезнью.
Со слов пациентки, аллергологический анамнез не отягощен. Переливания компонентов крови, эпидемические заболевания, туберкулез, вирусные гепатиты, ВИЧ, заболевания, передаваемые половым путем, отрицает. Семейный анамнез не отягощен.
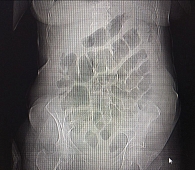
В приемно-диагностическом отделении НИИ-ККБ № 1 осмотрена дежурным хирургом и гинекологом, исключена острая хирургическая патология. Выполнена обзорная рентгенография брюшной полости стоя (рис. 1), данных за острую кишечную непроходимость не получено, на рентгенографии – выраженный пневматоз кишечника.
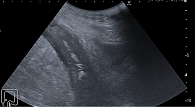
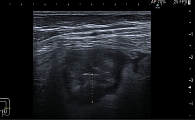
Выполнено ультразвуковое (УЗ) дуплексное сканирование (аппарат Samsung HS 70A, тип датчика – конвексный СА 1-7 А) органов брюшной полости (рис. 2, 3). Визуализация затруднена (аэроколия + стома). Печень: правая доля – косовертикальный размер 160 мм, левая – 40 мм, контуры ровные, четкие, эхогенность средняя, очаговые образования 3,0 × 11 мм и 5 × 12 мм в S6, 2 ×17 и 10 × 11 мм в S5 печени, структура диффузно-неоднородная, сосудистый рисунок обычный. Внутрипеченочные желчные протоки не расширены. Воротная вена: 8 мм. Холедох: в проксимальном отделе 4 мм. Желчный пузырь: 70 × 30 мм, стенка – 3,5 мм, просвет гомогенный, конкрементов нет. Поджелудочная железа (визуализируется фрагментарно): головка – 19 мм, тело – 12 мм, хвост – 16 мм, контуры четкие, ровные, эхогенность повышенная, структура диффузно-неоднородная. Вирсунгов проток не визуализируется. Очаговых образований на доступных осмотру участках не выявлено. Селезенка: 92 × 30 мм, форма обычная, контуры ровные, эхогенность обычная, структура однородная. Брюшная полость: свободная жидкость визуализируется толщиной слоя подпеченочно – 5 мм, межпетельно – в малом тазу следы. Петли кишечника в левых отделах 28 мм в диаметре, стенки гипоэхогенные, до 9 мм толщиной (воспалительные изменения), в правых отделах до 29 мм в диаметре, стенки гипоэхогенные, до 14 мм толщиной (воспалительные изменения), раздуты газом, перистальтика регистрируется, местами ослабленная. Заключение: УЗ-признаки малого гидроперитонеума, диффузных изменений и очаговых (2) образований S 6, 5 (2) печени, диффузных изменений поджелудочной железы, утолщения стенки толстой кишки, синдрома поражения полого органа, снижения перистальтики.
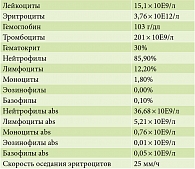
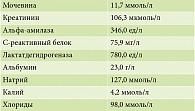
Данные общего клинического анализа крови представлены в табл. 2, данные биохимического анализа крови – в табл. 3.
Маркеры гепатита В и С – отрицательные. Вызван на осмотр врач-гастроэнтеролог. При объективном осмотре кожные покровы и слизистые бледные. Температура тела 36,9 °С. Сердце: тоны приглушены, ритм правильный, частота сердечных сокращений (ЧСС) – 88 в минуту, артериальное давление (АД) – 145/85 мм рт. ст. В легких хрипов нет, дыхание везикулярное, Sat O2 – 98%. Живот правильной формы, деформирован вследствие послеоперационного рубца по средней линии, слегка поддут, участвует в акте дыхания равномерно. При пальпации умеренная болезненность во всех отделах живота, отсутствуют симптомы раздражения брюшины, перистальтика кишечника выслушивается, ослаблена. Печень не увеличена, почки не пальпируются, симптом поколачивания отрицателен с обеих сторон. Данные анамнеза (прием цитостатиков по поводу онкологического заболевания), острые боли спастического характера в животе без перитонеальных симптомов и диарея сориентировали вектор диагностики в сторону осложнения химиотерапии в виде мукозита (степень тяжести III по NТCI-CTC (версия 3.0)). Принято решение о госпитализации пациентки в отделение реанимации под наблюдением гастроэнтеролога.
На момент поступления по поводу сопутствующей кардиопатологии постоянно принимает кандесартан 8 мг один раз в сутки, бисопролол 2,5 мг один раз в сутки, амлодипин 2,5 мг один раз в сутки, розувастатин 10 мг один раз в сутки, ацетилсалициловую кислоту 100 мг один раз в сутки. По поводу рака молочной железы получает ПХТ: доцетаксел 75 мг/м2 в/в в первый день один раз в три недели; карбоплатин AUC-6 в/в в первый день один раз в три недели; трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в первый день один раз в три недели + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в первый день один раз в три недели, шесть циклов.
Начато лечение: рифаксимин-альфа 400 мг три раза в сутки, VERIS (пектин + инулин) по две капсулы три раза в сутки, СЭР 1 л в сутки, инфузионная терапия 15 мл/кг.
Взят анализ для выполнения иммуно-хроматографического теста на определение токсина А и В C. difficile.
На вторые сутки отмечено урежение количества стула, уменьшение тошноты, на третьи сутки – улучшение самочувствия, перистальтика кишечника выслушивается и определяется на УЗИ.
Данные ультразвукового дуплексного сканирования органов брюшной полости на третьи сутки (аппарат LOGIQ V2, тип датчика – конвексный С 1-6): свободная жидкость лоцируется в отлогих местах брюшной полости, наибольшей толщиной в малом тазу 60 мм, наддиафрагмальный слой жидкости справа и слева толщиной 23 мм, по правому и левому фланку – до 25 мм.
Петли тонкого кишечника на доступных осмотру участках не расширены, перистальтика вялая. Толстый кишечник практически на всем протяжении с утолщенными до 10 мм стенками, до 30 мм в диаметре максимально (восходящий отдел), дифференцировка на слои сглажена, эхогенность снижена. Перистальтика толстой кишки определяется, вялая.
Выполнена КТ органов брюшной полости с целью исключения мезентериального тромбоза (рис. 4): полисегментарно в печени гиподенсные округлые образования до 10–12 мм, плотностью до 9 ед.Н. В брюшной полости жидкость толщиной слоя до 40 мм на уровне печени и селезенки. Стенки толстой кишки утолщены, имеется уплотнение параколической клетчатки.
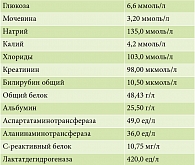
На четвертые сутки получен результат иммуно-хроматографического теста определения токсина А и В C. difficile – положительно. К лечению добавлен ванкомицин перорально по 250 мг три раза в сутки. Анализ на кишечную патогенную микрофлору отрицательный, коррекции лечения не требуется. Биохимический анализ крови на четвертые сутки представлен в табл. 4. Отмечается значительное снижение концентрации С-реактивного белка.
На десятые сутки пациентка отмечает выраженное улучшение самочувствия, нормализацию количества и характера стула, отсутствие тошноты, появление аппетита, отсутствие абдоминальных болей.
Данные объективного осмотра: кожные покровы и слизистые нормальной физиологической окраски. Сердце: тоны приглушены, ритм правильный, ЧСС – 66 в минуту, АД – 125/75 мм рт. ст. В легких хрипов нет, дыхание везикулярное, Sat O2 – 98%. Живот правильной формы, деформирован из-за послеоперационного рубца по средней линии, участвует в акте дыхания равномерно. При пальпации болезненности нет, отсутствуют симптомы раздражения брюшины, печень не увеличена, почки не пальпируются, симптом поколачивания отрицателен с обеих сторон.
На 10-е сутки в общем анализе крови наблюдается снижение скорости оседания эритроцитов и количества лейкоцитов, увеличение количества эритроцитов и концентрации гемоглобина (табл. 5).
По результатам биохимического анализа крови на 10-е сутки отмечено выраженное снижение С-реактивного белка, улучшение показателей работы почек, нормализация водно-электролитного баланса (табл. 6).
Обсуждение
Развитие мукозита у пациентов, находящихся на химиолучевой терапии, рассматривается как одно из самых частых побочных явлений, и в случае его подтверждения, согласно современным рекомендациям, требуется активное вмешательство. При развитии мукозита не исключены бактериальная транслокация, рост условно-патогенной флоры, активация оппортунистической инфекции и нарушение процессов микроциркуляции с развитием неокклюзионной формы нарушения мезентериального кровоснабжения [6, 25].
В описанном клиническом случае на основании данных жалоб, анамнеза и лабораторно-инструментальных методов исследования у пациентки было констатировано развитие мукозита третьей степени тяжести по шкале NТCI-CTC (версия 3.0) на фоне ПХТ, которое сопровождалось присоединением C. difficile-ассоциированной инфекции.
Для лечения данной пациентки, кроме стандартной терапии (антибактериальная терапия рифаксимином-альфа 400 мг три раза в сутки, ванкомицином 250 мг три раза в сутки, инфузионная терапия), применяли комбинацию препаратов, обладающих функцией энтеропротекции: VERIS по две капсулы три раза в сутки + СЭР 1 л в сутки.
Уже в течение первых трех суток на фоне лечения отмечалась положительная динамика в виде уменьшения маркеров системного воспаления в анализе крови, снижения уровня азотистых шлаков. У пациентки улучшилось общее состояние, появилась тенденция к восстановлению пропульсивной и всасывательной функций кишечника, выразившаяся в стабилизации характера стула (урежение дефекации до четырех раз в сутки, периодически стул полуоформленный), появился аппетит, прекратилась боль в животе. К 10-му дню наблюдалась значительная динамика в биохимическом анализе крови в виде выраженного снижения С-реактивного белка до 10,75 мг/л, уменьшения уровня шлаков (мочевина – 3,20 ммоль/л, креатинин – 98,00 мкмоль/л) и нормализации показателей водно-электролитного баланса (натрий – 135,0 ммоль/л, калий – 4,2 ммоль/л, хлориды – 103,0 ммоль/л), снижение частоты стула до двух раз в сутки, что в целом соответствует снижению степени тяжести мукозита с третьей до первой степени по NТCI-CTC (версия 3.0) [1].
Данная комбинация позволяет добиться улучшения общего самочувствия, в том числе нормализации стула, купирования диспепсических явлений – диареи, тошноты, рвоты, нормализации всасывательной и пропульсивной функций кишечника, что приближает сроки восстановления питания. Коррекцию интестинальной недостаточности отражает положительная динамика улучшения лабораторных показателей (снижение маркеров эндогенной интоксикации, нормализация водно-электролитного баланса). Все перечисленное позволяет не снижать дозы химиотерапии у пациентов, не прерывать лечение, что способствует сокращению времени реабилитации между курсами ПХТ и затрат на реабилитацию, а также повышению качества жизни и увеличению выживаемости больных.
Заключение
Ввиду увеличения количества онкологических больных, а также появления новых эффективных таргетных препаратов, повышения успешности и распространенности применения химио- и лучевой терапии, увеличения длительности курсов химиотерапии и общей продолжительности жизни пациентов проблема повреждения слизистой ЖКТ и развития мукозитов, методов их профилактики и лечения становится все более актуальной. Несмотря на достижения последних лет в понимании модели патогенеза развития данного осложнения, спектр терапевтических возможностей профилактики и лечения мукозитов на данный момент достаточно скромный, качество жизни пациентов страдает, поэтому для решения этой проблемы требуется расширение диапазона методов лечения и более глубокое их изучение. Представленный клинический пример иллюстрирует один из случаев успешного применения энтеропротективной комбинации VERIS (пектин + инулин) + СЭР у пациентки с нарушением функции кишки на фоне проводимой ПХТ, в результате чего отмечена положительная динамика клинических, лабораторных, инструментальных критериев кишечной недостаточности, снижение степени тяжести мукозита с третьей до первой степени по NТCI-CTC (версия 3.0), компенсация пропульсивной и всасывательной функций кишки. В связи с этим данная комбинация может рассматриваться как средство лечения мукозита и осложнений ПХТ у онкологических больных.
Стоит обратить внимание на литературные данные о системности развивающихся осложнений у пациентов, получающих ПХТ, и высокую частоту их развития. Своевременное лечение данных осложнений значительно улучшает качество жизни больных, предотвращает развитие тяжелых последствий, обеспечивает своевременное и непрерывное проведение курсов химиотерапии, оптимизирует результаты лечения и выживания пациентов с онкозаболеваниями. Исходя из вышеперечисленного, представляется разумным, помимо предшествующей оценки состояния органов ЖКТ до начала лечения и выявления сопутствующей патологии, рекомендовать специалистам акцентировать внимание на возможности назначения пациентам перед началом ПХТ профилактического курса препаратов с энтеропротективным действием. Назначение препаратов с функцией энтеропротекции позволит предотвратить или снизить токсическое воздействие цитостатиков на слизистую оболочку и функцию кишки, увеличивая таким образом эффекты лечения и обеспечивая экономическую и лечебную эффективность таргетной терапии.
Авторы заявляют об отсутствии конфликта интересов.
M.S. Yakovenko, PhD, A.I. Demina, N.N. Demin
Kuban State Medical University, Krasnodar
Region Clinical Hospital No. 1 – Research Institute named after Professor S.V. Ochapovsky, Krasnodar
Contact person: Mariya S. Yakovenko, eg12@bk.ru
Treatment of patients with oncopathology may be accompanied by a large number of adverse reactions, the most common symptoms of damage to the gastrointestinal tract (GIT) as development of mucositis. This condition significantly complicates the treatment of such patients due to an increase in the duration of hospitalization, the need to interrupt the course of chemotherapy, the need for additional nutritional support, symptomatic drug therapy and a significant deterioration in the quality of life. The presented clinical case demonstrates the possibility of using an enteroprotective combination of SES (saline enteral solution) + VERIS (Pectin+Inulin) as an additional therapy in order to reduce the severity of mucosal lesions Gastrointestinal tract on the background of chemoradiotherapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.