Магнитно-резонансно-томографическая трактография при постинсультном двигательном дефиците: результаты исследования белого вещества головного мозга для индивидуального подбора методов помощи
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследованы 65 пациентов в возрасте 45–84 лет: 42 пациента основной группы в течение года от момента исследования перенесли церебральный инсульт и имели парезы, 23 пациента контрольной группы не имели инсультов в анамнезе. Всем им были проведены клинические и параклинические (МРТТ) исследования. В основной группе клинический статус, оцененный по количественным шкалам, составил 4 [2,0–12,0] балла по NIHSS (National Institutes of Health Stroke Scale), 8,5 [3,25–12,0] – по шкале Рэнкина (Rankin Scale). Индекс мобильности Ривермид (Rivermead Mobility Index) – 3,0 [2,0–4,0].
Результаты и выводы. В группе пациентов, перенесших церебральный инсульт, отмечалось значительное увеличение в показателях различий коэффициентов фракционной анизотропии между пораженным и непораженным полушариями головного мозга – 0,023 по сравнению с пациентами контрольной группы – 0,003. Кроме того, модуль межполушарных различий средней скорости диффузии в основной группе был значительно выше (31,7), чем в контрольной (4,3). Эти данные подтверждены результатами диффузионно-тензорной визуализации (DTI).
Наши результаты указывают на значимость прижизненного нейровизуализационного исследования кортикоспинальных трактов для построения модели регрессии двигательного дефицита после перенесенного инсульта и формирования индивидуальной траектории медицинской реабилитации для каждого пациента с учетом степени морфологической целостности пирамидных путей головного мозга.
Материал и методы. Обследованы 65 пациентов в возрасте 45–84 лет: 42 пациента основной группы в течение года от момента исследования перенесли церебральный инсульт и имели парезы, 23 пациента контрольной группы не имели инсультов в анамнезе. Всем им были проведены клинические и параклинические (МРТТ) исследования. В основной группе клинический статус, оцененный по количественным шкалам, составил 4 [2,0–12,0] балла по NIHSS (National Institutes of Health Stroke Scale), 8,5 [3,25–12,0] – по шкале Рэнкина (Rankin Scale). Индекс мобильности Ривермид (Rivermead Mobility Index) – 3,0 [2,0–4,0].
Результаты и выводы. В группе пациентов, перенесших церебральный инсульт, отмечалось значительное увеличение в показателях различий коэффициентов фракционной анизотропии между пораженным и непораженным полушариями головного мозга – 0,023 по сравнению с пациентами контрольной группы – 0,003. Кроме того, модуль межполушарных различий средней скорости диффузии в основной группе был значительно выше (31,7), чем в контрольной (4,3). Эти данные подтверждены результатами диффузионно-тензорной визуализации (DTI).
Наши результаты указывают на значимость прижизненного нейровизуализационного исследования кортикоспинальных трактов для построения модели регрессии двигательного дефицита после перенесенного инсульта и формирования индивидуальной траектории медицинской реабилитации для каждого пациента с учетом степени морфологической целостности пирамидных путей головного мозга.

Введение
Инсульт остается серьезной глобальной проблемой здравоохранения, оказывающей существенное влияние на жизнь людей, перенесших острое нарушение мозгового кровообращения [1]. Инсульт оставляет глубокий след в аспекте не только высокой смертности, но и долгосрочных последствий, включая инвалидизацию. К распространенным последствиям инсульта относятся двигательные нарушения, способные значительно снижать качество жизни [2]. Традиционные клинические оценки дают ценную информацию о двигательных нарушениях, но современные методики нейровизуализации, такие как трактография магнитно-резонансной томографии (МРТ), предлагают более глубокое понимание изменений нейронных субстратов, лежащих в основе подобных нарушений [3].
Двигательный дефицит, обусловленный инсультом, часто объясняется нарушениями в сложной сети участков белого вещества, ответственных за двигательный контроль [4]. МРТ-трактография – неинвазивный метод визуализации, который позволяет визуализировать и картировать эти нервные пути, обеспечивая их детальную, в том числе количественную, анатомическую оценку [5]. В статье проанализированы значение МРТ-трактографии в дополнительной диагностике двигательных нарушений после церебрального инсульта и ее потенциал как объективного инструмента для характеристики нейроанатомических изменений [6].
По мере углубления в методологии, используемые в МРТ-трактографии при двигательных нарушениях, связанных с инсультом, становится очевидным, что детальное понимание структурных изменений мозга имеет решающее значение для оптимизации стратегий реабилитации [7]. В статье рассматриваются ключевые современные исследования, в которых МРТ-трактография используется для оценки целостности белого вещества у людей, переживших инсульт, что дает надежду на более целенаправленные терапевтические вмешательства и персонализированные подходы к их медико-социальной реабилитации [8, 9].
Согласно последним данным Всемирной организации здравоохранения (ВОЗ), свыше 50% выживших после инсульта сталкиваются с инвалидизацией различной степени, которая ложится тяжелым бременем как на индивида, его семью, так и на общество в целом [10].
Инвалидизация после инсульта проявляется по-разному, в том числе в виде двигательных нарушений, потери чувствительности, афазии и различных форм когнитивного дефицита. Оценка степени инвалидизации важна не только для медицинской диагностики, но и для разработки индивидуализированных программ реабилитации [11].
Используемые в мировой неврологической практике клинические шкалы, такие как модифицированная шкала Рэнкина (mRS), индекс мобильности Ривермид и шкала тяжести инсульта Национального института здоровья США (NIHSS), становятся важным инструментом квантификации степени инвалидизации и функциональной зависимости после инсульта [12–14]. Они предоставляют структурированный подход к оценке различных аспектов повседневной жизни, что важно для определения стратегии реабилитации и оценки эффективности терапевтических вмешательств [15, 16].
В то же время универсальной шкалы оценки двигательного дефицита не существует. Эксперты рекомендуют использовать определенную комбинацию шкал для отдельного пациента [17, 18–20], например NIHSS (или аналогичную шкалу дефицита), индексы Ривермид, шкалы Бартел и Рэнкина. Каждая шкала имеет преимущества и недостатки. Золотого стандарта для оценки двигательного дефицита у пациентов после инсульта нет [21].
Согласно клиническим рекомендациям Минздрава России по ишемическому инсульту и транзиторной ишемической атаке у взрослых 2021 г. [22], обязательны к применению следующие шкалы: «трехложечная проба», шкала ком Глазго, TOAST, шкала Рэнкина, индекс Ривермид и NIHSS. Однако нельзя предсказать возможность и скорость восстановления пациента в остром периоде инсульта, базируясь исключительно на результатах осмотра с применением даже комбинации этих высоковалидных клинических шкал.
Для более глубокого понимания механизмов и прогнозов инвалидизации, особенно в аспекте двигательных нарушений, трактография кортикоспинального пути может предоставить ценную дополнительную информацию. В статье рассматриваются современные методы оценки инвалидизации после инсульта и обсуждаются перспективы использования трактографии кортикоспинального пути для более точного определения направлений и подходов к реабилитации пациентов с последствиями инсульта.
Материал и методы
В работу включены данные наших наблюдений за 65 пациентами в возрасте 45–84 лет в Клинике Башкирского государственного медицинского университета (г. Уфа, Россия). Пациенты были разделены на две группы. В контрольную вошли 23 пациента (8 мужчин и 15 женщин) без перенесенных церебральных инсультов в анамнезе. Основную группу составили 42 пациента (21 мужчина и 21 женщина), перенесших церебральный инсульт и осмотренных в его позднем восстановительном периоде.
Все пациенты были обследованы клинически и с применением МРТ на аппарате OPTIMA 360 (GE) с напряженностью магнитного поля 1,5 Т. Использовалась 16-канальная поверхностная квадратическая катушка для головного мозга. Стандартный протокол, согласно клиническим рекомендациям [22], включал в себя набор программ с получением Т1- и Т2-взвешенных изображений, а также изображений Т2 FLAIR с подавлением сигнала от свободной воды и диффузионно-взвешенных изображений (DWI) с коэффициентами диффузии b0 и b1000 с/мм2. Толщина выделяемого среза при DWI составила 5 мм, промежуток между ними – 0, поле обзора (FOV) – 34 × 24 см, время повторения (TR) – 4994 мс, время эхо (ТЕ) – 129 мс. Общее время сканирования не превышало 15–20 минут.
Плоскость аксиального сканирования была ориентирована перпендикулярно линии, соединяющей переднюю и заднюю спайки мозга. Сагиттальная и коронарная плоскости сканирования выставлялись перпендикулярно к аксиальной плоскости сканирования.
Трактографию (DTI) выполняли отдельно как дополнение к диффузионной МРТ в 25 направлениях с первичным получением цветовой карты фракционной анизотропии и последующим объемным моделированием кортикоспинальных путей. Реконструкцию полученных изображений осуществляли с помощью пакета рабочих программ Volume Viewer 7, анализ DTI проводили на рабочей станции AW Volume Share 7 через программное обеспечение READY View. На полученных изображениях оценивали значения фракционной анизотропии (ФА) в диапазоне от 0 до 1, плотность проводящих путей, показатели радиальной и аксиальной диффузии, значения среднего коэффициента диффузии.
В качестве клинических оценочных инструментов использовались шкалы NIHSS, Ривермид, Рэнкина, ком Глазго (ШКГ), для описательной статистики – программа Еxcel.
Критерием включения в исследование для пациентов контрольной группы было подписание информированного добровольного согласия (ИДС) на участие в исследовании, критерием исключения – перенесенный церебральный инсульт в анамнезе. Для экспериментальной группы критериями включения были наличие одного или нескольких острых нарушений мозгового кровообращения (ОНМК) в анамнезе в течение 12 месяцев от момента осмотра, ИДС на участие в исследовании. Учитывая, что большинство пациентов находились в позднем восстановительном периоде (более шести месяцев с момента ОНМК), динамику восстановления кортикоспинального тракта мы не исследовали.
Общая характеристика включенных в данную выборку пациентов представлена в табл. 1. Испытуемые отличались по возрасту: медиана возраста в основной группе составила 69 лет, в контрольной – 54 года. В основной группе количество мужчин и женщин было одинаковым, в контрольной группе – 8 (34,8%) и 15 (65,2%) соответственно.
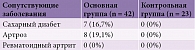
При оценке двигательного дефицита учитывались сопутствующие заболевания (табл. 2), влияющие на двигательную активность, такие как сахарный диабет, артроз или ревматоидный артрит. При осмотре пациентов основной группы выявлено, что данные коморбидности не влияли на двигательный дефицит.
Результаты и обсуждение
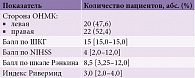
В основной группе церебральные инсульты в левом полушарии головного мозга диагностированы у 20 (47,6%) пациентов, в правом – у 22 (52,4%). Все пациенты находились в ясном сознании и имели показатель по ШКГ 15. Медиана значений по NIHSS составила 4, первый квартиль – 2,0, третий – 12,0, количество баллов шкале Рэнкина – 8,5, первый квартиль – 3,25, третий – 12,0, индекс Ривермид – 3,0, первый квартиль – 2,0, третий – 4,0 (табл. 3).
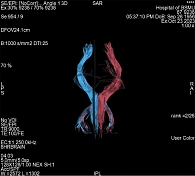
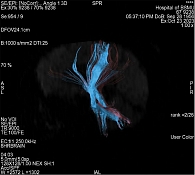
После клинического осмотра с оценкой по указанным выше шкалам и проведения МРТ кортикоспинальные пути/тракты (КСТ) строились в ручном режиме по зонам интереса как в левом, так и в правом полушарии головного мозга. Трехмерная модель КСТ представлена на рис. 1 и 2.
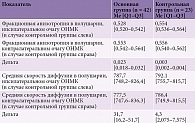
Оценка диффузионных метрик сигнальных и тканевых моделей на всем протяжении КСТ представлена в табл. 4. Медиана дельты ФА в основной группе (после ОНМК) составила 0,023, в контрольной – 0,003 (p < 0,05). Это свидетельствует о том, что ФА значимо развивается в основной и контрольной группе и может быть использована для прогнозирования восстановления двигательного дефицита так же, как и дельта средней скорости диффузии. Медиана дельты средней скорости диффузии в основной группе составила 31,7, в контрольной – 4,3 (p < 0,05), что также показывает значимость данного коэффициента для оценки морфологического повреждения КСТ. Это имеет значение при выборе методов реабилитации. При массивном перерыве КСТ, подтвержденном результатами МРТ-трактографии, потенциал для восстановления двигательной функции в конечностях, в которых развился центральный парез, крайне мал. В таком случае методики реабилитации рекомендуется направлять прежде всего на замещение функций паретичной конечности с максимальным использованием функций противоположной конечности, а не ожидать восстановления достаточных движений в конечности с парезом.
В данном исследовании мы провели анализ и сравнение различных методов оценки двигательного дефицита у пациентов после инсульта с помощью клинических количественных оценочных шкал и диффузионно-тензорной визуализации (DTI).
Диффузионно-тензорная визуализация (DTI), позволяя более детально исследовать структурные изменения в КСТ, представляет собой перспективный инструмент для прогнозирования восстановления двигательного дефицита после церебрального инсульта.
Таким образом, наше исследование еще раз подчеркивает необходимость интеграции различных методов клинической и параклинической оценки для более детального понимания перспектив уменьшения двигательного дефицита после церебрального инсульта для каждого пациента. Применение комбинации клинических оценочных шкал и передовых технологий визуализации, таких как DTI, может обеспечить более точное прогностическое понимание ситуации в отдельных случаях, а следовательно, улучшить эффективность персонифицированных реабилитационных мероприятий у пациентов, перенесших инсульт.
В настоящее время ряд клиник и групп исследователей в мире используют МРТ-трактографию для анализа целостности различных путей (трактов) головного мозга. Однако пока нет единых методологических подходов и протокола исследования для ее применения в диагностических и прогностических целях. Это делает невозможным сопоставление результатов количественного анализа волокон КСТ, полученных в различных центрах, и создает сложности для единого понимании вопроса врачебным профессиональным сообществом. На данном этапе мы можем лишь говорить о том, что полученные нами и представленные в статье данные сопоставимы с результатами других авторов, работающих в аналогичном направлении в России и за рубежом [5, 7, 23].
Выводы
При сравнении результатов ФА между полушариями головного мозга в основной группе получен значительно больший модуль дельты ФА, чем в контрольной группе. Дельта ФА в группе пациентов с церебральным инсультом в анамнезе составила 0,023, в контрольной – 0,003. Модуль средней скорости диффузии в экспериментальной группе составил 31,7, в контрольной – 4,3. Данные показатели DTI соотносились с показателями, полученными нами клинически с использованием количественных шкал оценки двигательного дефицита и описанными ранее [24, 25].
R.R. Gizatullin, L.R. Akhmadeeva, PhD, Prof., D.E. Baykov, PhD, Prof., R.Kh. Bakhitova, PhD, M.O. Isrofilov, PhD, M.T. Ganieva, PhD, L.M. Zainyshev, M.V. Savchenko
Bashkir State Medical University
Аcademy of Sciences of Bashkortostan Republic
Ufa University of Science and Technology
Tajik State Medical University
Contact person: Rinat R. Gizatullin, gizatullinrr@neuroufa.ru
Purpose of the study was to analyze the condition of brain white matter using magnetic resonance imaging tractography (MRIT) in stroke survivors with paresis within a year in comparison with patients with no motor problems and no history of stroke.
Material and methods. We included into the study 65 patients aged from 45 tо 84: 42 of them (main group) had cerebral strokes during a year before our exam and paresis, 23 patients didn’t have strokes and served as controls. All of them were examined using clinical and instrumental (MRIT) approaches. The characteristics of the stroke survivors were the following: National Institutes of Health Stroke Scale – 4 [2.0–12.0], Rankin Scale – 8.5 [3.25–12.0], Rivermead Mobility Index – 3.0 [2.0–4.0].
Results and conclusions. Based on the results of the data obtained, in the group of patients with a history of cerebral stroke, there was a significant difference between the values of the fractional anisotropy coefficient in the affected and healthy hemisphere: 0,023 compared to 0,003 in the controls. It was also noted that the modulus of the average diffusion rate difference between the hemispheres in the group with strokes was significantly higher, compared to the control group: 31,7 vs. 4.3. These data are supported by diffusion tensor imaging scores.
These results indicate the significance of neuroimaging of corticospinal tracts (CST) for modeling the regression of motor deficiency after cerebral strokes and recommending individual trajectory of medical rehabilitation for each patient knowing the grade of morphological deficiency in CST.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.