Комплексная терапия хронического болевого синдрома у пациентов с остеоартритом коленных суставов
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование было включено 60 пациенток с ОА коленных суставов с наличием нейропатического компонента боли (НКБ) (DN4 > 4 баллов). Методом случайных чисел пациентки разделены на две группы:
первая группа ‒ получающая терапию ацеклофенаком (Аэртал®) и прегабалином (Прегабалин-Рихтер), вторая группа ‒ принимающая ацеклофенак (Аэртал®) в течение шести недель. Всем вошедшим в исследование пациенткам было проведено клинико-неврологическое и ревматологическое обследование с оценкой функционального индекса WOMAC, интенсивности боли при движении и в покое по ВАШ, нейропатической боли по опросниам DN4 и Pain DETECT, эмоционально-аффективных нарушений по HADS.
Результаты. В первой группе оказались пациентки с более тяжелым и длительным течением заболевания, более выраженным НКБ, однако рентгенологические изменения в суставах, интенсивность боли по ВАШ (как в покое, так и при движении), качество жизни, выраженность тревоги и депрессии по HADS были одинаковыми в обеих группах. Проведенное исследование показало положительную динамику в обеих группах в отношении НКБ, однако комплексная терапия с применением препарата из группы антиконвульсантов (Прегабалин-Рихтер) продемонстрировала более значимый положительный эффект не только в отношении НКБ, но и в отношении функциональной активности (по индексу WOMAC), выраженности боли (по ВАШ).
Заключение. Пациентов с ОА коленных суставов необходимо до начала терапии обследовать на предмет наличия выраженной центральной сенситизации с помощью опросников нейропатической боли, в частности по опроснику DN4. Комплексная терапия с применением антиконвульсанта у пациентов с ОА коленных суставов, имеющих признаки нейропатической боли, позволяет не только эффективно уменьшить выраженность болевого синдрома, но и улучшить функциональную активность пациентов, а следовательно, качество жизни.
Материал и методы. В исследование было включено 60 пациенток с ОА коленных суставов с наличием нейропатического компонента боли (НКБ) (DN4 > 4 баллов). Методом случайных чисел пациентки разделены на две группы:
первая группа ‒ получающая терапию ацеклофенаком (Аэртал®) и прегабалином (Прегабалин-Рихтер), вторая группа ‒ принимающая ацеклофенак (Аэртал®) в течение шести недель. Всем вошедшим в исследование пациенткам было проведено клинико-неврологическое и ревматологическое обследование с оценкой функционального индекса WOMAC, интенсивности боли при движении и в покое по ВАШ, нейропатической боли по опросниам DN4 и Pain DETECT, эмоционально-аффективных нарушений по HADS.
Результаты. В первой группе оказались пациентки с более тяжелым и длительным течением заболевания, более выраженным НКБ, однако рентгенологические изменения в суставах, интенсивность боли по ВАШ (как в покое, так и при движении), качество жизни, выраженность тревоги и депрессии по HADS были одинаковыми в обеих группах. Проведенное исследование показало положительную динамику в обеих группах в отношении НКБ, однако комплексная терапия с применением препарата из группы антиконвульсантов (Прегабалин-Рихтер) продемонстрировала более значимый положительный эффект не только в отношении НКБ, но и в отношении функциональной активности (по индексу WOMAC), выраженности боли (по ВАШ).
Заключение. Пациентов с ОА коленных суставов необходимо до начала терапии обследовать на предмет наличия выраженной центральной сенситизации с помощью опросников нейропатической боли, в частности по опроснику DN4. Комплексная терапия с применением антиконвульсанта у пациентов с ОА коленных суставов, имеющих признаки нейропатической боли, позволяет не только эффективно уменьшить выраженность болевого синдрома, но и улучшить функциональную активность пациентов, а следовательно, качество жизни.


Остеоартрит (ОА) – широко распространенное заболевание. По данным Всемирной организации здравоохранения, ОА болеет около 4% населения земного шара, а в 10% случаев он является причиной инвалидизации. Частота OA увеличивается с возрастом. ОА страдает около 50% лиц старше 65 лет [1].
Основным проявлением остеоартрита коленных суставов является хронический болевой синдром. Именно он снижает качество жизни пациентов, заставляет обращаться за медицинской помощью.
Остеоартрит является классической моделью хронической мышечно-скелетной боли [2].
Согласно современным представлениям хроническая боль является самостоятельной болезнью, которая проявляется не только болью, но и вегетативными, эмоциональными и другими психическими нарушениями, формированием неадаптивного болевого поведения.
Патогенез хронической боли ‒ это сложная многоуровневая система, в которой участвуют механизмы периферической сенситизации, обусловленные активацией болевых рецепторов на периферии. При продолжающейся периферической сенситизации включаются центральные механизмы: центральные болевые нейроны становятся гипервозбудимыми, снижается порог их активации, они начинают воспринимать неболевые стимулы как боль (аллодиния), сами генерировать болевые импульсы (вторичная гипералгезия) ‒ это явление называют центральной сенситизацией (ЦС). Снижается также активность антиноцицептивных систем, чему способствует как ЦС, так и многочисленные психосоциальные факторы (тревога, страх, неверные копинг-стратегии и др.).
Причиной боли при ОА коленных суставов являются структурные и биохимические изменения, возникающие в кости, синовии, периартикулярных тканях, мышцах. Сам хрящ ‒ это аваскулярная и неиннервируемая ткань, не являющаяся источником боли. При ОА источники боли представлены нехрящевыми структурами сустава, включающими синовиальную оболочку, кость и периартикулярные ткани [3].
Воспалительные стимулы инициируют каскад биохимических событий: выделение субстанции P, брадикинина, фактора некроза опухоли альфа, интерлейкинов, хемокинов, фактора роста нервов, симпатических аминов, лейкотриенов, простагландинов и др. Этот воспалительный процесс индуцирует гипералгезию периферических ноцицепторов. Сопровождающий воспалительные изменения ангиогенез стимулирует прорастание новых сенсорных волокон в ткани поврежденного сустава и может способствовать хронизации боли даже после стихания воспаления [4]. Итак, механизмы периферической сенситизации при ОА хорошо изучены и известны.
Однако хроническая боль – это прежде всего заболевание центральной нервной системы. В ее патогенезе участвуют такие центральные механизмы, как ЦС и снижение активности нисходящих антиноцицептивных систем или дезингибиция.
Процессы, происходящие в центральной нервной системе при ОА, в настоящий момент плохо известны. Однако ряд фактов указывает на патогенетическое значение центральных механизмов. Изучение хронического болевого синдрома при ОА выявило ряд противоречий: отсутствуют корреляции между степенью структурных изменений в области пораженного сустава и интенсивностью боли, у 40% пациентов, имеющих изменения в суставах и окружающих тканях, боль вовсе отсутствует [5], а до 44% пациентов после адекватно выполненного эндопротезирования коленного сустава продолжают испытывать боль [6]. Около трети пациентов с ОА коленного сустава имеют качественные характеристики нейропатической боли: онемение, жжение, аллодинию, прострелы, сравнимые с ударом тока, и др. [7‒9]. Перечисленные особенности хронического болевого синдрома при ОА коленных суставов можно объяснить наличием выраженной ЦС у ряда пациентов.
При прогрессировании заболевания происходит изменение процессов контроля и модуляции боли, которое приводит к возникновению ряда сенсорных проявлений, ассоциирующихся с типичной нейропатией: локальной и отраженной гипералгезии, аллодинии, дизестезии и гипестезии. Каскад механизмов воспаления усиливает активность периферических ноцицепторов, это явление носит название периферической сенситизации. Длительно существуя, она приводит к спонтанной активности центральных ноцицептивных нейронов и дезингибиции, то есть ЦС и хронизации процесса [10]. Функциональная магнитно-резонансная томография головного мозга показала, что множество областей в головном мозге участвуют в патогенезе хронической боли при ОА: ствол мозга, передняя поясная кора, правая дорсолатеральная префронтальная кора, левая средняя фронтальная извилина и левая латеральная затылочная область [11]. Следовательно, сенситизация центральных ноцицептивных нейронов может быть причиной разницы между степенью повреждения сустава и клинической интенсивностью боли.
Препаратами выбора для терапии ОА являются нестероидные противовоспалительные препараты (НПВП), однако от 27 до 61% пациентов продолжают испытывать хроническую боль и не удовлетворены лечением [12].
Основным показанием для использования НПВП является наличие вторичного синовита. Согласно современным представлениям синовит облигатно развивается при ОА, поэтому за рубежом был принят термин «остеоартрит», подчеркивающий постоянность воспалительного компонента в синовии. Безусловно, НПВП эффективно уменьшают воспаление и купируют боль при ОА, однако неизбежность развития побочных эффектов со стороны желудочно-кишечного тракта, печени, почек, а также сердечно-сосудистой системы заставляет очень тщательно относиться к выбору препарата для конкретного пациента, ориентируясь на наличие того или иного сопутствующего заболевания, возраст, вредные привычки и т.д. Известно также, что неселективные НПВП, особенно при длительном применении, негативно влияют на хрящ. Этот факт также затрудняет эффективное лечение боли и воспаления при ОА [13].
Согласно современным рекомендациям лечения хронической боли при наличии нейропатической боли или в тех случаях, когда имеются качественные характеристики нейропатической боли, следует назначать комплексное лечение с применением препаратов центрального действия [14]. Это положение следует учитывать для повышения эффективности противоболевой терапии ОА.
Цель исследования
Целью нашего исследования стала оценка эффективности прегабалина в комплексной терапии хронического болевого синдрома у больных ОА коленных суставов.
Материал и методы
В исследовании приняли участие 60 пациенток с ОА коленных суставов. Критерии включения в исследование:
- первичный ОА коленных суставов согласно критериям Американской ревматологической ассоциации;
- женщины в возрасте от 45 до 65 лет;
- жительницы Москвы и Московской области;
- боль нейропатического характера по опроснику DN4 (Douleur Neuropathique 4 questions);
- подписанное информированное согласие.
Критерии исключения:
- наличие сопутствующих заболеваний, сопровождающихся хроническим болевым синдромом, не связанным с ОА (корешковый синдром, диабетическая или алкогольная полинейропатия и др.);
- наличие психических заболеваний, затрудняющих адекватную оценку болевого синдрома, эмоционального состояния и заполнение опросников;
- пациенты, имеющие противопоказания к назначению прегабалина;
- хондропротективная терапия, принимаемая пациентом не менее чем за три месяца до начала исследования;
- неподписание информированного согласия.
После обследования и подписания информированного согласия все пациентки были разделены на две группы по 30 человек. Группы были сформированы на основании порядкового номера: нечетные номера образовали первую группу, четные – вторую группу. Первая группа получала терапию НПВП Аэртал® (100 мг два раза в сутки в течение 42 дней) плюс Прегабалин-Рихтер (75 мг два раза в сутки в течение 14 дней, далее по 150 мг два раза в сутки в течение 28 дней), вторая группа – только монотерапию Аэрталом (100 мг два раза в сутки в течение 42 дней).
Дизайн исследования включал три визита: первый визит – включение в исследование, клинико-неврологическое обследование, оценка функциональной активности (индекс WOMAC – Western Ontario and McMaster Universities Osteoarthritis Index), интенсивности боли при движении и в покое (ВАШ – Визуальная аналоговая шкала), нейропатической боли (опросники DN4 и Pain DETECT), эмоционально-аффективной сферы (опросник HADS – Hospital Anxiety and Depression Scale), качества жизни (опросник EQ-5D – European Quality of Life Questionnaire), второй визит (через 14 дней) – определение индекса WOMAC, интенсивности боли в движении по ВАШ, третий визит (через 42 дня) – обследование, аналогичное обследованию во время первого визита.
Результаты
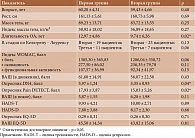
Средний возраст включенных в исследование пациенток с ОА коленных суставов составил 59,82 ± 4,46 года (от 49 до 65 лет). Клинико-неврологическое исследование не выявило поражения периферической соматосенсорной нервной системы и центральных ее отделов, способного объяснить появление нейропатических болевых феноменов. Поэтому наличие нейропатических болевых феноменов было расценено нами как клинические проявления ЦС. Клинические особенности пациенток и исходные данные в обеих группах представлены в табл. 1.
Основные характеристики пациенток при включении в исследование свидетельствовали о достоверно более выраженном нейропатическом компоненте боли (НКБ) по данным опросников DN4 и Pain DETECT (5,97 ± 1,24 vs 5,35 ± 0,93 балла (p < 0,04) и 17,93 ± 3,87 vs 15,03 ± 5,26 балла (p < 0,02) соответственно), большей длительности заболевания (12,97 ± 4,86 vs 9,74 ± 6,26 года (p < 0,02)) в первой группе. Для них также была характерна более выраженная функциональная недостаточность по индексу WOMAC (1295,67 ± 370,41 vs 874,90 ± 261,56 балла (p < 0,05)). Следовательно, путем случайной рандомизации в первой группе оказались пациентки с более тяжелым и длительным течением заболевания, более выраженным НКБ, однако рентгенологические изменения в суставах, интенсивность боли по ВАШ (как при движении, так и в покое), качество жизни, выраженность тревоги и депрессии по HADS были одинаковыми в обеих группах.
Оценка качественных характеристик боли по опроснику DN4 показала в процентном соотношении большую положительную динамику в первой группе с применением комплексной терапии (НПВП + антиконвульсант) по следующим показателям: жжение, прострелы как удар током, ползание мурашек, покалывание, онемение, пониженная чувствительность к прикосновению и покалыванию, аллодиния (табл. 2).
Полученные данные подтверждают наличие ЦС у ряда пациентов с ОА коленного сустава, поскольку комплексная терапия, направленная на центральные механизмы боли, показала более значимое улучшение качественных характеристик боли – уменьшение выраженности жжения, прострелов, онемения, пониженной чувствительности к холоду и прикосновению, аллодинии (главного маркера ЦС).
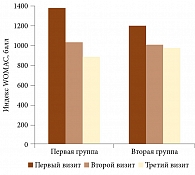
Динамика показателей функциональной активности по индексу WOMAC в обеих группах на фоне терапии представлена на рис. 1. Изменение значений индекса в первой группе в ходе трех визитов носило достоверный характер: 1385,30 ± 365,83 vs 1034,70 ± 402,37 vs 886,64 ± 456,31 балла на трех визитах соответственно (p = 0,01). Улучшение показателей составило 35%. Во второй группе показатели индекса WOMAC также изменялись: 1206,04 ± 358,72 vs 1016,45 ± 428,52 vs 976,55 ± 408,02 балла. Однако статистически достоверное улучшение было между первым и вторым визитами (p = 0,002) в отличие от первого и третьего визитов (р = 0,49). Улучшение составило 19%.
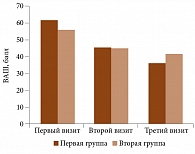
Динамика показателей интенсивности болевых ощущений по ВАШ при движении в области коленных суставов была идентична показателям индекса WOMAC. Положительные изменения отмечались в обеих группах: в первой группе – 61,60 ± 14,91 vs 45,34 ± 16,14 vs 36,24 ± 18,09 балла, достоверно между визитами (p = 0,01), во второй группе – 56,07 ± 22,58 vs 44,86 ± 18,68 vs 41,96 ± 24,04 балла, достоверного улучшения между вторым и третьим визитами не произошло (р = 0,41) (рис. 2).
Достоверные изменения показателей индекса WOMAC и ВАШ на протяжении всей терапии (первый – третий визиты) свидетельствуют о более длительном действии комплексного лечения, включающего прегабалин, в отличие от относительно более кратковременного эффекта монотерапии НПВП.
Показатели НКБ оценивали до начала терапии (первый визит) и через 42 дня (третий визит). Терапия в обеих группах имела положительное влияние согласно опросникам DN4 и Pain DETECT. Однако следует обратить внимание на то, что комплексная терапия с применением препарата Прегабалин-Рихтер оказала статистически более значимый положительный эффект на величину показателей нейропатических опросников (табл. 3).
За время исследования у 20% (шести) пациенток первой группы отмечались головокружения или ощущение «пьяной головы» в первые три ‒ пять дней от начала лечения с последующим самостоятельным купированием, дискомфорт и боли в эпигастральной области были отмечены в обеих группах: в первой группе у 20% (шести) пациенток, во второй у 24% (семи) пациенток, однако добавление омепразола к основной терапии купировало нежелательные явления. Одна пациентка второй группы была исключена из исследования после второго визита из-за подозрения на инфаркт миокарда (в специализированном отделении диагноз не подтвердился).
Обсуждение результатов
При назначении терапии хронического болевого синдрома следует учитывать его механизмы. Так, при ОА коленных суставов ноцицептивный механизм является очевидным и обусловлен воспалительным и дегенеративным процессом в области пораженного сустава.
В недавно проведенном исследовании Е.Ф. Туровской было показано, что нейропатические черты в отсутствие каких-либо признаков поражения нервной системы имели место у 37% пациентов [15]. Эти данные подтверждаются рядом зарубежных исследований. Показана эффективность дулоксетина у 30% пациентов с ОА коленных суставов по сравнению с плацебо [16], подтверждена роль супраспинальных механизмов в патогенезе хронической боли при ОА коленных суставов с помощью функциональной магнитно-резонансной томографии [11]. Суммируя эти данные, можно полагать, что в ряде случаев боль при ОА коленных суставов носит смешанный характер: ноцицептивный и дисфункциональный, и основным механизмом, поддерживающим в этих случаях боль в хроническом состоянии, является ЦС. Нейропатические черты и недостаточную эффективность НПВП можно объяснить именно ЦС как ведущим механизмом.
Механизм-направленная терапия является залогом успеха подавления хронической боли. В связи с этим нами было проведено исследование эффективности комбинированной терапии (ацеклофенак + прегабалин), нацеленной на оба механизма ‒ ноцицептивный и дисфункциональный, и противовоспалительной монотерапии (ацеклофенак). Отбор пациенток осуществляли с помощью опросника DN4. Этот опросник позволяет выявить клинические характеристики нейропатической боли у пациентов с ОА коленных суставов. Однако неврологический осмотр не выявил признаков поражения нервной системы, поэтому эти характеристики были расценены в качестве признаков ЦС как ведущего механизма.
Ацеклофенак (Аэртал®) является дериватом диклофенака, однако он действует более селективно в отношении циклооксигеназы 2. Данные многочисленных исследований свидетельствуют о сопоставимой эффективности ацеклофенака с диклофенаком и другими неселективными НПВП при лучшей переносимости, что позволяет считать ацеклофенак (Аэртал®) препаратом, показанным больным ОА. В экспериментальных исследованиях также показано позитивное влияние ацеклофенака на синтез гиалуронана и протеогликанов при уменьшении их распада, что позволяет говорить об отсутствии негативного действия на хрящ и рекомендовать препарат для длительного применения у больных с ОА [13]. Механизм действия прегабалина заключается в модулировании активности гипервозбужденных нейронов. Прегабалин связывается с дополнительной субъединицей (альфа-2-дельта-протеин) потенциал-зависимых кальциевых каналов нейрона, тем самым модулируя приток ионов кальция [17]. Таким образом уменьшается повышенный выброс нейромедиаторов и прекращается передача болевого импульса на вышестоящие уровни, снижается центральная сенситизация и связанные с ней клинические проявления.
Проведенное исследование показало, что комбинированная терапия, в состав которой входили НПВП (Аэртал®) и антиконвульсант (Прегабалин-Рихтер), была более эффективной при наличии признаков ЦС у пациентов с ОА коленных суставов и действовала более длительно – на протяжении всего курса терапии (42 дня).
С целью повышения эффективности фармакотерапии пациентов с ОА коленных суставов необходимо до начала терапии обследовать на наличие выраженной ЦС с помощью опросников нейропатической боли (DN4). При оценке более четырех баллов целесообразно назначение комбинированной терапии, включающей НПВП и прегабалин в дозе 150–300 мг/сут, для более эффективного контроля боли.
Ye.S. Filatova, Ye.F. Turovskaya, L.I. Alekseyeva
Research Institute of Rheumatology named after V.A. Nasonova
Contact person: Yekaterina Sergeyevna Filatova, es-filatova@mail.ru
Objective: to evaluate the effectiveness of pregabalin in patients with osteoarthritis (OA) of the knee joint.
Material and Methods. 60 women-patients with OA of the knee joint and neuropathic pain component (DN4 > 4 points) were divided into two groups by the random number method. For six weeks, the first group received aceclofenac (Airtal®) and pregabalin (Pregabalin-Richter), the second – aceclofenac (Airtal®). All participants underwent the clinical and neurological examination, which included an assessment of the severity of OA on the WOMAC index, neuropathic pain on the DN4 and painDETECT questionnaires, the intensity of pain when moving and at rest on VAS. In addition, the quality of their lives by EQ-5D and the anxiety and depression degree by HADS were studied.
Results. Despite the fact that the first group was consisted of patients with more severe and prolonged course of OA, expressed neuropathic component of pain (NP), radiological changes in the joints, the intensity of pain both in motion and at rest, quality of life, the severity of anxiety and depression in the first and the second groups were the same. On the background of therapy, positive trend in NP was observed in both groups, but it was more pronounced in the second group. In patients of this group, more significant improvement in functional activity and decrease in the severity of pain were recorded.
Conclusion. Before the start of treating the patients with OA of the knee joint, it is necessary to examine them for the presence of central sensitization. Complex therapy, including anticonvulsants, in patients with OA of the knee joint and signs of neuropathic pain can reduce the severity of the pain syndrome; improve the functional activity of the joint and, consequently, the quality of life.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.