Комплексное лечение пароксизмальной и перманентной форм хронической нейропатической боли
- Аннотация
- Статья
- Ссылки

Введение
НБ чаще всего имеет хроническое течение, сопровождается большим количеством коморбидных расстройств, гораздо труднее поддается лечению, чем многие другие типы хронической боли, и приводит к стойкой нетрудоспособности [4, 5], что определяет ее медико-социальную значимость [6]. Если острая боль обоснованно рассматривается как симптом, то хроническая боль может приобретать черты болезни («боль как болезнь»), которая проявляется вегетативными, психоэмоциональными нарушениями и приводит к формированию неадаптивного болевого поведения. В клинической практике не менее чем в половине случаев наблюдается сочетание хронического болевого синдрома с депрессией, что объясняется общностью патогенетических механизмов, лежащих в основе развития этих заболеваний, – недостаточностью серотонинергических и норадренергических систем мозга [7, 8]. Хроническая НБ значительно снижает качество жизни пациентов, их повседневную активность, вызывает нарушения сна, усиливает тревожность, депрессию [9, 10]. Около 20% взрослого населения Европы страдает хронической болью умеренной или тяжелой степени, и тем не менее до трети больных не получают никакого лечения, 50% назначается неадекватная терапия и только 2% лечатся у специалистов по боли [11]. Высокая интенсивность и стойкость хронической НБ, ее особый, часто мучительный характер, резистентность к традиционным методам обезболивания обусловливают исключительную актуальность этой проблемы [12].
Тригеминальная невралгия (ТН) и диабетическая полинейропатия (ДПН) – типичные примеры периферической хронической НБ пароксизмального и перманентного характера соответственно. ТН является одной из самых распространенных прозопалгий и относится к числу наиболее устойчивых болевых синдромов в клинической неврологии [13]. Диабетическая дистальная симметричная сенсорно-моторная полинейропатия – наиболее часто встречающийся тип диабетической нейропатии (выявляется более чем у 50% больных сахарным диабетом (СД) 1 и 2 типов) [14]. По данным литературы, полученным с 1992 по 2002 г., наблюдается тенденция к увеличению частоты встречаемости как ДПН, так и ТН [15]. Несмотря на появившееся в последние годы большое количество обзоров литературы и метаанализов, посвященных проблеме лечения НБ [16, 17], исследователи не пришли к единому мнению относительно основных принципов медикаментозной терапии этого заболевания. Лечение НБ все еще остается недостаточно эффективным: значительное улучшение в результате проведенного фармакологического лечения отмечается менее чем у половины пациентов [4, 5]. Подчеркнем, что простые анальгетики и нестероидные противовоспалительные препараты в терапии хронической боли при ДПН и ТН малоэффективны [1]. К сожалению, в мире более 60% больных с хронической НБ по-прежнему получают эти препараты, что чрезвычайно опасно при длительном применении, поскольку приводит к осложнениям со стороны ЖКТ, печени и крови. Результаты многочисленных мультицентровых плацебоконтролируемых исследований позволяют рекомендовать в качестве базовых препаратов в терапии депрессии и хронического болевого синдрома антидепрессанты [18]. С другой стороны, для лечения хронической НБ боли также широко применяются антиконвульсанты, в частности, при ТН препаратом первого выбора является карбамазепин [19, 20]. Однако достаточной доказательной базы эффективности препаратов для лечения НБ не существует, не установлено, какой антидепрессант или антиконвульсант наиболее эффективен, не изучен спектр и частота вызываемых ими побочных действий. Нередки ситуации, когда возникает потребность в комбинации лекарственных средств. Назначение «рациональной полифармакотерапии» (одновременное применение препаратов из разных групп) позволяет повысить эффективность лечения при меньших дозировках препаратов и меньшем количестве нежелательных явлений [21]. Основной целью проведенного исследования являлся анализ анальгезирующей эффективности и безопасности антидепрессанта Велафакса (венлафаксина) в комбинации с антиконвульсантом Финлепсином (карбамазепином) при лечении пациентов с пароксизмальной (ТН) и перманентной (ДПН) НБ.
Материал и методы исследования
Было обследовано 52 пациента, из них 25 больных с ДПН (14 женщин и 11 мужчин, средний возраст 55,2 ± 13,4 лет, средняя длительность заболевания 4,1 ± 1,9 года) и 27 пациентов с ТН (16 женщин и 11 мужчин, средний возраст 58,1 ± 13,6 лет, средняя длительность заболевания 5,3 ± 2,9 лет). В контрольную группу вошли 17 здоровых испытуемых: 10 женщин и 7 мужчин, средний возраст 53,4 ± 11,7 лет. Всем пациентам назначалась комбинация антиконвульсанта с антидепрессантом. Пациенты обеих групп принимали Финлепсин по схеме: 200 мг – 1/2 таб. 2 раза в сутки, с постепенным увеличением дозы препарата на 1/2 таб. каждые 3 дня до 800 мг в сутки в 4 приема; а также Велафакс по схеме: 37,5 мг – по 1/2 таб. 2 раза в сутки, с постепенным увеличением дозы препарата на 1/4 таб. каждые 3 дня до 75 мг в сутки в 2 приема. В такой дозе больные принимали лекарственные средства в течение 8 недель, а затем постепенно, в той же последовательности, дозу препаратов снижали вплоть до полной их отмены. Все пациенты были предупреждены о цели приема препаратов, возможных побочных эффектах терапии и подписали информированное согласие. Обследование пациентов проводилось при первичном обращении к врачу и по окончании курса лечения.
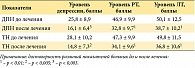
Клинико-неврологическое и соматическое обследование включало сбор анамнестических данных, подробный неврологический осмотр. Использовались также параклинические методы исследования (КТ или МРТ головного мозга, электронейромиографическое обследование с измерением скорости проведения возбуждения по нервам и параметров М-ответа). Оценка болевого синдрома проводилась с использованием опросника DN4 для определения признаков НБ, визуальной аналоговой шкалы (ВАШ) для оценки интенсивности боли и болевого опросника Мак-Гилла для определения качественных особенностей боли [22]. Психометрические методы использовали для определения уровней реактивной (РТ) и личностной (ЛТ) тревожности (Тест Спилбергера в модификации Ю. Л. Ханина) и степени выраженности депрессии (опросник Бека). Для исследования состояния вегетативной нервной системы использовалась вегетативная анкета (ВА) [23]. Статистическую обработку данных проводили с использованием статистического пакета программ «Statistica 6.0 for Windows». Применяли методы математической статистики с использованием t-критерия Стьюдента, дисперсионного анализа ANOVA. Для определения взаимосвязей между количественными признаками рассчитывали коэффициент корреляции Пирсона (r). Для выявления латентных факторов, объясняющих корреляционные связи между отдельными переменными, проводили многофакторный анализ методом главных компонент. Различия считали достоверными при уровне значимости р < 0,05.
Результаты исследования и обсуждение
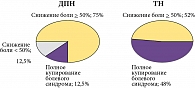
При оценке болевого синдрома с помощью опросника DN4 в обеих группах больных средний балл составил более 5, что позволило квалифицировать боль как нейропатическую [24]. Многомерная оценка боли по опроснику Мак-Гилла показала, что по количеству выбранных дескрипторов у больных обеих групп преобладали сенсорные, что указывает на ведущую роль чувствительных расстройств в формировании болевого синдрома при этих заболеваниях [22]. В результате проведенного лечения в группе больных ДПН у 12,5% пациентов болевой синдром купировался полностью, а уменьшение интенсивности боли не менее, чем на 50% от исходного значения выявлялось в 75% случаев. У остальных больных интенсивность боли снижалась менее чем на 50%. У больных с тригеминальной невралгией полное купирование болевого синдрома наблюдалось в 48% случаев, у остальных больных (52%) выявлялось уменьшение интенсивности боли ≥ 50% от исходного значения (рис. 1). Средняя интенсивность боли по ВАШ достоверно снизилась с 5,8 ± 2,3 баллов до 2,5 ± 1,6 баллов в группе больных с ДПН и с 7,3 ± 2,9 баллов до 3,4 ± 1,9 баллов в группе пациентов с ТН (p < 0,001). Кроме того, после проведенного курса полифармакотерапии в обеих группах больных отмечалось уменьшение значений всех показателей болевого опросника Мак-Гилла (табл. 1). После курса лечения в группах больных ДПН и ТН с равной достоверностью (p < 0,05) уменьшилась степень нарушения вегетативных функций (по данным ВА), которая в группе ДПН после лечения составила 35,3 ± 8,8 баллов (50,3 ± 9,8 баллов до лечения), а в группе ТН – 30,5 ± 8,1 баллов (40,4 ± 9,2 баллов до лечения). Анализ эмоционального состояния больных показал достоверное снижение уровней депрессии, РТ и ЛТ в обеих группах больных (табл. 2).
В настоящее время не существует универсальных методов терапии НБ. При выборе лекарственных препаратов необходимо принимать во внимание наличие коморбидных расстройств (тревоги, депрессии, заболеваний внутренних органов и т. д.). Помимо непосредственного анальгетического эффекта должны учитываться другие положительные эффекты выбранного препарата (уменьшение уровней тревоги, депрессии, улучшение сна и настроения), а также его переносимость и возможность развития серьезных осложнений. На основании исследований, проведенных в последние годы, можно сделать вывод, что препаратами первого выбора при лечении НБ и депрессии являются трициклические антидепрессанты (ТЦА) – имипрамин, амитриптилин, кломипрамин [18]. Преимущество ТЦА заключается в выраженном двойном воздействии – ингибировании обратного захвата серотонина и норадреналина, что обеспечивает высокую эффективность как в случае депрессии, так и хронической боли. Однако использование этих препаратов ограничено большим количеством побочных эффектов и целым рядом серьезных противопоказаний. Сравнимы с ТЦА по эффективности как в терапии хронической НБ, так и в коррекции эмоционально-аффективных нарушений селективные ингибиторы обратного захвата серотонина и норадреналина. Эти препараты также являются антидепрессантами «двойного действия», которые увеличивают содержание в мозге и серотонина, и норадреналина, при этом у них отсутствуют побочные действия, присущие классическим ТЦА.
К группе селективных ингибиторов обратного захвата серотонина относится препарат Велафакс (венлафаксин). Показана высокая эффективность, хорошая переносимость и безопасность венлафаксина при лечении хронической НБ и депрессии [25]. Поскольку, как указывалось выше, ДПН и ТН сопровождается депрессией и тревогой, актуальным является выбор препарата, который эффективно воздействует на эти психопатологические состояния и обладает высоким профилем безопасности. Велафакс имеет меньше противопоказаний по сравнению с ТЦА, поэтому ему следует отдавать предпочтение при лечении пожилых больных с сопутствующей соматической патологией [25]. Немаловажным фактором при выборе препарата является также его относительно низкая стоимость.
После курса проведенного лечения в группах больных с ДПН и ТН отмечалось не только значительное снижение уровня НБ, но также уменьшение степени выраженности вегетативных, тревожных и депрессивных расстройств, на основании чего можно сделать вывод о высокой эффективности Велафакса в комплексной терапии (в сочетании с Финлепсином) болевой формы диабетической полинейропатии и тригеминальной невралгии. Следует отметить более высокую эффективность препарата при лечении пароксизмальной формы НБ по сравнению с перманентной (полное купирование болевого синдрома отмечалось в значительно бóльшем проценте случаев в группе пациентов с ТН по сравнению с группой больных с ДПН).
Заключение
Хронический болевой синдром часто сочетается с депрессией и тревогой, что существенно затрудняет лечение пациентов с хронической НБ. Диагностика и оценка коморбидных расстройств у пациентов с ДПН и ТН имеют важное значение при выборе терапии.
Проведенное исследование продемонстрировало высокую эффективность комбинации Велафакса и Финлепсина как в лечении хронической НБ перманентного (ДПН) и пароксизмального (ТН) характера, так и в терапии коморбидных расстройств (вегетативной дисфункции, тревожно-депрессивного синдрома). Эффективность Велафакса обусловлена, главным образом, стимуляцией серотонинергических и норадренергических систем, участвующих в механизмах развития хронической боли и тревожно-депрессивных расстройств. В 2010 г. появилась новая форма Велофакса – Велафакс МВ 75 мг и 150 мг. Показана более высокая эффективность полифармакотерапии при пароксизмальном типе боли по сравнению с перманентным. Оптимальной схемой комплексного лечения перманентной и пароксизмальной форм хронической НБ, сопровождающихся выраженными тревожно-депрессивными и вегетативными расстройствами, является применение антидепрессантов Велафакса (суточная доза 75 мг в два приема) или его новой формы Велафакса МВ в сочетании с антиконвульсантом Финлепсином (суточная доза 800 мг в четыре приема) в течение 8 недель.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.