Вегетативная нервная система и ее нарушения
- Аннотация
- Статья
- Ссылки
- English
Под термином «вегетативная (автономная) нервная система» понимается не соматическая, не контролируемая, самостоятельная система. Этот термин удобен для понимания проблемы в аспекте искусственного разделения нервной системы.
Вегетативные функции автономны, поскольку не требуют сознательного контроля. Однако они неразрывно связаны с другими нейронными цепями. Границ, отделяющих вегетативные цепи от неавтономных, общего метаболизма, иммунитета, эмоций, умственного развития, не существует [1, 2]. Дисфункция вегетативной нервной системы (ВНС) реализуется под воздействием генетических и средовых факторов. Например, дисфункция ВНС плода (генетический «первый удар») и дисбаланс иммунитета матери под влиянием факторов окружающей среды («второй удар») могут привести к дисбалансу нейромедиаторов и развитию шизофрении [3, 4].
Основная функция вегетативных нервных путей заключается в бессознательном контроле немоторных органов-мишеней организма. Иннервация каждого органа-мишени адаптирована к балансу между первичными потребностями самого органа и необходимостью контроля в повседневной деятельности. В частности, непрерывная перфузия печени – условие для выживания. Перфузия кожи определяется прежде всего потребностями терморегуляции организма, в значительно меньшей степени – потребностями кожи в оксигенации. Иннервация органов может основываться на внутренних требованиях в одних условиях и на внешних – в других [2]. Мышечная перфузия в состоянии покоя рассматривается как функция, контролируемая извне: кровь поступает к мышцам или отводится от них в зависимости от системного объема крови и требований к давлению. Перфузия работающих мышц регулируется изнутри: повышение концентрации лактата отключает способность симпатических волокон контролировать сосудистый тонус [5]. На более высоких уровнях управления в центральной нервной системе (ЦНС) вегетативные интеграторы и сигналы объединяются и выражаются подсознательно через центральную автономную сеть [6]. Это лежит в основе циркадианного ритма вегетативной функции.
ВНС подразделяют на симпатическую (грудопоясничный отдел) и парасимпатическую (краниосакральный отдел). Такое разделение обусловлено анатомическим происхождением, а не физиологическими особенностями. Через свои ветви – симпатическую нервную систему (СНС) и парасимпатическую нервную систему (ПНС), а также эффекторные молекулы, включая норадреналин и ацетилхолин, ВНС управляет реакциями, обеспечивающими соответствующее артериальное давление (АД), частоту сердечных сокращений (ЧСС) и вазорегуляторные ответы на обычные ежедневные раздражители. Нарушение регуляции этой системы при остром и хроническом стрессе, старении, наличии органических, идиопатических и других причин приводит к развитию сердечно-сосудистой патологии, в том числе артериальной гипертензии (АГ), ишемической болезни сердца, аритмии, застойной сердечной недостаточности, нередко – фатальному исходу [7].
ВНС контролирует гомеостаз. Циркадианный ритм вегетативной функции возникает в супрахиазматическом ядре и передается в гипоталамус и ствол мозга. Свет падает на дендриты ганглиозных клеток сетчатки (не палочки или колбочки), сигнал передается через ретиногипоталамический тракт, формируя через специальный белок циркадианный ритм. Другие ключевые эфферентные сигналы происходят из островковой коры и миндалевидного тела. Основная интеграция вегетативного сигнала в сердечно-сосудистую систему происходит в продолговатом мозге. Механорецепторы барорефлекса кровеносных сосудов грудной клетки и шеи передают информацию об АД и объеме крови через языкоглоточный (из сонных артерий) и блуждающий (из аорты) нервы к ядру одиночного тракта (NTS) в задней части продолговатого мозга. Возбуждаемые нейроны NTS иннервируют дорсальное двигательное ядро блуждающего нерва, регулирующее парасимпатическую исходящую активность. Тормозные нейроны проецируются в вентролатеральной области продолговатого мозга, от которого регулируется отток симпатических сигналов. Наиболее важным из таких участков считается ростральный вентролатеральный отдел продолговатого мозга [8–10]. Практически каждая система органов получает нормативную информацию от ЦНС через эфферентные вегетативные пути. Но афферентный вход в центральную вегетативную сеть регулирует не только функции автономной системы, но и многие функции ЦНС, обычно не воспринимаемые как вегетативные. Данная теория представляет собой всеобъемлющую интеграцию вегетативной деятельности мозга и тела. Барорецепторы каротидного синуса передают информацию о растяжении стенки сосуда до ствола мозга через языкоглоточный нерв. Другие барорецепторы в дуге аорты и крупных сосудах грудной клетки передают аналогичную информацию через блуждающий нерв в те же ядра ствола мозга. Рецепторы низкого давления связаны блуждающим нервом со стволом мозга, они реагируют на объем крови в грудной клетке. Стволовая структура мозга (NTS), получающая эту информацию, расположена в дорсальном мозговом слое на уровне четвертого желудочка. Нейромедиаторы (глутамат и оксид азота), высвобождаемые в NTS, могут приводить к сердечно-сосудистым заболеваниям. Каудальный вентролатеральный отдел продолговатого мозга и ростральный вентролатеральный отдел являются важнейшими структурами ствола мозга, участвующими в модуляции исходящего симпатического сигнала.
Классификация вегетативных расстройств
Вегетативные расстройства подразделяют на структурные (первичная вегетативная недостаточность) и функциональные.
Структурные нарушения определяются как имеющие очевидные патологические отклонения, которые влияют на вегетативные нервные пути периферической или центральной нервной системы (например, диабетическая автономная нейропатия). В настоящее время патологическая основа функциональных расстройств однозначно не доказана. Особое внимание уделяют симптоматике, таким синдромам, как синдром постуральной тахикардии (POTS), комплексный регионарный болевой синдром, синдром раздраженного кишечника. Соотношение структурных и функциональных расстройств по мере изучения ВНС и ее расстройств будет сдвигаться в сторону структурных. В частности, длительно расцениваемые при дисплазии соединительной ткани многие функциональные расстройства получили определение структурных при выявлении нарушенной миелинизации мелких нервных волокон, аутоиммунном подавлении синаптического сигнала.
Структурные нарушения подразделяют на затрагивающие центральные пути и изменения периферической системы. На данный момент при функциональных расстройствах специфическая патология не выявляется, поэтому аналогичную градацию провести невозможно.
Периферические расстройства классифицируют в зависимости от преимущественно страдающего звена – афферентного или эфферентного. Большинство периферических нарушений касаются эфферентных нервов. Но очень немногие структурные расстройства являются изолированно центральными или периферическими, локализованными в афферентном или эфферентном участке. В частности, диабет поражает центральные пути, при болезни Паркинсона в процесс вовлекаются периферические ганглии.
Структурные и функциональные дисавтономии различаются и по своим клиническим проявлениям. Пациенты со структурными нарушениями, несмотря на распространенные патологические изменения в нервной системе, малосимптомны [11–13]. Пациенты с функциональными расстройствами предъявляют множество разнообразных жалоб (полиалгический синдром), указывающих на мультисистемность. Структурные и функциональные нарушения контрастируют и по прогнозу. Смертность при структурных нарушениях ВНС существенно выше, чем при функциональных. Тем не менее следует помнить, что с функциональных нарушений могут дебютировать структурные.
Клинические характеристики нарушения функций вегетативной нервной системы
Зрение существенно определяется ВНС. Размер зрачка, аккомодация хрусталика, глазное кровообращение, внутриглазное давление регулируются ВНС. При ортостатической гипотензии возникает гипоперфузия мозга с потемнением в глазах и туннелированием зрения. При фундусскопии выявляется сужение сосудов глазного дна. Возможно снижение внутриглазного давления. Под вегетативным контролем находится функция зрачков. При дисавтономии они недостаточно быстро расширяются в темноте [14].
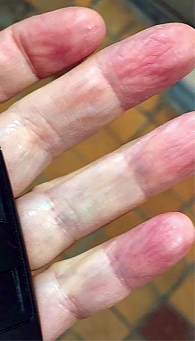
Сердечно-сосудистая система. В вертикальном положении систолическое АД (САД) снижается примерно на 10 мм рт. ст., диастолическое АД (ДАД) повышается на 5 мм рт. ст. ЧСС увеличивается на 5–20 уд/мин. Это обусловлено гравитационным перераспределением крови и депонированием 300–800 мл в ногах и висцеральной венозной системе. Венозный возврат к сердцу уменьшается. Активируется СНС, снижается активность ПНС, возрастают ЧСС и тонус сосудов. В усилении притока крови к сердцу задействованы мускулатура ног и дыхательно-брюшная мускулатура. В случае дисавтономии АД в первые десять секунд вертикализации снижается на 30% от исходного (начальная ортостатическая гипотензия). Обычно возникает рефлекторная тахикардия, и в ближайшие 30–60 секунд АД восстанавливается. До нормализации АД не исключены головокружение, тошнота, потеря сознания. Снижение АД на 20/10 мм рт. ст. и более в первые три минуты вертикализации рассматривается как ортостатическая гипотензия (ОГ). Для людей с АГ наиболее информативным критерием диагностики ОГ считается снижение САД > 30 мм рт. ст. в горизонтальном положении. В отсутствие снижения АД на 20/10 мм рт. ст. в вертикальном положении при наличии симптоматики и тахикардии говорят об ортостатической непереносимости. Состояние квалифицируется как POTS, если в первые десять минут после вертикализации ЧСС увеличивается более чем на 30 уд/мин, а у людей младше 19 лет – более чем на 40 уд/мин [15]. ОГ выявляется легче через час после обильной еды, особенно углеводной, в меньшей степени – белковой или жирной. Первичная ОГ – ранняя или легкая форма адренергической недостаточности сочетается с синдромами гипермобильности суставов, Элерса – Данлоса, Марфана, чаще регистрируется у девочек-подростков [16] (рисунок).
Вторичная ОГ сопровождает кровотечения, дегидратацию, лихорадку, инфекцию, прием гипотензивных препаратов, злоупотребление диуретиками и антидепрессантами, нарушение активации тучных клеток, демпинг-синдром [17]. Хроническая ОГ отражает серьезные структурные нарушения ВНС с плохим прогнозом: синдром Ши-Дрейджера, автономная нейропатия, многие генетические расстройства, амилоидоз, сахарный диабет, злокачественные новообразования. Застойная сердечная недостаточность маскирует ОГ. Прогноз вторичной ОГ значительно хуже, чем при POTS [18].
Выделяют отстроченную ОГ. Отсроченная ортостатическая гипотензия (ООГ) проявляется прогрессирующим снижением уровня САД ≥ 20 мм рт. ст., ДАД – более 10 мм рт. ст. после третьей минуты и продолжается до 45-й минуты ортостаза. Прогноз ООГ неблагоприятен. Среди взрослых пациентов без ОГ ожидаемый уровень смертности < 10%, среди пациентов с ООГ – 50%.
Респираторная система. При вегетативной недостаточности функция легких обычно сохраняется. Недостаточность ВНС часто сопровождается апноэ во сне. В результате может резко увеличиться АД. Частично это обусловлено ролью углекислого газа в определении уровня АД при вегетативной недостаточности. Гиповентиляция способствует повышению уровня АД, гипервентиляция может значительно снизить его. Ортостатическая одышка может быть признаком ОГ при POTS. Наиболее вероятная причина – сниженное наполнение кровью верхних долей легких в положении стоя.
Обсуждается роль ВНС в возникновении бронхиальной астмы. В ее генезе может быть аномальное срабатывание вегетативного рефлекса ныряния. Предполагается, что стресс во время беременности воздействует на развивающуюся нервную систему. Это приводит к повышению парасимпатической реактивности, чрезмерно активируется рефлекс ныряния в ответ на намокание и охлаждение лица и носа, как бывает при инфекции верхних дыхательных путей. В водной среде у млекопитающих срабатывает рефлекс – сокращаются гладкие мышцы дыхательных путей, чтобы минимизировать объем легких и не допустить азотного наркоза при погружении на глубину. Подобный рефлекс у человека способен привести к патологическому сужению дыхательных путей. Рефлекс ныряния является рудиментом нашего водного прошлого. Согласно гипотезе, классические условно-рефлекторные реакции сами по себе становятся постоянными триггерами повторяющихся обструктивных хрипов. Симптомы, возникающие таким образом, провоцируются стрессами, не зависят от наличия аллергенов и нарушения проходимости дыхательных путей при сенсибилизации [19].
Желудочно-кишечный тракт. Расстройства ВНС, вовлекая парасимпатическую и симпатическую системы желудочно-кишечного тракта (ЖКТ), сопровождаются мультисистемными последствиями. Гастроинтестинальная дисфункция ВНС не является изолированной. Она сочетается с иными проявлениями дисфункции ВНС: с POTS, сердечно-сосудистой дисфункцией, чаще симпатической [20]. Нарушения моторики ЖКТ влияют на всасывание, экскрецию и иммуногенез [21, 22]. У многих пациентов с вегетативной недостаточностью возникает запор. На фоне диабетической диcавтономии не исключены тяжелая диарея или гастропарез. Диарея, сопровождаемая гиповолемией, приводит к артериальной гипотензии. Проблемы возникают при специфической дисавтономии. Пациенты с синдромом Шегрена обычно страдают гастроэзофагеальным рефлюксом. Соответственно у них высока вероятность развития рака пищевода. Болезнь Чагаса может сопровождаться ахалазией и расширением пищевода, а следовательно, рвотой. Ахалазия также присутствует при болезни Олгроува (алакримия, ахалазия, нечувствительность к адренокортикотропному гормону и автономная нейропатия), картированной на хромосоме 12q13 (мутация в гене AAAS). При дисавтономии возможна поспрандиальная стенокардия без изменения сегмента ST (чаще в вертикальном положении). Дисфункция кишечной нервной системы при ряде заболеваний является результатом апоптоза кишечных нейронов и окислительного стресса. Возникает дисбаланс тормозных и возбуждающих нейропептидов.
Нарушения мочеполового тракта. Дисфункция ВНС может сопровождаться недержанием мочи, интерстициальным циститом, бесплодием, предменструальным синдромом, тазовой болью, эректильными нарушениями и преждевременным семяизвержением [23]. Мочевой пузырь часто непосредственно участвует в диcавтономии, что проявляется в императивности, задержке, недержании [24]. Урологическое обследование может ошибочно показать гипертрофию предстательной железы у мужчин и привести к хирургическому вмешательству. Но такая операция редко помогает пациентам с вегетативной дисфункцией, ее следует рекомендовать только после тщательной консультации уролога и невролога, чтобы выяснить, действительно ли определяющее значение имеет физическая обструкция. Препараты класса альфа-1-антагонистов, используемые для лечения гипертрофии предстательной железы, способны агравировать ОГ. В то же время альфа-1-агонист мидодрин, используемый для повышения АД, иногда усиливает дисфункцию мочевого пузыря. При задержке мочи часто возникают инфекции мочевыводящих путей. При вегетативной недостаточности уровни ренина в плазме бывают низкими, вероятно, из-за нарушения симпатической регуляции почек. Однако функция почек сохраняется при большинстве форм вегетативной недостаточности, за исключением дефицита дофамин-бета-гидроксилазы. В последнем случае у взрослых возникает почечная недостаточность. Мочевые симптомы при функциональных расстройствах проявляются ургентными позывами, реже недержанием и задержкой.
Эректильная дисфункция часто является первым признаком дисавтономии у мужчин. Обычно заболевание имеет преимущественно парасимпатическую природу, его очень трудно лечить медикаментозно. Силденафил вызывает значительную гипотензию. Когда заболевание затрагивает только симпатические пути (например, дефицит дофамин-бета-гидроксилазы), эректильная функция может быть нормальной, но возникает ретроградная эякуляция. Терапия дроксидопой, которая восстанавливает норадреналин, нередко способствует антеградной эякуляции [25]. Информации о влиянии вегетативной системы на женскую сексуальную функцию мало.
ВНС и овариально-менструальный цикл. Различный гормональный статус в фолликулярной и лютеиновой фазах способствует вегетативной модуляции [26]. В лютеиновой фазе в большей степени, чем в фолликулярной, активирована симпатическая нервная система. Как следствие – ощущение напряженности и усталости.
Сохраняющаяся физическая усталость лютеиновой фазы в менструальном периоде и сопутствующие симптомы могут быть причиной плохого настроения. Парасимпатическая активность выше в менструальной фазе по сравнению с лютеиновой и фолликулярной.
Нарушения потоотделения (гипо- или гипергидроз) наблюдаются при нарушениях функции вегетативной терморегуляции [27]. Гипергидроз может быть генерализованным, очаговым, первичным (эпизодическая гипотермия с гипергидрозом или синдром Шапиро) или вторичным по отношению к другим расстройствам. Как правило, гипергидроз носит эпизодический характер. Опухоли способны вырабатывать цитокины, провоцирующие лихорадку и впоследствии потливость. Гипергидроз также встречается при резко выраженном симпатическом возбуждении (белая горячка, прессорные всплески барорефлекторной недостаточности). Существуют доказательства увеличения числа потовых желез в сочетании с повышением активности симпатических волокон, проходящих через Т2–Т4. Это особенно заметно у лиц молодого возраста. До 25% таких людей имеют положительный семейный анамнез гипергидроза. Первичный очаговый гипергидроз поражает ладони, подошвы, подмышки или лицо, может быть настолько выраженным, что ограничивает социальные контакты. Дистальный гипогидроз типичен для периферической нейропатии. Глобальный гипогидроз возникает при множественной системной атрофии, распространенной автономной ганглиопатии, но может быть идиопатическим. Нарушения потоотделения оценивают по данным анамнеза, осмотра, терморегуляторной потовой пробы, судомоторного аксонного рефлекса. Лечение эссенциального гипергидроза включает пероральные мускариновые антагонисты или клонидин, местное применение хлорида алюминия, ионофорез, введение ботулотоксина А, блокаду симпатических ганглиев, радиочастотную абляцию, симпатэктомию (в основном при ладонном гипергидрозе). Идиопатический гипергидроз следует отличать от компенсаторного. Гипергидроз верхней части тела встречается на фоне гипогидроза нижней части, обычно при дисавтономии, что парадоксально описывается пациентами как чрезмерное потоотделение в верхней части тела. Пациенты, которые утрачивают способность потеть большей частью тела, сохраняют непропорциональное потоотделение в области шеи и лица. В условиях гипергидроза требуется исключение локального гипо/ангидроза, что наблюдается при структурных дисавтономиях. Уменьшение потоотделения компенсируется пребыванием во влажном помещении, ношением в жарком климате влажной рубашки (этого хватает на 30–90 минут).
Оценка функции вегетативной нервной системы
Оценка функции ВНС начинается со сбора жалоб и анамнеза. Анамнез и клиническое обследование – важнейшие диагностические ресурсы. При сборе анамнеза и обследовании следует сосредоточиться на следующих жалобах и состояниях.
Общие признаки: усталость, утомляемость, чувство разбитости, бледность, немотивированные головные боли, птоз, быстрый переход от слез к смеху, эмоциональная лабильность, метеолабильность, апноэ во сне, гипнагогические подергивания (толчки) конечностей, слюнотечение, пошатывание при ходьбе, другие мозжечковые и экстрапирамидные симптомы, отсутствие пиломоторной реакции, аномальное регулирование температуры тела, повышенное артериальное давление в положении лежа.
Ортостатическая непереносимость или гипотензия: головокружение при вертикализации с/без нарушения зрения, тошнота, тахикардия, дискомфорт в шее и плечах, слабость, невнятная речь, пресинкопе, обморок. Симптомы провоцируются и усиливаются пребыванием в постели, высокой температурой, гипервентиляцией, голодом.
Кожные проявления: сухость кожи, чрезмерное потоотделение, ливедо.
Мочеполовая дизавтономия: никтурия, задержка мочи, недержание мочи (как следствие – высокая вероятность рецидивирующей инфекции мочеполовых путей), нарушения утренней эрекции, импотенция, преждевременная эякуляция, ретроградная эякуляция, нарушения менструального цикла, изменение либидо.
Желудочно-кишечная дизавтономия: запор, анорексия, ощущение постпрандиальной полноты, диарея, недержание стула, потеря массы тела.
Существует много тестов по определению функции ВНС. Многие из этих тестов применимы как в амбулаторных, так и в домашних условиях. Но у конкретного пациента интерпретация тестов может быть затруднена, поскольку нормативные показатели могут различаться, в частности, по половозрастным характеристикам. Формирование базы – вопрос времени и ресурсов. Поэтому большинство врачей, наблюдающих пациентов с вегетативными расстройствами, формируют набор диагностических проб, соответствующих их специализации. Неврологу необходима топическая локализация поражения, информация о типах вовлеченных волокон, функции и тесты, отличающие симпатическую систему от парасимпатической. Кардиологу важно оценить вероятность и выраженность сердечно-сосудистой дисрегуляции. Для этого измеряются уровень АД, ЧСС в покое, при нагрузке и ортостатических пробах. Эндокринолога интересует концентрация циркулирующих катехоламинов, кортикостероидов, половых гормонов, ренина, характеризующая гормональную составляющую дисфункции ВНС. Офтальмолог оценивает вегетативную регуляцию по функции зрачков. Несмотря на чрезвычайно большой набор клинических и диагностических тестов, на практике реализуется персонифицированный подход к диагностике и лечению в каждом конкретном случае.
Заключение
Диcфункцией ВНС страдают около 70 млн человек в мире. Дисавтономия полиморфна, затрагивает все органы и системы организма. Первичная дисавтономия обычно наследуется или возникает на фоне дегенеративного заболевания, тогда как вторичная развивается в результате другого заболевания или травмы. Дисавтономию трудно диагностировать, ошибочный диагноз – явление не редкое. Симптомы дисфункции ВНС иногда ошибочно трактуются как симптомы другого существующего заболевания. Успешный диагноз часто является результатом сотрудничества нескольких специалистов. Междисциплинарный подход, предполагающий участие в ведении пациента нескольких специалистов разных дисциплин, обеспечивает более широкий взгляд на систему вовлеченных органов и более точный диагноз. Не существует единого метода лечения всех дисавтономий. В качестве базовой терапии рекомендуются нормализация сна, физические нагрузки, отказ от алкоголя, курения, адаптогены.
V.M. Delyagin, PhD, Prof.
Dmitry Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology
N.I. Pirogov Russian National Research University
Contact person: Vasily M. Delyagin, delyagin-doktor@yandex.ru
The autonomic nervous system (ANS) is autonomous because it does not require conscious control. However, it is inextricably linked with other neural circuits. There are no boundaries separating vegetative chains from non-autonomous ones, from general metabolism, immunity, emotions, mental and mental development. A feature of the ANS is the ability to carry out innervation based not only on internal requirements for some and external requirements for other organs, but innervation of the organ on internal requirements in some conditions and on external requirements in others. The ANS consists of the sympathetic (thoracolumbar) and parasympathetic (craniosacral). This division determines anatomical origin rather than physiological features. The circadian rhythm of autonomic function originates in the suprachiasmatic nucleus and is transmitted to the hypothalamus and brain stem. Each organ system receives regulatory information from the central nervous system (CNS) through autonomic efferent signals. Afferent input to the central autonomic network regulates not only autonomic system outputs but also many CNS functions not typically considered autonomic. The presented concept explains the comprehensive integration of the autonomic activity of the brain and body, the central and peripheral nervous systems. Very conventionally, structural disorders of the ANS (which have obvious pathological abnormalities that directly affect the autonomic nerve pathways of the peripheral or central nervous system) and functional disorders (currently do not have a clearly proven pathological basis) are distinguished. The article analyzes symptoms of ANS disorders in age and gender aspects. The algorithms of diagnosis, non-drug and drug treatment are presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.