Лечение острых и хронических болевых синдромов при пояснично-крестцовой радикулопатии
- Аннотация
- Статья
- Ссылки
- English

Боль в нижней части спины вследствие высокой распространенности обусловливает высокие показатели временной нетрудоспособности и представляет собой серьезную медико-социальную проблему [1]. В разные периоды жизни с болевыми синдромами пояснично-крестцовой локализации к врачу обращаются 80–90% людей. Среди лиц в возрасте 20–50 лет дорсопатии занимают второе место по частоте возникновения (после респираторных заболеваний) и третье место среди причин госпитализации [2]. Дегенеративно-дистрофические заболевания пояснично-крестцового отдела позвоночника приводят к временной нетрудоспособности 15–25% работающего населения в возрасте 30–60 лет [3].
Радикулопатия, возникающая в результате патологических изменений позвоночника, относится к одной из наиболее тяжело протекающих форм неврологических проявлений вертеброгенной патологии периферической нервной системы. В случае компримирования спинномозгового корешка продолжительность нетрудоспособности значительно увеличивается, требуются дорогостоящие обследование и лечение. При неадекватной оценке имеющихся симптомов дегенерации может наступить стойкая нетрудоспособность со значительным неврологическим дефицитом. При высокой распространенности боли в нижней части спины симптомы компрессии спинномозгового корешка отмечаются у 3–5% людей в популяции. Пик заболеваемости у мужчин приходится на возраст 40–50 лет, у женщин – 50–60 лет [4–7].
Ведущий механизм патогенеза спондилогенных радикуло- и миелопатий – компрессионное воздействие на артериальные и венозные сосуды спинномозгового корешка. Более грубое сдавление приводит к механическому повреждению волокон. Это происходит при ограничении пространства в месте прохождения спинномозгового корешка в межпозвонковом отверстии – на уровне латерального кармана (в большинстве случаев при грыже межпозвонкового диска). Стенозирующее воздействие может также наблюдаться при обызвествлении связочного аппарата с формированием остеофитов, гипертрофии суставных фасеток или капсулярных сегментарных процессах. Возможно сочетание этих изменений, особенно при значительном снижении высоты межпозвонковых дисков [7, 8].
Дегенеративно-дистрофические изменения развиваются постепенно и затрагивают различные структуры позвоночного двигательного сегмента и позвоночника в целом: межпозвонковые диски (остеохондроз), суставы (деформирующий спондилоартроз), связочный аппарат (спондилез). Особое анатомическое расположение спинного мозга, корешков, радикулярных и радикуломедуллярных сосудов (артерий и вен), межпозвонковых дисков, суставов обусловливает появление сосудисто-ирритативных или проводниковых синдромов компрессионного характера при патологических изменениях как в межпозвонковых дисках, так и в связочно-суставных структурах позвоночного двигательного сегмента. Наибольшая механическая нагрузка на единицу площади межпозвонкового диска становится причиной более раннего возникновения дегенеративно-дистрофических изменений в нижнешейных и нижнепоясничных сегментах позвонков [9].
Первоначальные дегенеративные изменения затрагивают студенистое ядро, затем фиброзное кольцо. Происходят дегидратация и снижение высоты межпозвонкового диска. Изменяются физико-химические свойства студенистого ядра, снижается устойчивость эластических волокон к механической нагрузке, происходят разрыв волокон фиброзного кольца и проникновение фрагментов ядра в поврежденные участки. При прогрессировании изменений зона повреждения эластических волокон увеличивается, присоединяются локальные микроциркуляторные нарушения воспалительного характера в оболочках кармана твердой мозговой оболочки и корешков спинного мозга. С проникновением фрагментов студенистого ядра в участки поврежденного фиброзного кольца формируются протрузии и грыжи диска. В последующем присоединяются компенсаторные реактивно-дистрофические изменения в фиброзном кольце (краевые костные разрастания), связках, межпозвонковых суставах. Выраженность и уровень дегенеративных процессов в позвоночном двигательном сегменте определяют локализацию и характер неврологических синдромов. Поддерживающим фактором компрессии в межпозвонковом отверстии становится участие асептического иммунного воспаления при контактировании антигенов студенистого ядра с иммунокомпетентными клетками. Наибольшая податливость венозной стенки служит причиной раннего возникновения венозного полнокровия, хронической венозной гипоксии и отека.
Среди основных факторов, приводящих к дегенеративным изменениям в дисках, – повышенная осевая нагрузка, особенно импульсная, большой интенсивности, с микротравматизацией студенистого ядра и фиброзного кольца. Снижение устойчивости к нагрузке часто обусловлено конституционально-дизрафическими особенностями анатомического строения позвонков и молекулярно-биохимического состава структур межпозвонкового диска и связочного аппарата, в частности при диспластическом кифосколиозе, врожденной узости позвоночного канала и др.
Наиболее драматические изменения происходят при формировании грыжи межпозвонкового диска. Отсутствие связи между степенью и выраженностью дегенеративных изменений межпозвонковых дисков и локальным компрессионным сегментарным процессом подтверждено данными клинико-нейровизуализационных сопоставлений [8].
При продолжительности около трех недель боли классифицируют как острые. Возможно также подострое (от трех до 12 недель) или хроническое (более 12 недель, до 25 эпизодов в год) течение боли [9]. В инициации острой боли решающую роль играют механические факторы. Стойкий болевой синдром может быть связан не столько с компрессией корешка, сколько с вторичными токсическими, дизиммунными и дисметаболическими процессами, которые индуцируются внедрением структур пульпозного ядра в эпидуральное пространство и воздействием биологически активных веществ, высвобождающихся при участии иммунокомпетентных клеток. Ключевую роль в возникновении сегментарной корешковой боли могут играть воспалительные изменения в ближайших структурах – спинномозговом корешке с последующим вовлечением спинального ганглия.
Механизм повреждения связан с накоплением фосфолипазы А2, оксида азота, простагландина Е. В результате каскадных биохимических преобразований наблюдается интра- и экстраневральный отек, происходит ирритация чувствительных волокон, изменяется способность проведения импульса. Более выраженное повреждение ведет к грубому структурному поражению и блокирует проведение импульсации различной модальности [10]. О вовлечении спинномозгового корешка свидетельствует стойкая или пароксизмальная интенсивная боль, иррадиирующая в соответствующий дерматом нижней конечности. Возникающая сегментарная болевая импульсация также запускает регионарные мышечно-тонические синдромы. Ограничивается подвижность в пояснице, нарушается чувствительность сегментарного характера, снижаются или выпадают соответствующие глубокие рефлексы, наблюдаются гипотония и слабость мышц, иннервируемых данным корешком [5–7]. Длительное воздействие повреждающего фактора на рецепторные и проводниковые структуры афферентной модальности вызывает изменение боли – присоединяется невропатический компонент.
В целом с учетом особенностей патофизиологических механизмов различают ноцицептивные и невропатические боли. Ноцицептивная боль обусловлена действием повреждающего фактора (механической травмы, ожога, воспаления и т.д.) на периферические структуры восприятия – болевые рецепторы. Этот тип боли характерен для острой стадии спондилогенной радикулопатии. В подобной ситуации все отделы нервной системы функционируют адекватно. Однако при длительном раздражении структур, обеспечивающих передачу болевой импульсации, присоединяются другие механизмы боли. Наибольшее значение имеют структурные нарушения в системах, контролирующих боль. В результате появляется болевая импульсация – невропатическая боль. Многочисленные эпидемиологические исследования указывают на возникновение и даже преобладание невропатического компонента боли при спондилогенной радикулопатии в 20–35% случаев [11].
Кроме того, имеются механизмы хронизации боли, которые обусловлены импульсацией афферентной модальности от болевых рецепторов (ноцицепторов), расположенных в сухожильно-фасциальных структурах паравертебральной области, и не связаны с функциональными нарушениями чувствительной порции спинномозгового корешка. Однако появившаяся болевая импульсация мощным потоком направляется в спинной мозг и переключается через синаптические контакты. В ответ повышается синтез провоспалительных цитокинов (интерлейкинов) и простагландинов, активируются интактные рецепторы за пределами зоны болевой стимуляции. Возникающая в результате импульсация (восходящая) индуцирует повторную волну выброса медиаторов воспаления в синаптических терминалях. Повышенная возбудимость ноцицепторов оказывает рефлекторное активирующее действие на мотонейроны сегментарного аппарата спинного мозга, формируя защитное мышечное напряжение.
Локальное мышечное напряжение инициирует нейрогенное воспаление, возникают ограниченные зоны болезненных мышечных уплотнений, усиливается поток ноцицептивных импульсов в структуры центральной нервной системы. В дальнейшем сенситизируется значительная часть центральных ноцицептивных нейронов. Замкнутый порочный круг играет важную роль в пролонгировании соматогенной боли и развитии хронических болевых синдромов. На месте возникшего нейрогенного воспаления происходит поражение аксонов, со временем разрастается соединительная ткань, нарушается целостность миелиновой оболочки [12].
Очевидно, что в сложившейся ситуации эффективность лечения будет определяться возможностями воздействия на разных этапах, уровнях возникновения и передачи импульсов боли. В случае острой компрессии корешка преобладает ноцицептивный компонент боли, при этом целесообразно назначение нестероидных противовоспалительных препаратов (НПВП) и миорелаксантов. Преимущества имеют НПВП – селективные ингибиторы циклооксигеназы (ЦОГ), поскольку при их применении существенно снижается риск эрозивно-язвенного поражения желудочно-кишечного тракта. Сегодня наиболее исследованным препаратом из класса селективных ингибиторов ЦОГ-2 является Мовалис, оригинальный мелоксикам.
При острой боли в спине продолжительность лечения невелика и эффект наступает в течение нескольких дней. Интенсивная боль, особенно при компрессии корешка, может потребовать лечения в течение трех-четырех недель. Длительный прием неселективных НПВП существенно повышает риск негативного воздействия на желудочно-кишечный тракт с возможностью развития эрозивно-язвенного поражения.
При невропатической боли НПВП обладают меньшим эффектом. В подобных ситуациях назначаются антидепрессанты, противоэпилептические средства, опиоидные анальгетики. В литературе представлен также большой опыт использования витаминов группы В. Немедикаментозные методы лечения (физиотерапия, лечебная гимнастика, электрофизиологические воздействия и др.) при формировании невропатической боли у пациентов со спондилогенной радикулопатией неэффективны.
Консервативное лечение позволяет купировать болевой синдром, уменьшить компрессию радикулярных и радикуломедуллярных артерий, ослабить мышечно-тонические реакции, улучшить кровообращение в зоне компрессии, повысить устойчивость к гипоксии.
Кроме того, применяются нейрохирургические вмешательства. Техники операции совершенствуются, разрабатываются минимально инвазивные методы. Ряд авторов указывают, что частота рецидива болевого синдрома при нейрохирургических операциях составляет 15–45% случаев [13–16]. Современные нейрохирургические техники позволяют снизить ее до 3–8% [17]. При этом повторные операции обнаруживали грыжи диска в 1,9–29% случаев [3, 13, 14, 17].
Основная причина возобновления боли – возникновение рубцово-спаечных процессов в эпидуральном пространстве и стенозирование позвоночного канала, изменение биомеханики позвоночного двигательного сегмента в зоне оперативного вмешательства. К появлению вертеброгенных и корешковых синдромов могут приводить неполное удаление или оставление мигрировавших секвестрированных фрагментов измененного диска, недостаточная декомпрессия сосудисто-нервных структур в межпозвонковом отверстии. В подобном случае лечебно-диагностические мероприятия позволяют эффективно и в короткие сроки устранить компрессию сосудисто-нервных структур корешка и спинного мозга, минимизировать неврологический дефицит и предупредить рецидивирование.
Цель исследования
Улучшить эффективность лечения спондилогенных пояснично-крестцовых радикулоишемий путем использования селективного ингибитора ЦОГ-2 мелоксикама (Мовалиса).
Гипотеза исследования
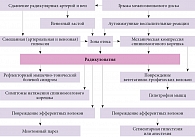
Основной механизм патогенеза развития спондилогенных пояснично-крестцовых радикулоишемий обусловлен стенозированием межпозвонкового отверстия. Повреждение межпозвонкового диска с формированием грыжи диска этой локализации – наиболее частая причина возникновения корешкового синдрома. Несмотря на стенозирование межпозвонкового пространства, часто удается добиться улучшения состояния при консервативном лечении. В большинстве случаев ограничение резервного пространства наблюдается при формировании грыжи межпозвонкового диска с латерализацией в направлении расположения спинномозгового корешка. Реже имеет место выраженный дегенеративно-дистрофический процесс в пульпозном ядре и фиброзном кольце между смежными телами позвонков. Независимо от причины происходит компримирование сегментарных вен и артерий, обеспечивающих кровоснабжение соответствующего спинномозгового корешка. В результате возникает радикулопатия с нарушением функции двигательной и чувствительной части волокон, а также повреждение вегетативно-трофических волокон. Патогенез компрессионных радикулоишемий представлен на рис. 1.
Большинство методов лечения направлены на купирование болевого, корешкового (проявлений миотомного пареза и сегментарной гипестезии) и мышечно-тонического синдромов. Хирургическое лечение позволяет добиться декомпрессии в межпозвонковом отверстии. В той или иной степени противовоспалительные препараты разных классов оказывают противоотечное, противовоспалительное действие с уменьшением внешнего сдавления невральных структур межпозвонкового отверстия или даже позвоночного канала.
Применение противоотечных, вазоактивных, венотонизирующих препаратов купирует острые боли, уменьшает до определенного предела сдавление аксонов и дендритов волокон спинномозгового корешка, устраняет повреждение миелиновой оболочки. Таким образом, медикаментозная терапия с выбором НПВП с избирательностью действия позволяет улучшить лечение и исходы при компрессионных радикулоишемиях.
Материал и методы
Проанализированы результаты, полученные при лечении 77 больных (53 женщин в возрасте от 18 до 79 лет и 24 мужчин от 22 лет до 81 года), находившихся на стационарном и амбулаторном лечении. Дизайн исследования представлен на рис. 2.
Поводом для обращения за врачебной помощью во всех случаях был болевой синдром в нижней части спины. У всех больных отмечалась иррадиация боли в нижние конечности с распространением в зону иннервации соответствующего корешка. У большинства больных имели место клинические проявления радикулопатии L5 или S1. В исследование включали пациентов с умеренной или выраженной болью (оценка по Визуальной аналоговой шкале не менее 4 баллов) и длительностью обострения не менее месяца.
Критерии исключения: опухолевое, инфекционно-воспалительное или иное заболевание позвоночника, требующее специального лечения, выраженная деформация позвоночника, компрессия спинного мозга, другие сопутствующие неврологические, психические, серьезные или нестабильные соматические заболевания (тяжелая патология печени, сердечно-сосудистой системы, легких или почек, декомпенсированный сахарный диабет, онкологические заболевания).
В ходе комплексного обследования до начала лечения был проанализирован ряд анамнестических, клинико-неврологических, нейроортопедических, нейровизуализационных, электрофизиологических параметров. Особое значение придавали оценке ноцицептивной и невропатической боли, сопоставляя данные со сроками возникновения компрессии корешка, длительностью дорсопатии, основным патоморфологическим субстратом сдавления корешка.
Невропатический характер боли оценивали с помощью специализированной Шкалы невропатической боли (Neuropathic Pain Scale – NPS), анализируя выраженность болевого синдрома по десяти параметрам: интенсивность, острота, жгучесть, тупость, холодящий и зудящий характер, чувствительность кожи в зоне боли, переносимость боли, интенсивность поверхностной и глубинной боли. Из перечисленных пунктов два отражали общую интенсивность боли и неприятных ощущений, а восемь – специфические характеристики боли. Каждая из характеристик боли оценивалась по шкале от 0 до 10 баллов, где 0 – отсутствие признака, а 10 – самое сильное ощущение [18, 19].
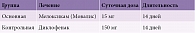
Пациенты были рандомизированы на две группы: основную (n = 42) и контрольную (n = 35). Между группами не было достоверных различий по возрасту и полу больных, длительности заболевания, интенсивности болевого синдрома. В основной группе проводился курс общепринятой медикаментозной терапии: НПВП, преимущественно селективный в отношении ЦОГ-2 (мелоксикам в дозе 15 мг/сут), внутримышечно в течение трех дней с дальнейшим переходом на энтеральный прием. Длительность лечения – 14 дней (табл. 1). Пациенты контрольной группы получали неселективный НПВП диклофенак перорально по 50 мг внутрь во время или после еды с небольшим количеством воды три раза в сутки (что соответствует средней терапевтической дозе). Диклофенак, производное фенилуксусной кислоты, обладает противовоспалительным, обезболивающим, антиагрегантным и жаропонижающим действием. Неизбирательно угнетая ЦОГ-1 и ЦОГ-2, он нарушает метаболизм арахидоновой кислоты. До начала лечения у всех пациентов оценивали противопоказания для применения, наиболее значимыми из которых были эрозивно-язвенное поражение желудка и двенадцатиперстной кишки, перенесенный острый сердечно-сосудистый эпизод (острое нарушение мозгового кровообращения или острый инфаркт миокарда), непереносимость или аллергическая реакция в анамнезе.
Диагноз устанавливали на основании клинико-неврологического обследования с помощью перечисленных выше клинических и инструментальных методик. Клинико-анамнестические данные соотносили с результатами томографических методов диагностики. Выполнялась компьютерная или магнитно-резонансная томография. По показаниям (выборочно) осуществлялась электрофизиологическая диагностика, которая позволяла объективизировать неврологический дефицит (выраженность повреждений двигательной и чувствительной порции спинномозгового корешка). Интенсивность болевого корешкового синдрома определяли по Визуальной аналоговой шкале (ВАШ). Кроме того, оценивали эмоциональный статус пациентов.
При анализе данных игольчатой электромиографии (ЭМГ) оценивали активность введения, спонтанную мышечную активность, произвольную мышечную активность (длительность, амплитуда потенциалов двигательной единицы, процент полифазных потенциалов двигательной единицы). Стимуляционную ЭМГ (сенсорный и двигательный ответы) проводили в следующих точках: n. peroneus, n. saphenous, n. tibialis, n. suralis, n. superficialis, принимая во внимание:
- дистальную латентность ответов;
- скорость проведения импульса;
- амплитуду двигательного (М-ответ) и сенсорного (невральный потенциал) ответов;
- H-рефлекс;
- отношение максимальных амплитуд Н- и М-ответов (%);
- среднюю латентность, амплитуду, хроно- и тахеодисперсию, характеристики потока (время, скорость) F-волны (мин).
В рамках электрофизиологического исследования, которое выполняли в конечной фазе наблюдения – на 10–14-й день, оценивали выраженность повреждения нейромоторного аппарата, в том числе двигательной и чувствительной порции спинномозгового корешка. Исследование осуществляли на четырехканальном компьютерном электронейромиографе «Нейро-ЭМГ-4», который позволяет проанализировать функцию сенсорных (оценка скорости поведения импульса), моторных (стимуляционные пробы) проводников, а также проявления денервации скелетных мышц (игольчатая ЭМГ). Для изучения состояния периферических отделов проводников спинного мозга показано исследование M-ответа, H-рефлекса, F-волны при стимуляции n. medianus, игольчатая ЭМГ, а передних столбов спинного мозга – невральные и двигательный вызванные потенциалы [20, 21].
Динамику клинико-неврологических синдромов оценивали на второй, седьмой и 14-й дни лечения. Обращали внимание на изменение жалоб, объективных симптомов заболевания (характер и степень нейроортопедических нарушений, выраженность мышечно-тонических болевых симптомов, тяжесть двигательных и чувствительных расстройств), функциональную активность нейромоторного аппарата. Результаты исследования обрабатывали методами вариационной статистики, вычисляя среднюю арифметическую и используя t-критерий. Большое значение придавали динамике характера боли по обеим шкалам. Полученные данные соотносили с клинико-неврологическими синдромами и выявленными изменениями.
Результаты
Среди обследованных больных преобладали женщины. В первой группе – 30 (73,2%) женщин и 12 (29,8%) мужчин, в контрольной – 23 (65,7%) женщины и 12 (34,3%) мужчин. Средний возраст женщин в основной группе составил 39,9 года, мужчин – 42,5 года, в контрольной группе – 40,1 и 37,3 года соответственно. Практически у четверти пациентов основной группы ранее отмечались эпизоды обострений, у остальных боли в спине с радикулопатией развились впервые. Схожие показатели были и в контрольной группе. Давность обострения составила от двух-трех до 14 дней.
При первичном обращении интенсивность боли по ВАШ в группах была сопоставимой: 8,6 ± 0,3 балла в контрольной группе и 8,8 ± 0,4 балла – в основной. У 37 (90,2%) пациентов основной и 33 (94,3%) контрольной группы наблюдались напряжение паравертебральных мышц и болезненность при пальпации остистых отростков позвоночника на уровне поражения. Наряду с болевым синдромом встречались и расстройства чувствительности в виде гиперестезии – у 32 (78,0%) и 28 (80,0%) пациентов соответственно, а также сочетание гиперестезии с гиперпатией – у десяти (24,%) и девяти (25,6%) больных.
Об острой фазе заболевания (сдавление корешка соответствующего уровня) свидетельствовали симптомы натяжения спинномозговых корешков на стороне поражения у 37 (90,2%) и 29 (82,9%) больных соответственно. У 15 (36,6%) пациентов основной группы и 12 (34,3%) контрольной группы наблюдали проявления миотомного пареза в виде уступчивости длинного разгибателя большого пальца стопы. Слабости и гипотрофии икроножных мышц ни в одном случае не было. В целом у 54 (70,1%) больных отмечалось снижение или выпадение коленного рефлекса при компрессии корешка L4. При обнаружении острого корешкового синдрома на уровне S1 определялось выпадение ахиллова рефлекса у 51 (67,1%) больного.
Таким образом, представленная выборка включала две однородные по возрасту группы с незначительным преобладанием в каждой женщин. У пациентов имелись отчетливые признаки радикулопатии, обусловленной компримирующим воздействием измененных межпозвонковых дисков. В момент обращения интенсивность болевого синдрома позволяла проводить консервативную терапию и отражала фазу обострения. При первичном обращении преобладали ноцицептивные боли, в последующем присоединялся невропатический компонент. Признаки грубой денервации отсутствовали, что также позволило расценивать выборку как однородную.
Магнитно-резонансная томография пояснично-крестцового отдела позвоночника выявила формирование латеральных протрузий и пролапсов дисков, которые преимущественно соотносились с клинико-неврологическими проявлениями у пациентов обеих групп.
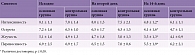
При сопоставлении данных по шкале NPS отмечена наиболее выраженная динамика параметров, характеризующих невропатический компонент боли: интенсивность, острота, жгучесть, переносимость и др. (табл. 2). Наибольшее значение в характеристике боли имели ее интенсивность и острота (около 7–8 баллов). Исследование на 14-й день выявило более выраженную положительную динамику в основной группе (Мовалис) (см. табл. 2).
Так, у 39 (95,1%) пациентов основной и 31 (88,6%) пациента контрольной группы отмечено клиническое улучшение, что выражалось в уменьшении болевого синдрома по ВАШ до 1,5 ± 0,5 и 2,5 ± 0,5 балла соответственно. Кроме того, на фоне применения Мовалиса регрессировала неврологическая симптоматика. Чувствительные расстройства отсутствовали у 34 (82,9%) пациентов основной и 26 (74,3%) пациентов контрольной группы, а симптомы натяжения – у всех больных. В дальнейшем было достигнуто значительное улучшение: полное купирование болевого синдрома и регресс неврологической симптоматики (оживление пониженных рефлексов в 93,2 и 72,6% случаев соответственно). Таким образом, селективный ингибитор ЦОГ-2 способствовал более эффективному купированию и ноцицептивной, и невропатической боли.
Электрофизиологическое исследование продемонстрировало нормальную скорость проведения импульса по малоберцовому нерву с обеих сторон. При стимуляции малоберцовых нервов выявлено увеличение по сравнению со стороной поражения средней латентности F-волны, зарегистрировано 50–57,5% блоков проведения F-волны на пораженной и 25–30% – на противоположной конечности. Н-рефлекс не получен на стороне поражения у большинства больных основной и контрольной групп (до 80%). При проведении игольчатой ЭМГ имели место единичные положительные острые волны и потенциалы фасцикуляции m. tibialis anterior dextra, m. soleus dextra в незначительных количествах. Таким образом, электрофизиологическое исследование указывало на интактность дистальной двигательной порции, незначительное повреждение проксимальных двигательных волокон сегмента L5. Данная методика позволяет оценить функцию чувствительной двигательной части соответствующего корешка, а также продолжительность денервации сегментарных мышц. Признаки необратимой денервации отсутствовали. Диагностировано снижение функции поверхностного малоберцового нерва (сенсорная порция малоберцового нерва) с выключением афферентной части рефлекторной дуги соответствующего сегментарного рефлекса.
Полученные данные свидетельствуют об эффективности и безопасности применения Мовалиса у пациентов с пояснично-крестцовой радикулопатией. Анализ показал, что препарат эффективен при выраженном болевом синдроме и способствует его быстрому купированию [4, 6, 7, 12, 22, 23]. Лечение Мовалисом в сравнении с диклофенаком позволило эффективно снизить выраженность ноцицептивного и невропатического компонентов болевого синдрома при компрессии корешка.
Установлено, что в острой стадии компрессионно-ишемической радикулопатии наибольшее значение имеет возникновение ноцицептивной боли. Это подтверждается более высокой оценкой боли по ВАШ и особенно важно при впервые возникшем обострении. В случае длительных предыдущих эпизодов присоединяется невропатический компонент, что обусловлено изменениями в проводящих структурах ноцицептивной системы, присоединением вторичного мышечно-тонического синдрома. Соотнесение этих результатов с нейровизуализационными данными позволяет заключить, что причиной возникновения симптомов компрессии спинномозгового корешка в анализируемых группах являются протрузии и грыжи дисков. Острота воздействия на чувствительную порцию спинномозгового корешка вызвана отеком и биохимическими изменениями в месте дискорадикулярного конфликта.
Выводы
Включение препарата Мовалис (15 мг/сут в течение 14 дней) в комплексную терапию спондилогенной радикулоишемии эффективно снижает интенсивность болевого синдрома. Препарат влияет на ноцицептивный и невропатический компоненты боли. В подавляющем большинстве случаев (n = 37, 90,2%) использование Мовалиса не сопровождалось появлением гастроинтестинальных симптомов. В то время как на фоне приема диклофенака отмечались тяжесть в желудке и тошнота, которые были устранены после применения антацидных препаратов из группы ингибиторов протонной помпы (омепразола). Безопасность терапии имеет немаловажное значение, поскольку хронические боли требуют длительной и регулярной реабилитации.
V.V. Andreyev, Ye.R. Barantsevich
Academician I.P. Pavlov First St. Petersburg State Medical University
Contact person: Yevgeny Robertovich Barantsevich, professorerb@mail.ru
The efficiency of lumbosacral radiculopathy treatment with the use of non-steroidal anti-inflammatory drugs selective inhibitor of cyclooxygenase 2 meloxicam (Movalis) and non-selective inhibitor of cyclooxygenase 2 diclofenac was studied. The appointment of Movalis in comparison with diclofenac allowed to reduce effectively the severity of nociceptive and neuropathic components of pain (muscle-tonic and radicular) syndrome. Besides, the use of drugs with selectivity of blocking of the inducible enzyme of the proinflammatory series (Movalis) reduces the probability of erosive and ulcerative lesions of the gastrointestinal tract and complications of the cardiovascular system.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.