Современные стратегии эффективной фармакотерапии остеоартрита у коморбидных пациентов
- Аннотация
- Статья
- Ссылки
- English
Представлены результаты метаанализа, включающего 60 плацебо-контролируемых исследований эффективности и переносимости нестероидного противовоспалительного препарата (НПВП) из группы оксикамов лорноксикама у коморбидных пациентов с острой и ревматической болью, которые свидетельствуют о высоком анальгетическом эффекте и благоприятном профиле безопасности в отношении желудочно-кишечного тракта, сердечно-сосудистой системы и почек. Подчеркнуто преимущество лорноксикама у пациентов старше 65 лет, при назначении которого не требуется коррекции дозы. Кроме того, приводятся результаты проспективных сравнительных исследований по оценке динамики тяжести ОА при применении комбинированных препаратов из группы SYSADOA – Артра и Артра МСМ, которые подтверждают их выраженный симптом-модифицирующий эффект и хорошую переносимость, что позволяет рекомендовать данные препараты для широкого использования в клинической практике у коморбидных пациентов с ОА. Установлено, что при выраженном болевом синдроме назначение у больных ОА коленного сустава сначала Артра МСМ, затем Артра обеспечивало снижение дозы или отмену НПВП и, следовательно, предотвращало развитие нежелательных явлений, характерных для этого класса препаратов.
Представлены результаты метаанализа, включающего 60 плацебо-контролируемых исследований эффективности и переносимости нестероидного противовоспалительного препарата (НПВП) из группы оксикамов лорноксикама у коморбидных пациентов с острой и ревматической болью, которые свидетельствуют о высоком анальгетическом эффекте и благоприятном профиле безопасности в отношении желудочно-кишечного тракта, сердечно-сосудистой системы и почек. Подчеркнуто преимущество лорноксикама у пациентов старше 65 лет, при назначении которого не требуется коррекции дозы. Кроме того, приводятся результаты проспективных сравнительных исследований по оценке динамики тяжести ОА при применении комбинированных препаратов из группы SYSADOA – Артра и Артра МСМ, которые подтверждают их выраженный симптом-модифицирующий эффект и хорошую переносимость, что позволяет рекомендовать данные препараты для широкого использования в клинической практике у коморбидных пациентов с ОА. Установлено, что при выраженном болевом синдроме назначение у больных ОА коленного сустава сначала Артра МСМ, затем Артра обеспечивало снижение дозы или отмену НПВП и, следовательно, предотвращало развитие нежелательных явлений, характерных для этого класса препаратов.


Введение
Остеоартрит (ОА) – хроническое гетерогенное прогрессирующее заболевание суставов, характеризующееся деградацией экстрацеллюлярного матрикса хряща, которое сопровождается патологическим ремоделированием тканей сустава и проявляется болевым синдромом, развитием краевых остеофитов с нарушением функциональной активности и снижением качества жизни больных [1]. При ОА чаще поражаются коленные, тазобедренные, мелкие суставы кистей и позвоночник.
Согласно данным эпидемиологических исследований, в России ОА страдают более 14% населения. При этом нетрудоспособность вследствие ОА возросла в три – пять раз.
Будучи причиной стойкой утраты трудоспособности и одной из ведущих причин инвалидизации, на сегодняшний день ОА представляется важной социально-экономической проблемой [2].
Согласно современным представлениям, ОА рассматривается как заболевание суставов, в основе развития которого лежит хроническое низкоинтенсивное воспаление (low-grade inflammation) [3]. Патология характеризуется клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникающих при микро- и макроповреждениях, которые гиперактивируют адаптивные процессы тканевой репарации, включая провоспалительные реакции иммунной системы, костное ремоделирование и образование остеофитов.
Исследования последних лет дают основание полагать, что при ОА боль чаще носит смешанный характер. В частности, отмечают наличие элементов нейропатической, ноцицептивной и дисфункциональной боли. При прогрессировании заболевания нередко выявляется рефлекторный спазм мышц, сопровождающийся образованием сухожильно-мышечных контрактур, что является одной из причин усиления уже существующего болевого синдрома [4].
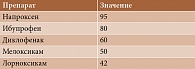
Диагноз ОА устанавливается на основании жалоб, анамнеза, данных объективного и инструментального исследований суставов (табл. 1) [5].
Современные стратегии лечения
Лечение пациентов с ОА включает фармакологические и нефармакологические методы и направлено не только на уменьшение боли и улучшение функционального состояния суставов, но и на предотвращение или замедление прогрессирования заболевания, что в конечном счете будет способствовать повышению качества жизни больных [6].
Нефармакологические методы
Нефармакологическим методам лечения придается первостепенное значение, особенно на ранних стадиях ОА. К таковым относятся образовательные программы, систематические занятия лечебной физкультурой, коррекция массы тела, правильное и своевременное применение подручных средств (хождение с тростью, палками для скандинавской ходьбы, ношение супинаторов, ортезов) и др. Физиотерапевтические процедуры назначаются в отсутствие противопоказаний с целью купирования суставной боли, уменьшения отека околосуставных тканей, явлений синовита. Наиболее широко используются фонофорез с анальгетиками, электромагнитное поле сверхвысокой и высокой частоты, магнитолазеротерапия, фонофорез глюкокортикоидов, аппликации теплоносителей (парафин, озокерит), бальнео- и гидротерапия. Для облегчения боли рекомендуются тепловые или холодовые аппликации, массаж конечностей, мануальная терапия и др. [7].
Фармакологические методы
Системная терапия. Для подавления боли на начальных стадиях ОА традиционно используются анальгетики, в частности ацетаминофен до 3 г/сут, который во многих случаях обеспечивает необходимый эффект и является сравнительно безопасным. В настоящее время ацетаминофен показан при слабой выраженности боли (≤ 40 мм по визуальной аналоговой шкале (ВАШ)) и наличии противопоказаний к назначению нестероидных противовоспалительных препаратов (НПВП) [8].
При сохранении выраженного болевого синдрома на фоне указанного выше лечения или невозможности назначения НПВП к терапии добавляют опиоидные анальгетики или антидепрессанты. Трамадол или Залдиар (трамадола гидрохлорид 37,5 мг и ацетаминофен 375 мг) применяют коротким курсом при выраженном болевом синдроме или неэффективности предшествующей терапии [9].
Ведущее место при лечении ОА занимают НПВП, что является патогенетически обоснованным, поскольку основной причиной развития боли и одним из факторов прогрессирования патологии признан воспалительный процесс.
Терапевтический эффект НПВП реализуется за счет подавления активности циклооксигеназы (ЦОГ) с последующим снижением синтеза провоспалительных простагландинов.
В последние годы внимание было привлечено к проблеме сердечно-сосудистой безопасности средств, избирательно подавляющих ЦОГ-2. Отсутствие у ингибиторов ЦОГ-2 влияния на агрегацию тромбоцитов поставило вопрос об их потенциальной тромбогенной опасности [10].
В связи со сказанным выше встает вопрос о целесообразности назначения наиболее безопасного с учетом соотношения «польза – риск» НПВП для коморбидных пациентов. Одним из таких препаратов является лорноксикам. Лорноксикам (препарат Ксефокам) относится к оксикамам. Он является мощным сбалансированным ингибитором ЦОГ-1/ЦОГ-2 и отличается быстрым началом действия, высокой скоростью элиминации и низким объемом распределения.
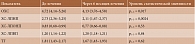
Результаты метаанализа, включавшего 60 плацебо-контролируемых исследований эффективности и переносимости лорноксикама у коморбидных пациентов с острой (n = 7661) и ревматической (n = 3621) болью, свидетельствуют о низком риске нарушений функции почек (0,2%), развития сердечно-сосудистых нежелательных эффектов в виде повышения артериального давления и нарушения ритма сердца без тромбоэмболических осложнений (0,5%). Важно отметить отсутствие достоверных различий в отношении частоты возникновения нежелательных явлений в группах лорноксикама и плацебо.
Еще одним важным преимуществом лорноксикама у коморбидных пациентов с нефрологическими нарушениями является наименьший процент выведения активного вещества почками (табл. 2) [11].
Кроме того, применение лорноксикама не требует коррекции дозы у пациентов старше 65 лет.
Данные о хорошей переносимости лорноксикама дают основание для его выбора у пациентов с отягощенным анамнезом, в первую очередь со стороны желудочно-кишечного тракта, сердечно-сосудистой системы и почек.
В комплексном лечении ОА особое место занимает местная терапия. Для уменьшения выраженности болевого синдрома и дозы принимаемых НПВП широко используют НПВП в форме мазей, кремов, гелей как в виде моно-, так и в виде комбинированной терапии с хондроитина сульфатом и диметилсульфоксидом, который облегчает проникновение активных компонентов к тканям сустава [12].
При неэффективности анальгетиков показаны антидепрессанты (дулоксетин). Дулоксетин относится к группе селективных ингибиторов обратного захвата серотонина и норадреналина. Кроме того, он слабо подавляет захват дофамина. При хронической боли, особенно при выявлении признаков нейропатической боли, могут назначаться антиконвульсанты (габапентин, прегабалин) [13].
Как было отмечено ранее, важнейшими задачами лечения ОА являются предотвращение прогрессирования деструкции хрящевого матрикса, сохранение функциональной активности больных и улучшение качества их жизни. С этой целью применяются препараты базисной терапии – симптоматические препараты замедленного действия (SYSADOA), которые стимулируют синтез хондроцитами сульфатированных и несульфатированных протеогликанов, повышают резистентность хондроцитов к воздействию провоспалительных цитокинов, снижают активность матриксных металлопротеиназ в хрящевой ткани и синовиальной жидкости, тормозят катаболические процессы в хряще и т.д. [14].
Хондроитина сульфат (ХС) – высокомолекулярное соединение, сульфатированный гликозаминогликан, являющийся структурным компонентом матрикса хрящевой ткани. Для ХС доказаны противовоспалительный, анальгетический и анаболический эффекты.
В комплексной терапии ОА также используется глюкозамин – аминосахарид, являющийся предшественником сульфатированных и несульфатированных гликозаминогликанов хрящевой ткани, в частности хондроитина сульфата и гиалуроновой кислоты. Глюкозамина гидрохлорид (ГГ) вступает в реакции синтеза гликозаминогликанов, гликопротеинов и гликолипидов. ХС и ГГ тормозят активность ключевого фактора транскрипции генов провоспалительных и деструктивных медиаторов [15].
Полученные доказательства структурно-модифицирующего действия ХС и ГГ стали предпосылкой для создания лекарственных средств, содержащих оба этих компонента.
Результаты многоцентрового открытого рандомизированного клинического исследования комплекса Артра®, который содержит 500 мг ХС и 500 мг ГГ, подтверждают эффективность и безопасность комбинации у больных ОА [16].
Клиническая эффективность, безопасность и длительность последействия препарата Артра® были оценены у 375 больных с гонартрозом второй и третьей стадий из семи ревматологических центров России. В исследование включались амбулаторные больные обоего пола в возрасте 45–70 лет с тибиофеморальным гонартрозом в соответствии с критериями Американской коллегии ревматологов, второй и третьей рентгенологическими стадиями по классификации Келлгрена – Лоуренса и болью в коленных суставах более 40 мм по ВАШ. Учитывалась необходимость приема НПВП в течение 30 дней за предшествующие три месяца. Больные были разделены на две группы. Основная группа (n = 203) сначала получала Артра® по одной таблетке два раза в день в течение одного месяца, затем – по одной таблетке один раз в день в течение пяти месяцев и диклофенак натрия по 50 мг два раза в день с последующим снижением дозы при развитии эффекта. Контрольная группа (n = 172) применяла только диклофенак натрия по 50 мг два раза в день в течение шести месяцев с возможным снижением его дозы. Контроль эффективности терапии осуществлялся в начале исследования, на 30-й, 120-й и 180-й дни. Эффективность устанавливалась по общепринятым критериям оценки препаратов для лечения ОА: по индексу остеоартрита Университетов Западного Онтарио и МакМастера (Western Ontario and McMaster Universities Arthritis, WOMAC), оценке эффективности лечения исследователем и больным, суточной потребности в диклофенаке. Длительность последействия препарата Артра® оценивалась через три месяца по окончании терапии.
Уже через месяц приема Артра® в основной группе по сравнению с группой контроля отмечено достоверное значимое уменьшение боли, скованности и улучшение функционального состояния по индексу WOMAC. Достоверные различия показателей между группами сохранялись и на последующих визитах, в том числе через три месяца по окончании лечения. Так, обследование больных спустя три месяца после завершения терапии показало наличие длительного последействия комплекса Артра®. У больных основной группы по всем оцениваемым показателям индекса WOMAC стабильно отмечалось улучшение в отличие от больных контрольной группы, у которых наблюдалось усиление боли, скованности и ухудшение функции суставов.
Результаты исследования позволили сделать вывод, что комбинированный препарат Артра® является эффективным при ОА коленного сустава. Улучшение состояния зафиксировано в 89,2 и 90,0% случаев по оценке врача и больного соответственно. Наличие у Артра® анальгетического и противовоспалительного действия подтверждалось отменой диклофенака через месяц лечения у 12,2% пациентов, через четыре месяца – у 40,0%, через шесть месяцев – у 61,0%. Таким образом, систематическое применение препарата Артра® позволяло отменить принимаемые НПВП и тем самым предотвратить развитие нежелательных эффектов, которые могут наблюдаться при длительном приеме этого класса препаратов.
Важными представляются результаты исследования, проведенного Е.Ю. Алексенко и соавт. [17]. Ученые проанализировали клиническое течение ОА при применении комплекса Артра® в течение шести месяцев, а также его плейотропные эффекты. В ходе работы были подтверждены ранее установленные анальгетическое и противовоспалительное свойства препарата. Так, через шесть месяцев терапии препаратом Артра® выявлено значительное улучшение клинической картины заболевания по индексу WOMAC. Боль в суставах уменьшилась на 38,4%, скованность – на 29,9%, функция суставов улучшилась на 26,1%. Через 24 недели от начала лечения в два раза сократилась средняя концентрация С-реактивного белка (СРБ). Содержание в крови интерлейкина 1β (ИЛ-1β), ИЛ-6 и ИЛ-18, а также фактора некроза опухоли α (ФНО-α) уменьшилось уже через 12 недель лечения. При этом положительная динамика сохранялась в течение всего периода наблюдения (табл. 3).
На фоне терапии препаратом Артра® также отмечено снижение показателей общего холестерина (ОХС), холестерина липопротеинов низкой плотности (ХС-ЛПНП) при практической неизменности уровня холестерина липопротеинов высокой плотности (ХС ЛПВП) и триглицеридов (ТГ) (табл. 4).
Полученные данные позволили сделать вывод о достоверном симптом-модифицирующем, противовоспалительном и липидоснижающем эффектах препарата Артра® у пациентов с ОА коленного сустава через 24 недели применения.
Важным этапом в лечении ОА стала разработка Артра® МСМ, одна таблетка которого содержит 400 мг ХС, 500 мг ГГ, 300 мг метилсульфонилметана, 10 мг гиалуроната натрия (в пересчете на гиалуроновую кислоту).
В рамках многоцентровой программы «Остеоартроз: оценка прогрессирования в реальной клинической практике» проведено сравнение эффективности, переносимости и безопасности препаратов Артра® MСM и Артра® у пациентов с ОА коленного сустава при непрерывном приеме в течение четырех месяцев [18]. Под наблюдением находились 100 пациентов обоего пола в возрасте от 45 до 75 лет с ОА коленного сустава по критериям Американской коллегии ревматологов, второй и третьей стадий по классификации Келлгрена – Лоуренса, болью при ходьбе более 40 мм по ВАШ. Больных осматривали ежемесячно. Оценивали значения индекса WOMAC и результаты теста «Встань и иди», а также эффективность терапии по мнению врача и больного и качество жизни по EQ-5D. Пациентов рандомизировали на две группы. Группа М (n = 50) получала препарат Артра® MСM по две таблетки в день в течение одного месяца, затем по одной таблетке в день в течение трех месяцев, группа А (n = 50) – препарат Артра® по аналогичной схеме. Сопутствующие заболевания имели место у 84% больных.
Обе группы были сопоставимы по возрасту, длительности болезни, индексу массы тела и выраженности боли по ВАШ.
Необходимо отметить, что все пациенты закончили исследование.
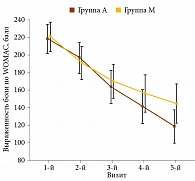
Анализ результатов позволил установить достоверное снижение боли по WOMAC в обеих группах (рис. 1). Уменьшение интенсивности боли отмечалось к концу первого месяца терапии и сохранялось на протяжении всего периода наблюдения. Между группами различий в изменении выраженности боли по WOMAC не выявлено.
Оба препарата уменьшали скованность уже через месяц терапии. Разницы в динамике утренней скованности между группами также не обнаружено.
В отношении влияния на функцию суставов и суммарный индекс WOMAC оба препарата продемонстрировали сопоставимый результат. Так, уменьшение рассматриваемых показателей отмечалось в обеих группах со второго визита. Улучшение по всем составляющим индекса WOMAC фиксировалось на протяжении всего периода терапии. При этом выявленные различия внутри групп были статистически значимыми.
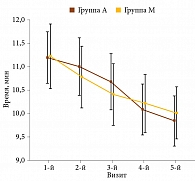
Анализ результатов теста «Встань и иди», то есть времени, потраченного на вставание со стула и прохождение 5 м, показал достоверное его уменьшение в обеих группах. Однако разница относительно исходных значений в группе М достигла статистической значимости уже во время второго визита, в группе А – только во время третьего визита. Полученные данные свидетельствуют о более быстром действии Артра® МСМ (рис. 2).
Переносимость препаратов была хорошей. Нежелательные явления отсутствовали в обеих группах.
Авторами работы отмечено, что для Артра® МСМ характерно более быстрое развитие эффекта.
Локальная терапия при ОА включает внутри- или околосуставное введение глюкокортикоидов, а также внутрисуставное введение препаратов гиалуроновой кислоты [19, 20].
Внутрисуставное введение глюкокортикоидов показано при наличии синовита. Количество инъекций в один сустав на протяжении одного года не должно превышать трех-четырех. Отсутствие эффекта после первых двух инъекций является противопоказанием для дальнейшей терапии глюкокортикоидами.
Не рекомендуется вводить пролонгированные препараты в тазобедренный сустав из-за опасности развития осложнений. Однако при правильной инъекционной технике их частота относительно редкая [21–23].
Еще одним методом лечения ОА является локальное применение обогащенной тромбоцитами плазмы (platelet-rich plasma, PRP). В настоящее время получены доказательства эффективности использования PRP-терапии только с анальгетической целью, но не с целью влияния на структурные изменения и прогрессирование болезни [24].
Хирургические методы
При неэффективности консервативной терапии и тяжелом инвалидизирующем поражении коленных (тазобедренных) суставов применяются хирургические методы лечения – остеотомия и тотальное, в некоторых случаях частичное, замещение суставов.
В настоящее время артроскопический лаваж и другие внутрисуставные вмешательства в качестве компонента комплексного лечения ОА не рекомендуются.
Основными показаниями для хирургического лечения являются выраженный болевой синдром и функциональные нарушения, когда уже исчерпаны все возможности консервативной терапии.
В качестве перспективной методики при раннем ОА признана аутологичная трансплантация хондроцитов. Предполагается, что применение аутологичной трансплантации хондроцитов позволит восстановить структуру гиалинового хряща в области его дефектов и тем самым остановить прогрессирование ОА [25].
Заключение
Современное лечение пациентов с ОА включает комбинацию фармакологических и нефармакологических методов и направлено не только на уменьшение боли и улучшение функции суставов, но и на предотвращение или замедление прогрессирования заболевания, что способствует улучшению качества жизни пациентов.
Нестероидные противовоспалительные препараты занимают лидирующее место в анальгетической терапии ОА с учетом соотношения «польза – риск». Среди всех НПВП лорноксикам (Ксефокам) является сбалансированным ингибитором обеих изоформ ЦОГ и отличается от других оксикамов быстрым началом действия и высокой скоростью элиминации. Препарат характеризуется выраженным анальгетическим эффектом и благоприятным профилем безопасности в отношении желудочно-кишечного тракта, сердечно-сосудистой системы и почек. Важным преимуществом лорноксикама считается и то, что при его применении не требуется коррекции дозы у пациентов старше 65 лет.
С учетом международных и отечественных рекомендаций основополагающим фармакологическим методом терапии ОА является долгосрочное применение SYSADOA, содержащих хондроитин и глюкозамин.
Результаты рандомизированных клинических исследований комбинированного препарата Артра®, в состав которого входят 500 мг ХС и 500 мг ГГ, подтверждают его эффективность и безопасность у коморбидных больных ОА.
Представленные данные проспективных исследований позволяют сделать вывод о достоверном симптом-модифицирующем, противовоспалительном и липидоснижающем действии препарата Артра® у коморбидных пациентов с ОА коленного сустава через 24 недели применения.
Важным моментом для повышения эффективности терапии ОА стало появление препарата Артра® МСМ, одна таблетка которого содержит 400 мг ХС, 500 мг ГГ, 300 мг метилсульфонилметана, 10 мг гиалуроната натрия (в пересчете на гиалуроновую кислоту).
Результаты рандомизированного открытого сравнительного исследования эффективности и переносимости препарата дают основание полагать, что Артра® МСМ по сравнению с Артра® обеспечивает более быстрое развитие эффекта. Так, его использование ассоциировалось с достоверным улучшением результатов теста «Встань и иди» и оценки эффективности лечения врачом и пациентом уже на втором визите.
Полученные данные, свидетельствующие об эффективности и хорошей переносимости Артра® МСМ и Артра®, позволяют рекомендовать эти препараты для широкого применения в клинической практике у коморбидных пациентов с ОА.
Важно отметить, что регулярное последовательное применение препарата Артра® МСМ при выраженном болевом синдроме с последующим переходом на препарат Артра® позволяет сократить или полностью отменить прием НПВП и тем самым предотвратить развитие нежелательных эффектов, свойственных данному классу лекарственных средств при длительном использовании.
V.I. Mazurov, Academician of the RASci., MD, PhD, Prof., I.B. Belyayeva, MD, PhD, Prof., E.A. Trofimov, MD, PhD, E.S. Zhugrova, PhD
North-Western State Medical University named after I.I. Mechnikov
Contact person: Vadim I. Mazurov, maz.nwgmu@yandex.ru
The review presents domestic and international recommendations for effective pharmacotherapy of patients with osteoarthritis (OA).
The results of a meta-analysis are presented, including 60 different placebo-controlled studies, assessing the effectiveness and tolerability of nonsteroidal anti-inflammatory drugs (NSAIDs) of their oxicam group lornoxicam in comorbid patients with acute pain and rheumatic pain, which indicate a high analgesic effect and a favorable safety profile in relation to gastrointestinal lesions, cardiovascular system and kidney. The advantage of prescribing Lornoxicam in patients over 65 years of age, which does not require dose adjustment, is emphasized. The results of prospective comparative studies assessing the dynamics of OA severity indicators with the use of combined drugs from the SYSADOA group – Artra and Artra MSM are presented, which indicate their pronounced symptom-modifying effect and good tolerability, and make it possible to widely recommend the use of these drugs in clinical practice for the treatment of comorbid patients with OA sequential use of Artra drugs by MSM for severe pain syndrome with subsequent administration of Artra in patients with OA of the knee joints makes it possible to reduce the dose or discontinue NSAIDs, and, therefore, prevent the development of undesirable effects of this class of drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.