Лечение постменопаузального остеопороза: от экспериментальных исследований к реальной клинической практике
- Аннотация
- Статья
- Ссылки

Однако в последствии стало известно, что, азотсодержащие бисфосфонаты (N-БФ) не только способны непосредственно воздействовать на кристаллы гидроксиапатита, но и могут вмешиваться в биохимические процессы, протекающие внутриклеточно, что приводит к подавлению биосинтеза изопреноидных липидов и пренилирования G-белков, что является основной причиной снижения активности остеокластов. В результате происходит дезорганизация цитоскелета остеокластов, утрата щеточной каемки клеток, нарушение внутриклеточного движения везикул (1). БФ также ускоряют апоптоз остеокластов (2).
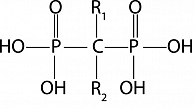
Все БФ имеют одинаковую химическую структуру. Их медицинское использование обусловлено наличием двух фосфатных групп, связанных между собой атомом углерода (рисунок 1).
Уникальность этой молекулы (Р-С-Р) состоит в том, что она определяет сродство БФ к костному минералу, а также реализует антирезорбтивный эффект на костную ткань как in vitro, так in vivo. У современных бисфосфонатов R1 домен представлен гидроксильным радикалом (ОН-), который усиливает аффинность всей молекулы к гидроксиапатиту, а точнее к иону кальция. Строение R2 домена у разных БФ отличается. Именно R2 домен определяет силу антирезорбтивного действия БФ. Первое поколение БФ содержало в R2 положении атом Сl- (клодронат), СН3 группу (этидронат). Эти БФ отличались тем, что, несмотря на высокое сродство к гидроксиапатиту, обладали невысокой антирезорбтивной активностью, при этом в высоких дозах препятствовали нормальной минерализации кости. В экспериментальных и клинических работах было показано, что этидронат способен вызывать остеомаляцию.
Понадобилось десятилетие, чтобы синтезировать новый класс БФ, у которых антирезорбтивное действие оказалось в 1000 раз мощнее за счет того, что длина R2 бокового участка существенно увеличилась, и в состав его вошел атом азота – азотсодержащие бисфосфонаты. В дальнейшем клинические возможности N-БФ значительно расширились, когда атом азота был помещен в пятичленное имидазольное кольцо, что привело к тому, что антирезорбтивный потенциал возрос в 10000 раз по сравнению с этидронатом.
Если эффекты N-БФ на костную ткань были хорошо известны, то молекулярный механизм действия стал понятен недавно. N-БФ ингибируют ключевой фермент мевалонового пути – фарнезилпирофосфат-синтетазу (ФПФ-с). Блокада этого пути посредством некоторых лекарственных препаратов нашла отражение в их клиническом использовании. Так, статины ингибируют гидроксиметилглютарил-коэнзим А редуктазу, что в конечном итоге приводит к подавлению биосинтеза холестерина и некоторых липидов. N-БФ, воздействуя на ФПФ-с, нарушают синтез фарнезил пирофосфата и геранил пирофосфата, которые необходимы для пренилирования G-белков (Ras, Rho, Rab), являющихся сигнальными белками и регулирующих многие клеточные процессы, в том числе в остеокластах. Была выявлена сильная корреляционная связь между способностью ингибировать ФПФ-с человека in vitro и силой антирезорбтивного действия in vivo. Причем даже минимальные изменения в структуре R2 бокового участка N-БФ оказывали значительное влияние на активность ФПФ-с. J.E. Dunford и соавторы (2001 г.) показали, что при одинаковой концентрации в 0,1 мкМ золедроновая кислота сильнее подавляла активность ФПФ-с in vitro по сравнению с другими пяти БФ, зарегистрированными для лечения постменопаузального остеопороза (этидронатом, клодронатом, алендронатом, резидронатом, ибандронатом) (3). Позже G.H. Nancollas и соавторы (2006 г.) in vitro продемонстрировали, что золедроновая кислота обладает более высокой аффинностью к гидроксиапатиту, чем другие БФ (4).
С клинической точки зрения важно понимать, как долго будет сохраняться антирезорбтивное действие того или иного БФ после однократного приема препарата при различиях в их аффинности. Очевидно, что скорость обратного высвобождения БФ будет зависеть не только от самой структуры молекулы, но и от дозы и кратности приема препарата, что может быть продемонстрировано только в популяционных исследованиях. Известно, что процесс выздоровления у женщин, находившихся в период ранней менопаузы, протекал значительно быстрее, чем у женщин в более пожилом возрасте со сниженным костным обменом. Опубликованные работы свидетельствуют о том, что N-БФ оказывали продолжительный подавляющий эффект на костную резорбцию при их однократном применении. Именно этот факт позволил сделать предположение, что современные N-БФ можно назначать в интермиттирующем режиме без потери их эффективности. Ведь известно, что все пероральные БФ (алендронат, ризедронат и ибандронат) продемонстрировали свой «антипереломный» эффект при их ежедневном приеме. Лишь проведенные в дальнейшем сравнительные клинические исследования, в которых обе группы пациентов с установленным остеопорозом получали активную терапию, но в разных режимах/дозах, показали, что вполне адекватно назначать БФ не каждый день, поскольку по суррогатным маркерам (минеральная плотность костной ткани и биохимические маркеры костного обмена) не было обнаружено статистически значимых различий. Результаты этих исследований были приняты к рассмотрению, и регуляторные органы США и Европы разрешили применять для лечения постменопаузального остеопороза алендронат и ризедронат один раз в неделю (5), а ибандронат один раз в месяц внутрь (6, 7) или ежеквартально при его внутривенном введении (8).
Учитывая более высокую аффинность к гидроксиапатиту золедроновой кислоты, а также более сильный антирезорбтивный потенциал, в экспериментальных работах на лабораторных животных, подвергшихся овариоэктомии, изучалось влияние однократной инфузии золедроновой кислоты в различных дозах на структурные параметры и прочность губчатой и кортикальной кости (9). Оказалось, что минеральная плотность и объем костной массы сохранялись у взрослых крыс на прежнем уровне в течение 32 недель при введении золедроновой кислоты в дозе 100 мг/кг массы тела. Механические тесты образцов кости, собранных через 32 недели, показали, что однократная инфузия золедроновой кислоты предотвращает снижение предельной прочности костной ткани, индуцированное овариоэктомией. Предельная прочность кости измерялась на основе методик теста на сжатие (позвоночник) и 3-х точечного изгиба диафиза бедренной кости. Например, введение золедроновой кислоты в дозе 20,100 и 500 мкг/кг приводило к статистически значимому увеличению прочности кости по сравнению с ложнооперированными крысами и крысами после овариоэктомии без лечения. Вместе с тем, применение золедроновой кислоты в дозе 500 мкг/кг также повышало прочность кости по сравнению с крысами без терапии, но не отличалось от дозы 100 мкг/кг. При пересчете оптимальной дозы для животных в 100 мкг/кг на пациента с массой тела 70 кг эквивалентная доза составила 4,74 мг. Эти экспериментальные работы позволили спланировать и провести рандомизированные клинические исследования, в которых 5 мг золедроновой кислоты стали лечебной дозой.
В 2007 году были опубликованы результаты большого по своей статистической мощности международного многоцентрового рандомизированного плацебо контролируемого двойного слепого исследования, которое получило название HORIZON (Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly) (10). Пациентки с установленным остеопорозом были рандомизированы в 2 группы: одна группа получала внутривенно золедроновую кислоту в дозе 5 мг, которая вводилась в течение 15 минут (день 0, месяц 12 и 24), вторая группа получала плацебо (рисунок 2). Обе группы пациенток дополнительно получали комбинированную терапию кальцием (1000-1500 мг/день в пересчете на элементарный кальций) и нативными формами витамина Д3 в дозе 400-1200 МЕ/день. Пациенты наблюдались в течение 3 лет. В исследование включались женщины в возрасте 65-89 лет, у которых минеральная плотность костной ткани (МПК) по шейке бедренной кости составила -2,5 SD по Т-критерию при наличии или отсутствии компрессионных переломов, установленных с помощью рентгеноморфометрии, или если Т-критерий был £ -1,5 SD при наличии двух компрессионных переломов легкой степени или одного средней степени. Пациенты были разделены на две страты, в первую страту были определены пациенты, которые не получали специфической антиостеопоротической терапии до рандомизации. Во вторую страту были выделены пациенты, которые получали антиостеопоротические препараты (заместительная гормональная терапия эстрогенами/прогестагенами, селективные модуляторы эстрогеновых рецепторов, кальцитонин). Критериями исключения служили выявленная в период скрининга гипо- или гиперкальциемия, а также низкая клубочковая фильтрация (< 30 мл/мин) или протеинурия. Основной конечной точкой было определение новых вертебральных переломов в первой страте и переломов проксимального отдела бедренной кости в обеих стратах. Вторичными точками исследования служили любые невертебральные переломы, клинические вертебральные переломы. Другими вторичными точками были изменения МПК в шейке бедра и поясничном отделе позвоночника, а также изменения маркеров костного обмена (сывороточного С-телопептида коллагена I типа, костно-специфичной щелочной фосфатазы и N-терминального пропептида коллагена I типа).
Результаты исследования были проанализированы через 3 года после его начала. Оказалось, что 3 ежегодных инфузии золедроновой кислоты в дозе
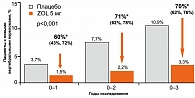
5 мг привели к снижению риска всех основных остеопоротических переломов, включая вертебральные и переломы шейки бедра. Относительный риск вертебральных переломов уменьшился на 70% (рисунок 3), что оказалось значительно выше по сравнению с БФ, которые принимались внутрь (от 40 до 59%).
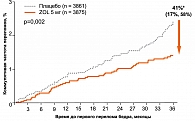
Достоверно уменьшалась частота переломов шейки бедра, что выразилось в снижении относительного риска на 41% через три года лечения (рисунок 4).
Отмечено снижение риска всех невертебральных переломов, всех клинических переломов, включая клинические вертебральные переломы, на 25, 33 и 77% соответственно (Р < 0,001).
В группе пациентов, получивших золедроновую кислоту, отмечено статистически значимое повышение МПК в общем показателе бедра на 6,02%, в шейке бедра на 5,06% и поясничных позвонках на 6,7%. Маркеры костного обмена: С-телопептид коллагена I типа, костно-специфическая щелочная фосфатаза, N-концевой пропептид коллагена I типа в сыворотке крови снизились к 12-му месяцу на 59%, 30% и 58% соответственно (p<0,001 для всех значений) и оставались на этом уровне в течение всего периода наблюдения.
По количеству смертей, серьезных нежелательных явлений (СНЯ), а также по количеству пациентов, выбывших из исследования в связи с развившимися СНЯ, группы вмешательства и плацебо не отличались. Вместе с тем в группе пациентов, получивших золедроновую кислоту, чаще регистрировались так называемые последозовые реакции, которые проявлялись в повышении температуры тела, миалгиях, артралгиях, болях в спине, гриппоподобном синдроме. Все эти негативные явления были расценены врачами как легкой/средней тяжести и проходили самостоятельно в течение первых трех дней или хорошо купировались приемом парацетамола или ибупрофена. Частота последозовых реакций значительно уменьшалась после второй и третьей инфузии препарата. Было также отмечено преобладание аритмий в группе золедроновой кислоты (6,9%) по сравнению с группой плацебо (5,3%), Р = 0,003. Фибрилляция предсердий выявлялась в 1,3% случаев и была расценена как СНЯ, однако этот тип аритмии развивался более чем через 30 дней после введения препарата, когда он полностью отсутствовал в циркуляции. В литературе нет данных, позволяющих судить о биологических механизмах развития аритмий на фоне применения БФ. В группе пациентов, получивших золедроновую кислоту, остеонекроз нижней челюсти был диагностирован в 1 случае, как и в группе плацебо (1:1).
Таким образом, на основании представленных доказательств эффективности золедроновой кислоты при лечении постменопаузального остеопороза и предотвращении основных остеопоротических переломов, включая переломы шейки бедра и вертебральные переломы, регулирующими органами была разрешена к клиническому использованию золедроновая кислота в дозе 5 мг, получившая патентованное название Акласта. Широкое применение Акласты в реальной клинической практике позволит решить проблему низкой приверженности пациентов к лечению остеопороза, а соответственно, существенно уменьшить количество остеопоротических переломов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.