Лечение синдрома кишечной недостаточности при панкреонекрозе
- Аннотация
- Статья
- Ссылки
- English


Введение
Несмотря на успехи многокомпонентной терапии и хирургические методы лечения, летальность при панкреонекрозе составляет 20–30%, а при панкреатогенном сепсисе и полиорганной дисфункции – 70–80%. Главными факторами риска при панкреонекрозе являются: объем поражения поджелудочной железы (ПЖ), бактериальная контаминация зоны некроза, сопутствующая патология, возраст, иммунный статус и др. В настоящее время на такой фактор, как объем поражения ПЖ, оказать влияние практически невозможно, но можно воздействовать на инфицирование зоны некроза и ряд других факторов. Инфицирование зоны некроза, являющееся причиной летальности у 80% пациентов, в подавляющем большинстве случаев (80–90%) происходит из кишечника и только в 10–20% – из билиарного тракта. Установлено, что если парез кишечника, который всегда выявляется при панкреонекрозе, длится 24 часа, инфицирование зоны панкреонекроза происходит у 20% больных, 48 часов – у 40–50%, более 3 суток – у 90–100% больных [1].
Одним из ведущих патогенетических механизмов, осложняющих течение панкреонекроза, является СКН, при котором нарушаются все функции кишечника: моторная, секреторная, всасывательная, иммунная, барьерная. Синдром кишечной недостаточности играет ведущую роль в развитии эндогенной интоксикации, «кишечного» сепсиса, синдрома системного воспалительного ответа, полиорганной дисфункции и повышении летальности.
Основными проявлениями СКН являются парез кишечника (динамическая кишечная непроходимость) и увеличение внутрикишечного и внутрибрюшного давления (ВБД), которые усугубляют нарушения микроциркуляции в стенке кишечника, ведут к расстройству трофики, повышению проницаемости кишечной стенки, в результате чего происходит массивная транслокация агрессивной микробной флоры (грамотрицательные формы) и токсинов в лимфатическое русло, портальный кровоток и парапанкреатическую клетчатку. Активизируются гнилостные и бродильные процессы в кишечнике. Выделяют три стадии СКН, которые определяют характер лечебных мероприятий и уровень летальности:
- 1-я стадия (рефлекторная) – угнетение моторики и всасывания жидкости без нарушения всасывания газов;
- 2-я стадия (промежуточная) – резкое нарушение всасывания жидкости и газов, растяжение кишки, венозный стаз в ее стенке, размножение микрофлоры;
- 3-я стадия (терминальная) – тяжелые нарушения микроциркуляции и резкий отек стенки кишки с развитием панкреатогенного сепсиса.
Таким образом, можно достоверно предположить, что терапия, направленная на профилактику транслокации кишечной флоры в область ПЖ и парапанкреатической клетчатки, приводит к реальному снижению летальности, причиной которой в фазу гнойных осложнений является панкреатогенная системная воспалительная реакция.
По Чикагскому согласительному договору (1991) [2], рекомендациям которого следуют практикующие врачи в России, диагноз «сепсис» выставляется при наличии очага инфекции, диагноз «синдром системной воспалительной реакции» – при наличии двух или более органных дисфункций. Результаты посева крови при этом не имеют значения, так как даже отрицательный результат не может быть основанием для снятия диагноза «сепсис». Профилактику инфицированного панкреонекроза необходимо проводить в следующих направлениях:
- быстрая ликвидация пареза кишечника;
- эффективная стартовая антибактериальная терапия;
- улучшение микроциркуляции, в том числе с целью снижения объема и тяжести некроза;
- иммуностимуляция.
Материалы и методы
Проанализированы данные, полученные по результатам проводившихся профилактики и лечения СКН, развившегося вследствие панкреонекроза. В основной и контрольной группах (по 100 пациентов) для профилактики инфицирования панкреонекроза проводили антибактериальную терапию (фторхинолоны II–III поколения + метронидазол; при тяжести состояния выше 12 баллов по шкале оценки тяжести состояния больных при острых и хронических заболеваниях – APACHE II (acute physioligy and cronic health evaluation) назначались карбапенемы: Тиенам, Меронем)), антикоагулянтную (Гепарин, Фраксипарин, Клексан), антиоксидантную (Мексидол) и иммуностимулирующую терапию (Полиоксидоний, иммуноглобулины). В основной группе в дополнение к этой коррекции проводили терапию, направленную на профилактику и лечение СКН, которая включала следующие процедуры:
- ранний энтеральный лаваж и нутриционную поддержку;
- перидуральную блокаду;
- очистительные клизмы.
Для проведения кишечного лаважа через 2–3 часа после поступления пациента в стационар устанавливался назоэнтеральный зонд в начальный отдел тонкой кишки с помощью гастродуоденоскопа. Через зонд капельно или с помощью инфузомата вводили специальный раствор, состоящий из 100 мл вазелинового масла, 100 мл пробиотиков (применяли Хилак форте), 100 мл физиологического раствора, 100 мл 10%-ного раствора глюкозы и 100 мл сернокислой магнезии. В течение 1-х суток вводили 500 мл раствора, 2-х и 3-х суток – по 1000 мл, далее – по 1200–1500 мл раствора. В контрольной группе кишечный лаваж не проводили. Состояние всех пациентов при поступлении оценивали как тяжелое. Тяжесть состояния в контрольной и основной группах оценивали по APACHE II, а степень эндотоксикоза – по клинической классификации степени тяжести синдрома эндогенной интоксикации В.К. Гостищева [3]. Во всех случаях по этим шкалам группы наблюдаемых были сопоставимы.
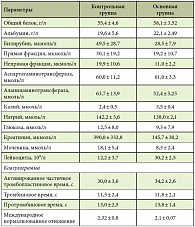
В подтверждение тяжести панкреонекроза кроме клинической оценки тяжести состояния пациента применялись лабораторные методы: уровень лейкоцитоза и лейкоцитарная формула, лейкоцитарный индекс интоксикации; уровень гемоглобина, альбумина; активность амилазы крови и мочи, трансаминаз; уровень прокальцитонина, пептидов средней молекулярной массы, С-реактивного белка, кислотно-щелочного состояния, креатинина, мочевины, билирубина, функциональные резервы печени и почек, параметры иммунного статуса, оценка диуреза и мочевино-билирубинового комплекса. Дополнительно всем больным проводили инструментальные методы диагностики в динамике: ультразвуковое исследование (УЗИ), компьютерную томографию (КТ), спиральную компьютерную томографию (СКТ) с болюсным усилением, магнитно-резонансную томографию (МРТ), лапароскопию. Диагностическая лапароскопия в 62% случаев при ферментативном перитоните и сальниковом бурсите переходила в лечебную для санации и дренирования брюшной полости и сальниковой сумки. Для экстракорпоральной детоксикации (плазмаферез, гемофильтрация) у 36% больных показаниями служили: тяжесть заболевания более 15 баллов по шкале APACHE II и степень эндотоксикоза (II–III степень). Распространенность некроза проверяли по методике, предложенной М.И. Прудковым [4].
Пациенты в наблюдаемых группах, несмотря на некоторые отличия по возрасту, сопутствующей патологии, полу, в целом были сопоставимы и типированы по проводимому лечению. Билиарный панкреатит был выявлен у 17% пациентов, алкогольный – у 48%, алиментарный – у 22%, сосудистый – у 13%. До последнего времени одним из постулатов лечения острого панкреатита являлось полное голодание на протяжении 7–10 дней. При этом белково-энергетическую недостаточность в случае необходимости восполняли путем полного парентерального питания больных. Считалось, что до периода стихания воспалительных изменений в ПЖ прием пищи через рот вызывает ее дополнительную стимуляцию, что ведет к прогрессированию заболевания. В этой ситуации кишечник тяжелобольных в течение длительного времени был лишен поступления питательных ингредиентов. Однако, как известно, именно поступление пищи в просвет тонкой кишки способствует нормализации всех ее функций, что позволяет предотвратить транслокацию микроорганизмов. Было доказано отсутствие какой-либо стимуляции внешней секреции ПЖ при введении пищи дистальнее двенадцатиперстной кишки (ДПК), а именно в тощую кишку за связку Трейтца. Подобный путь введения в современных условиях легко осуществить с помощью эндоскопической установки назоэнтерального зонда.
Основной функциональной единицей ПЖ является ацинус, который даже при отеке железы вызывает внешнесекреторную недостаточность, препятствует выделению сока ПЖ в просвет ДПК. При недостаточности ферментов ПЖ развивается мальабсорбция жиров, белков и углеводов. Организм человека не имеет достаточных механизмов для длительной компенсации нарушений белково-энергетического обмена. В восстановлении пищеварительной функции и ликвидации СКН при недостаточности ферментов ПЖ при панкреонекрозе важное значение имеет также протезирование ферментной функции ПЖ.
Нами изучено влияние комплексного лечения, схема которого рассматривается в данной статье, на интраабдоминальную гипертензию (ИАГ) и микроциркуляторные нарушения в основной и контрольной группах. В течение 7 суток 2 раза в день в основной (1-й) и контрольной (2-й) группах измерялось внутрибрюшное давление по методике J. Kron и соавт. (1998), M. Cheatham и соавт. (1998) [5] через катетер в мочевом пузыре. В норме ВБД составляет 4–10 мм рт. ст., при патологии различают 4 степени ВБД: I степень – 10–15 мм рт. ст.; II степень – 16–20 мм рт. ст.; III степень – 21–25 мм рт. ст.; IV степень – более 25 мм рт. ст. Для изучения состояния системной и регионарной микроциркуляции нами использовался метод лазерной допплеровской флоуметрии (ЛДФ). Регионарная микроциркуляция измерялась интраоперационно на коже передней брюшной стенки в области пупка на 5 см латеральнее разреза до и после операции. Оценка микроциркуляции проводилась по показателям базального кровотока: М – среднеарифметическое значение показателя микроциркуляции, Q – среднее колебание перфузии, Kv – коэффициент вариации.
Результаты и обсуждение
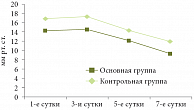
В основной группе в 1-е сутки панкреонекроза средний уровень ВБД был 14,2 ± 1,0 мм рт. ст., на 3-и сутки – 14,5 ± 0,9 мм рт. ст., на 5-е сутки – 12,1 ± 0,7 мм рт. ст., на 7-е сутки – 9,3 ± 0,8 мм рт. ст. В контрольной группе на 1-е сутки средний уровень ВБД составил 16,9 ± 1,1 мм рт. ст., на 3-и сутки – 17,3 ± 0,8 мм рт. ст., на 5-е сутки – 14,3 ± 0,8 мм рт. ст., на 7-е сутки – 11,9 ± 0,6 мм рт. ст. Динамика изменения средних значений ВБД в обеих группах представлена на рис. 1. При наличии назоэнтеральной интубации и проведении лаважа внутрибрюшное давление снижалось, причем изменения в сторону нормализации шли быстрее.
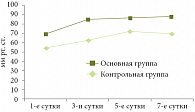
Всем пациентам определялся уровень перфузионного давления в брюшной полости. Динамика изменений средних значений перфузионного давления брюшной полости представлена на рис. 2. Средние величины перфузионного давления брюшной полости в основной группе составили в 1-е сутки послеоперационного периода 69 ± 1,5 мм рт. ст., на 3-и сутки – 85,3 ± 2,5 мм рт. ст., на 5-е сутки – 86,8 ± 2,0 мм рт. ст., на 7-е сутки – 88,5 ± 2,5 мм рт. ст. В контрольной группе средние величины перфузионного давления брюшной полости составили в 1-е сутки 54,6 ± 1,5 мм рт. ст., на 3-и сутки – 62,9 ± 3,5 мм рт. ст., на 5-е сутки – 72,4 ± 2,0 мм рт. ст., на 7-е сутки – 69,9 ± 1,5 мм рт. ст. При всех измерениях показатели микроциркуляции оказались значительно лучше в основной группе по сравнению с показателями в контрольной группе.
Разрешение пареза и полное восстановление пассажа по кишечнику в основной группе через сутки отмечены у 36% пациентов, через 36 часов – у 24%, через 48 часов – у 28%, через трое суток – у 8%, через четверо суток – у 4%. В основной группе в течение трех суток парез разрешился у 88% больных, в более поздние сроки – у 12%. В контрольной группе парез разрешился через сутки у 16% пациентов, через 36 часов – у 11–22%, через 48 часов – у 24%, через трое суток – у 19%, через четверо суток – у 20%, через 5–7 суток – у 23% пациентов. В контрольной группе в течение первых трех суток парез разрешился у 57%, позже – у 42% пациентов.
Сброс застойного содержимого по желудочному зонду (рис. 3) в основной группе в 1-е сутки после начала лечения составил 1600 ± 400 мл, на 2–3-и сутки – 1000 ± 250 мл, на 3–5-е сутки – 300 ± 100 мл, на 5–6-е сутки – 300 ± 100 мл, на 7-е сутки – 0. В контрольной группе соответственно на 2-е сутки – 1800 ± 400 мл, на 3-и сутки – 1500 ± 300 мл, на 5-е сутки – 1200 ± 300 мл, на 6-е сутки – 750 мл, на 7-е сутки – 500 ± 100 мл и на 9-е сутки – 0.
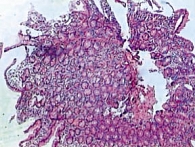
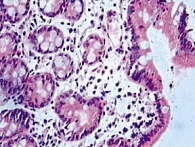
Полное восстановление функции кишечника на 5–7-е сутки в основной группе отмечено у 48 пациентов (96%), в контрольной группе – у 42 (84%) (табл. 1). По мере восстановления перистальтики и функций кишечника снижались тяжесть состояния (в том числе по результатам биохимических показателей) и эндотоксикоз (табл. 2). Результаты анализа отчетливо продемонстрировали эффективность проводимого лечения в основной группе больных, о чем свидетельствуют также данные энтеробиопсии (рис. 4 и 5).
Инфицирование панкреонекроза в основной группе наступило у 22% пациентов, в контрольной – у 46%. При инфицированном панкреонекрозе в обеих группах в основном проведены малоинвазивные вмешательства: оментобурсостомия – 28, оментобурсостомия + люмботомия – 18, дренирование жидкостных образований под ультразвуковым (УЗ) контролем – 17, некрсеквестрэктомия – 14. Всем пацентам при оментобурсостомии и люмботомии проводили плановую санацию под контролем видеоэндоскопии. При лечении инфицированного панкреонекроза важно своевременное раскрытие, адекватная санация и дренирование всех зон некроза, что имеет основное значение в профилактике панкреатогенного сепсиса, полиорганной дисфункции и летальности. В основной группе панкреатогенный сепсис развился у 10 пациентов (10%), в контрольной – у 19 (19%); умерли в основной группе 8 пациентов (8%), в контрольной – 16 (16%).
Заключение
Таким образом, своевременная ликвидация СНК при панкреонекрозе является одним из основных компонентов патогенетического лечения этого заболевания. В структуре лечения немаловажной является коррекция метаболических нарушений, напрямую связанная с использованием растворов, содержащих электролиты, пробиотики, что позволяет в 2 раза уменьшить инфицирование, развитие сепсиса и летальность при тяжелой форме панкреонекроза.
M.D. Dibirov
Yevdokimov Moscow State Medical and Stomatological University, Department of Surgery and Clinical Angiology
Contact person: Magomed Dibirovich Dibirov, m.dibirov@yandex.ru
The results of prophylaxes and treatment of intestinal failure syndrome in 200 pancreonecrosis patients were analysed. Effects of combination treatment on intra-abdominal hypertension and microcirculation were studied.
Key words: pancreonecrosis, intestinal failure syndrome, enteroparesis, intra-abdominal hypertension, microcirculatory abnormalities
