Легочная гипертензия: текущие достижения как основа моделирования прогресса. IX Евразийский конгресс кардиологов
- Аннотация
- Статья
- Ссылки
Направления развития науки о легочной гипертензии
Открывая симпозиум, заместитель генерального директора по научно-экспертной работе ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, академик РАН, д.м.н., профессор Ирина Евгеньевна ЧАЗОВА отметила, что ЛГ – раздел медицинской науки, претерпевший за последние несколько десятилетий значительные позитивные изменения.
Первое гистологическое описание ЛГ относится к 1890 г. В 1910–1930 гг. врач Аэрз опубликовал первые клинические случаи ЛГ. Впоследствии данное состояние получило название болезни Аэрза1, 2. Первая катетеризация правых отделов сердца (КПОС) была выполнена в 1940-х гг., а спустя десять лет появилась первая классификация ЛГ. В 1960-е гг. в Европе началась эпидемия ЛГ, вызванная применением препарата аминорекса. В 1973 г. Всемирная организация здравоохранения (ВОЗ) впервые провела конференцию по проблемам ЛГ. В 1980-х гг. Национальный институт сердца, легких, крови США создал первый регистр легочной гипертензии. 1980–90-е гг. ознаменовались разработкой новых подходов к лечению ЛГ и легочной артериальной гипертензии (ЛАГ). Появился первый парентеральный препарат для ЛАГ-специфической терапии. В 2000-е гг. был создан первый препарат в таблетированной форме для лечения ЛАГ.
По словам академика РАН, профессора И.Е. Чазовой, родоначальником учения о ЛГ в России считается ее учитель, академик Нурмухамед Мухамедович Мухарлямов. Его работа «Легочное сердце» стала настольной книгой для целого поколения практических врачей3. В монографии Н.М. Мухарлямов отмечал, что первичная ЛГ относится к числу редких и малоизученных заболеваний. При участии учеников и последователей Н.М. Мухарлямова были разработаны отечественные рекомендации по диагностике и лечению ЛГ, которые объединили как российский, так и зарубежный опыт ведения больных ЛГ.
В 2020 г. наступил очередной этап в развитии учения о ЛГ, который ознаменовался созданием новых клинических рекомендаций4. Над ними работали не только российские эксперты, но и ученые из других стран постсоветского пространства – Киргизии, Казахстана, Узбекистана, Белоруссии, Армении и Азербайджана.
Согласно евразийским рекомендациям, диагностическими критериями ЛАГ являются гемодинамические параметры в покое, по данным манометрии при КПОС: среднее давление в легочной артерии (ДЛА) ≥ 25 мм рт. ст., давление заклинивания в легочной артерии (ДЗЛА) ≤ 15 мм рт. ст. и легочное сосудистое сопротивление (ЛСС) более 3 ЕД по Вуду4, 5.
На VI Всемирном симпозиуме в Ницце в 2018 г. было предложено изменить диагностические критерии ЛГ, снизив величину среднего ДЛА с ≥ 25 мм рт. ст. до > 20 мм рт. ст.6 При этом в плане диагностики хронической тромбоэмболической легочной гипертензии (ХТЭЛГ) – группы IV – было принято решение оставить величину среднего ДЛА без изменений.
В последние годы нормальные значения ДЛА остаются предметом дискуссии. Так, в 2013 г. в статье G. Kovacs и соавт. на основании изучения данных КПОС сделан вывод, что нормальное значение ДЛА составляет 14,0 ± 3,3 мм рт. ст.7 После этого было опубликовано несколько работ, в которых утверждалось, что в общей популяции пациентов у больных ЛАГ на фоне системных заболеваний соединительной ткани и хронической обструктивной болезни легких повышение порога 16–20 мм рт. ст. приводит к большему числу осложнений, более высокой вероятности развития ЛГ и сопровождается худшим прогнозом8.
С учетом того что многие предложения экспертов пока обсуждаются и не нашли отражения в европейских рекомендациях, в евразийских документах за основу взяты утвержденные положения и принятые ранее концепции4, 5.
В евразийских4, 5 и зарубежных9 рекомендациях КПОС рассматривается как ключевой диагностический метод при всех формах ЛАГ. Эхокардиография (эхоКГ) также относится к необходимым методам диагностики ЛГ. ЭхоКГ позволяет определить вероятность ЛГ – низкую, среднюю и высокую в зависимости от скорости трикуспидальной регургитации и наличия дополнительных эхоКГ-признаков. Сегодня продолжается активное изучение дополнительных возможностей эхоКГ.
Кроме того, для оценки вероятности ЛГ может использоваться метод магнитно-резонансной томографии (МРТ)10–13. С помощью МРТ можно достаточно точно определить ДЗЛА, ДЛА, сердечный индекс, сердечный выброс и рассчитать ЛСС. Изучаются возможности МРТ в определении конечно-диастолического и конечно-систолического объемов правого желудочка при расчете фракции выброса правого желудочка. Продолжаются работы по оценке 4D-визуализации потока в легочной артерии. В перспективе большие диагностические возможности связывают с активным использованием фазово-контрастной МР-ангиографии.
Не прекращаются дискуссии об эскалации терапии ЛАГ. В 2018 г. был опубликован обновленный алгоритм лечения ЛАГ – Кельнский консенсус14. По мнению немецких коллег, всех пациентов с ЛАГ можно разделить на две группы: коморбидные пациенты с ЛАГ и больные классической ЛАГ. К первой обычно относят пожилых пациентов с сопутствующей патологией. Независимо от риска (низкий, промежуточный и высокий) коморбидным больным ЛАГ рекомендуется начальная монотерапия per os. В группу так называемой классической ЛАГ входят в основном молодые пациенты без каких-либо заболеваний сердечно-сосудистой и дыхательной систем. Таким пациентам при условии низкого или промежуточного риска предлагается начинать терапию с двух препаратов per os. Больным высокого риска рекомендована начальная тройная комбинированная терапия, включая внутривенные аналоги простациклина.
В настоящее время накапливается информация о возможностях и ограничениях комбинированной терапии15. Так, результаты метаанализа рандомизированных контролируемых исследований показали, что комбинированная терапия по сравнению с монотерапией дополнительно улучшает толерантность к физическим нагрузкам, функциональный класс (ФК) по классификации ВОЗ и гемодинамические параметры, однако не влияет на смертность. При этом одновременное назначение нескольких ЛАГ-специфических препаратов сопряжено с более высокой частотой отмены из-за развития нежелательных явлений.
Согласно алгоритму лечения пациентов с ЛАГ, предложенному экспертами Евразийской ассоциации кардиологов, при низком и промежуточном риске лечение начинают в монорежиме5. Стартовая двойная комбинированная терапия рекомендуется только при высоком риске. В дальнейшем риск следует оценивать каждые три-четыре месяца. При сохранении промежуточного или высокого риска возможна эскалация терапии (двойная или тройная последовательная комбинированная терапия). У пациентов с сохраняющимся низким риском на фоне приема ЛАГ-специфических препаратов продолжают терапию, выбранную на первом этапе.
Экспертами предложена стратегия оптимизации специфической терапии ЛАГ5. Так, при неэффективности ингибиторов фосфодиэстеразы-5 (иФДЭ-5) у пациентов с ЛАГ и сохранении промежуточного риска, в том числе III ФК по классификации ВОЗ, возможна замена ранее назначенного препарата на стимулятор растворимой гуанилатциклазы – риоцигуат.
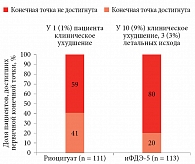
Данная концепция нашла подтверждение в рандомизированном клиническом исследовании REPLACE, в рамках которого у пациентов с ЛАГ сравнивали замену иФДЭ-5 на риоцигуат (стратегия переключения) и продолжение терапии иФДЭ-516. Клиническое улучшение в отсутствие клинического ухудшения в группах переключения и дальнейшего приема иФДЭ-5 зарегистрировано в 45 (41%) и 23 (20%) случаях соответственно. При этом клиническое улучшение при переключении на риоцигуат не зависело от исходной терапии (монотерапия иФДЭ-5 или комбинированная терапия иФДЭ-5 в сочетании с антагонистами рецепторов эндотелина (АРЭ)) (рисунок).
В своем выступлении академик, профессор И.Е. Чазова также обозначила новые перспективные направления терапии, основанные на последних данных о молекулярных механизмах передачи внутри- и межклеточных сигналов, действии гормонов и тканевых ферментов17, 18. Результаты опубликованных исследований позволяют предположить включение в клинические рекомендации новых препаратов патогенетической терапии ЛАГ в будущем: ингибиторов рецепторной тирозинкиназы, ингибиторов Rho-киназы, иммуносупрессантов и агонистов активиновых рецепторов 2-го типа, ингибиторов протеинкиназы С, ингибиторов ароматазы и антагонистов эстрогеновых рецепторов, ингибиторов поли-(АДФ-рибоза)-полимеразы и бромодоменного белка 4, ингибиторов эластазы. Одни препараты, например иматиниб, уже прошли III фазу клинических исследований, другие, в частности олапариб, энзастаурин, элафин, находятся в доклинической стадии разработки или проходят I–II фазы клинических исследований.
В заключение академик рассказала о масштабном проекте PVDOMICS, который запустил Национальный институт сердца, легких, крови США19. Цель исследования – провести глубокое фенотипирование больных ЛГ. В рамках проекта осуществляется наблюдение за пациентами с подтвержденной ЛГ и повышенным риском ее развития, а также здоровыми лицами (планируется включение 1200 человек). Помимо стандартных исследований, которые внесены в современные протоколы диагностики ЛГ, в изучаемой популяции планируется широкое использование так называемых омик-технологий (геномные, транскриптомные, протеомные и метаболомные исследования). В 2020 г. были опубликованы предварительные результаты проекта.
Таким образом, в настоящее время появляются данные о новых эффективных методах лечения ЛАГ, что позволит в перспективе улучшить качество медицинской помощи пациентам с этим жизнеугрожающим заболеванием.
Возможности и ограничения для начальной комбинированной ЛАГ-специфической терапии в Российской Федерации
Ведущий научный сотрудник отделения хирургического лечения заболеваний сердца с прогрессирующей легочной гипертензией ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева», доцент кафедры сердечно-сосудистой хирургии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования», д.м.н. Антон Алексеевич ШМАЛЬЦ в начале своего выступления подчеркнул, что современные подходы к комбинированной ЛАГ-специфической терапии формировались на протяжении последних 20 лет. Опция начальной комбинированной терапии для пациентов с ЛАГ IV ФК по классификации ВОЗ впервые была представлена в европейских рекомендациях в 2009 г. (после 4-го Всемирного симпозиума по ЛГ, Дана-Пойнт), для пациентов с ЛАГ низкого или промежуточного риска – в 2015 г.9, 20
Позиции начальной комбинированной терапии закреплены в Кельнском консенсусе14. Так, в соответствии с данным документом, больным с фенотипом классической ЛАГ с низким или промежуточным риском показано назначение двух, а с исходно высоким риском – трех ЛАГ-специфических препаратов, включая внутривенные аналоги простациклина.
Идентичные принципы лечения были предложены в рамках 6-го Всемирного симпозиума по ЛГ (Ницца, 2018 г.), при этом начальная монотерапия оставлена в качестве опции для отдельной сравнительно небольшой категории больных6.
Для лечения пациентов с ЛАГ действующие европейские рекомендации допускают использование 16 лекарственных форм 12 ЛАГ-специфических препаратов, обновленные американские рекомендации – 14 лекарственных форм десяти ЛАГ-специфических препаратов9, 21. В европейских рекомендациях (2015) для пациентов с II–III ФК по классификации ВОЗ при назначении начальной комбинированной терапии на первом месте находится сочетание амбризентана и тадалафила (класс рекомендаций и уровень доказательности – IВ)9. Другие комбинации ЛАГ-специфических препаратов приведены с меньшими классами рекомендаций и уровнями доказательности (другие антагонисты рецепторов эндотелина + иФДЭ-5, бозентан + силденафил + внутривенный эпопростенол).
Представленные рекомендации базируются на результатах исследования AMBITION, в котором у «наивных» пациентов с ЛАГ на фоне начальной комбинированной терапии амбризентаном и тадалафилом наблюдалось статистически значимое снижение риска прогрессирования заболевания по сравнению с монотерапией отдельными компонентами22.
В свою очередь доказательная база в отношении начальной тройной комбинированной терапии, назначаемой тяжелым пациентам, невелика и в основном опирается на результаты одноцентрового ретроспективного неконтролируемого исследования23. В ходе исследования 19 пациентам с ЛАГ III–IV ФК, ранее не получавшим лечения, назначали начальную комбинированную тройную терапию эпопростенолом, бозентаном и силденафилом. Через четыре месяца лечения у 18 больных отмечалось увеличение дистанции в тесте шестиминутной ходьбы, у 17 больных – улучшение ФК до I или II. Через 32 ± 19 месяцев терапии все пациенты имели стойкое клиническое и гемодинамическое улучшение. Выживаемость через один, два и три года составила 100% при прогнозируемой выживаемости без лечения 75, 60 и 49% соответственно.
В мае 2021 г. в Российской Федерации были одобрены семь ЛАГ-специфических препаратов восьми лекарственных форм: илопрост, селексипаг, силденафил, риоцигуат (Адемпас), бозентан (таблетированная форма для взрослых и диспергируемые таблетки для детей), амбризентан, мацитентан24. Кроме того, в России зарегистрировано семь дженериков бозентана, два дженерика силденафила, а также дженерики мацитентана, амбризентана. В настоящее время регистрации ожидают еще несколько дженериков ЛАГ-специфических препаратов (два препарата илопроста, бозентана и один мацитентана).
В евразийских клинических рекомендациях по диагностике и лечению легочной артериальной гипертензии (2019) при исходно низком и промежуточном риске предусмотрено назначение монотерапии, при высоком – начальной двойной комбинированной терапии5.
Российские рекомендации 2020 г. в данном аспекте несколько отличаются. В них для пациентов с исходно низким и промежуточным риском обозначена последовательная комбинированная терапия, при высоком риске – стартовая комбинированная терапия25.
Доказательная база отдельных комбинаций препаратов, зарегистрированных на территории РФ, для начальной терапии ЛАГ выглядит следующим образом.
В 2018 г. в исследовании M.V. Thakrar и соавт. комбинация амбризентана и риоцигуата продемонстрировала эффективность в улучшении большинства клинико-гемодинамических показателей: среднего ДЛА, сердечного индекса, ударного индекса, снижения ЛСС, увеличения дистанции в тесте шестиминутной ходьбы26.
В небольшом исследовании C.S. Thornton и соавт. (2020) на фоне применения комбинации амбризентана и риоцигуата отмечалось улучшение эхоКГ-показателей, таких как TAPSE, индекс Tei, соотношение размеров правых и левых отделов сердца, расчетного ДЛА27.
Интересно, что еще в 2014 г. в ходе эксперимента был выявлен биохимический синергизм амбризентана и риоцигуата28. Так, использование комбинации риоцигуата и амбризентана в отличие от применения каждого препарата в отдельности ассоциировалось с более выраженной легочной вазодилатацией. Комбинация риоцигуата с бозентаном и мацитентаном не обладала подобным эффектом. Полученные результаты авторы исследования объяснили дополнительной продукцией оксида азота, вызванной стимуляцией эндотелиновых рецепторов типа В, на которые амбризентан оказывает минимальное воздействие.
Эффективность стартовой комбинированной терапии амбризентаном и силденафилом оценивали в рамках одного ретроспективного исследования у небольшой группы больных ЛАГ (восемь из 97 пациентов, получавших различные комбинации АРЭ и иФДЭ-5, преимущественно бозентан + силденафил)29. Исходя из опубликованных данных, определить эффективность и безопасность в подгруппах пациентов, получавших отдельные препараты, не представляется возможным. Необходимо отметить, что, по данным фармакокинетических исследований, для этих препаратов не характерно лекарственное взаимодействие, опосредованное цитохромом P45030–32.
В 2019 г. было опубликовано исследование эффективности начальной комбинации мацитентана и риоцигуата33. На фоне терапии у пациентов с ЛАГ наблюдались увеличение дистанции в тесте шестиминутной ходьбы, снижение уровня мозгового натрийуретического пептида (BNP) и ФК по классификации ВОЗ, а также улучшение гемодинамических показателей (снижение ДЛА и ЛСС, увеличение сердечного индекса). Изменения ДЛА и сердечного индекса были выражены в большей степени, чем при монотерапии каждым из этих препаратов в регистрационных исследованиях PATENT34 и SERAPHIN35. Низкая степень риска через год терапии достигалась почти в половине случаев при 85%-ной трехлетней выживаемости33.
A. Rinaldi и соавт. оценивали эффективность начальной терапии мацитентаном и силденафилом у 28 пациентов с ЛАГ. Данная комбинация эффективнее улучшала гемодинамические параметры (среднее ДЛА, ЛСС, сердечный индекс), чем монотерапия мацитентаном или силденафилом36.
Значимого лекарственного взаимодействия между мацитентаном и силденафилом не установлено37.
Накопленные данные свидетельствуют о том, что применение комбинации силденафила и бозентана нежелательно вследствие взаимодействия между препаратами со снижением концентрации силденафила, которая опосредована цитохромом P450. Так, в исследовании COMPASS-2 добавление бозентана к терапии пациентов с ЛАГ не имело преимущества перед монотерапией силденафилом в увеличении времени до первого события заболеваемости/смертности38.
Согласно евразийским клиническим рекомендациям, пациентам с исходно высоким риском показана стартовая комбинированная терапия, включающая ингаляционный илопрост в качестве альтернативы внутривенным простаноидам, не зарегистрированным на территории РФ5. Еще в 2013 г. было опубликовано исследование, результаты которого показали эффективность начальной комбинации ингаляционного илопроста и силденафила39. Все пациенты с ЛАГ, участвовавшие в исследовании, имели IV ФК (дистанция в тесте шестиминутной ходьбы 0 м), половина из них были кандидатами на трансплантацию легких. Начальная терапия комбинацией ингаляционного илопроста и силденафила в течение трех месяцев способствовала увеличению дистанции в тесте шестиминутной ходьбы до 322 м. Выживаемость через год и пять лет составила 100 и 75% соответственно. Таким образом, начальная терапия ингаляционным илопростом и силденафилом представляет собой приемлемую опцию у пациентов с тяжелой ЛАГ.
В исследованиях также показан эффект одновременного назначения ингаляционного илопроста и силденафила40. Комбинация препаратов при краткосрочном применении была более эффективной в отношении снижения ДЛА, чем каждый из ее компонентов в отдельности. Кроме того, совместное назначение препаратов препятствовало быстрому возврату ДЛА к исходному уровню по окончании действия илопроста. Синергизм препаратов с благоприятным фармакологическим эффектом является следствием того, что иФДЭ-5 силденафил может препятствовать деградации не только циклического гуанозинмонофосфата, но и циклического аденозинмонофосфата, обусловливающего вазодилатирующий эффект простаноидов.
В многоцентровом открытом рандомизированном клиническом исследовании стартовая комбинация бозентана и ингаляционного илопроста эффективнее улучшала показатели теста шестиминутной ходьбы, среднего ДЛА, сердечного индекса, уровня N-терминального мозгового натрийуретического пептида (NT-proBNP), ФК и качества жизни, чем монотерапия каждым из препаратов41.
Представляют интерес данные, полученные в ретроспективном исследовании, в котором сравнивали эффективность начальной комбинированной терапии иФДЭ-5 (силденафил и тадалафил) в сочетании с различными антагонистами рецепторов эндотелина (амбризентан, бозентан, мацитентан, ситаксентан) и монотерапии теми же препаратами42. Результаты исследования продемонстрировали, что начальная двойная комбнированная терапия обеспечивает большее снижение ЛСС и улучшение других показателей, в том числе ДЛА, NT-proBNP, объема и напряжения стенки правого желудочка.
Результаты крупных метаанализов рандомизированных клинических исследований также показали эффективность двойной терапии по сравнению с монотерапией в отношении улучшения гемодинамических показателей и переносимости физической нагрузки у пациентов с ЛАГ43.
Так, по данным метаанализа 18 рандомизированных клинических исследований с участием 4162 больных ЛАГ, двойная комбинированная терапия снижает риск клинического ухудшения на 38%. У пациентов улучшаются гемодинамические параметры и показатели теста шестиминутной ходьбы, ФК44.
Результаты исследования, опубликованные в 2021 г., показали эффективность начальной тройной комбинации мацитентана, риоцигуата и селексипага у пациентов с ЛАГ. Максимальных доз всех трех препаратов достигли 65,4% пациентов. При этом эффективно снижались показатели ЛСС, ДЛА и повышался сердечный выброс45.
Таким образом, несмотря на ограниченное количество зарегистрированных ЛАГ-специфических препаратов, в России имеются возможности для практически полноценного применения начальной комбинированной терапии у пациентов с ЛАГ, в отношении которой постепенно расширяется доказательная база. В пилотных исследованиях продемонстрирован эффект начальных комбинаций у больных с исходно низким и промежуточным риском (амбризентан и риоцигуат, мацитентан и риоцигуат, мацитентан и силденафил), а также при исходно высоком риске (ингаляционный илопрост и силденафил, ингаляционный илопрост и бозентан).
Эффекты, обусловленные синергией амбризентана и риоцигуата, а также ингаляционного илопроста и силденафила, требуют дальнейшего клинического подтверждения. Необходимо дополнительное изучение и других комбинаций ЛАГ-специфических препаратов.
Стратегия замены ЛАГ-специфических препаратов при легочной гипертензии. Мировой и российский клинический опыт
Руководитель отдела легочной гипертензии и заболеваний сердца ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, Научно-исследовательского центра клинической кардиологии им. А.Л. Мясникова, д.м.н. Тамила Витальевна МАРТЫНЮК подробно рассмотрела стратегию замены ЛАГ-специфических препаратов при ЛГ. В своем докладе она отметила, что в последние годы наблюдаются накопление данных, изменение и оптимизация принципов ЛАГ-специфической терапии.
Так, одним из рациональных и в достаточной степени изученных подходов к специфической терапии у пациентов с ЛАГ является переключение с иФДЭ-5 на стимуляторы растворимой гуанилатциклазы (риоцигуат)46. При этом надо учитывать особый двойной механизм действия риоцигуата. Данный препарат, во-первых, сенсибилизирует растворимую гуанилатциклазу к эндогенному оксиду азота (NO) и, во-вторых, напрямую стимулирует растворимую гуанилатциклазу через другой участок связи, независимо от NO. Риоцигуат восстанавливает метаболический путь NO и вызывает увеличение продукции циклического гуанозинмонофосфата с последующей вазодилатацией. Необходимо помнить, что при ЛГ нарушение вазодилатации может наблюдаться даже на фоне достаточной продукции эндогенного NO.
На современном этапе комбинированная терапия становится стандартом лечения пациентов с ЛАГ14, 47. Эффективность последовательной комбинированной терапии подтверждена в многочисленных рандомизированнных клинических исследованиях. Более очевидными становятся преимущества ранней комбинированной терапии. У больных с так называемой классической ЛАГ стандартом считается начальная комбинированная терапия.
В то же время комбинированная терапия в отличие от монотерапии пока не имеет доказанного влияния на смертность пациентов с ЛАГ15. Кроме того, при использовании комбинированных препаратов не исключены побочные эффекты и лекарственное взаимодействие. Требует оценки и соотношение «стоимость – эффективность». Несмотря на недоступность ряда лекарственных средств, сегодня в РФ по сравнению с другими странами евразийского содружества имеется возможность для применения ЛАГ-специфических препаратов.
Безопасность и целесообразность замены терапии на риоцигуат у больных ЛАГ с недостаточным ответом на иФДЭ-5 изучали в открытом международном многоцентровом исследовании RESPITE48. Конечными точками являлись (динамика через 24 недели от исходного уровня) увеличение дистанции в тесте шестиминутной ходьбы, гемодинамические параметры, ФК по классификации ВОЗ, уровень NT-proBNP, процент больных с развитием клинического ухудшения и оценка качества жизни (EQ-5D). Оценивались также безопасность и переносимость препарата. К концу 24-й недели комбинированный ответ (ФК I/II по классификации ВОЗ и улучшение дистанции в тесте шестиминутной ходьбы более чем на 30 м в отсутствие клинического ухудшения) отмечался у 31% пациентов. Помимо изменения функциональных параметров в исследовании установлены статистически значимые снижение NT-proBNP и улучшение ряда гемодинамических параметров (снижение ЛСС, среднего ДЛА, давления в правом предсердии, увеличение сердечного индекса).
Результаты исследования наглядно продемонстрировали безопасность и целесообразность перевода пациентов с ЛАГ с иФДЭ-5 на риоцигуат при недостаточном ответе на терапию.
В post-hoc-анализе исследования RESPITE изучали показатели, которые могут свидетельствовать о вероятном ответе на замену иФДЭ-5 риоцигуатом. У пациентов, достигших терапевтического ответа, наблюдалось улучшение отдельных гемодинамических параметров (ЛСС и среднее ДЛА)49. Представляют интерес различия в параметрах функции сердца между подгруппами больных, достигших терапевтического ответа и не ответивших на терапию (исходно и через 24 недели применения риоцигуата). Производительность сердца (ударный объем/среднее ДЛА), ударный объем и ударный индекс значительно улучшились у всех пациентов независимо от ответа на терапию. У пациентов, не ответивших на переключение, исходно отмечались более высокие уровни биомаркеров – ростового фактора дифференцировки 15 (GDF-15) и NT-proBNP, что потенциально может быть использовано при прогнозировании эффективности терапии. В изучаемых подгруппах не отличались уровни ингибитора эндотелиальной NO-синтазы – асимметричного диметиларгинина (ADMA). В обеих подгруппах имело место статистически значимое снижение риска по шкале REVEAL, более выраженное в группе переключения.
По данным докладчика, риоцигуат может использоваться не только при неэффективности иФДЭ-5, но и у «наивных» пациентов с ЛАГ. В исследовании российских ученых риоцигуат назначали 24 больным с ЛАГ и ХТЭЛГ, десять из них ранее получали силденафил в стандартной дозе и не достигли целей лечения50. Через 24 недели наблюдения независимо от исходной терапии наблюдалось улучшение функционального статуса (статистически значимое увеличение дистанции в тесте шестиминутной ходьбы до 495,5 м и снижение ФК по классификации ВОЗ – I/II ФК у 71% пациентов). Кроме того, в ходе исследования были продемонстрированы положительные изменения NT-proBNP, ряда эхокардиографических (TAPSE, фракция выброса правого желудочка, межжелудочковое взаимодействие, жесткость и улучшение растяжимости ЛА, СС-сопряжение – взаимодействие правого желудочка с легочной артерией (ПЖ – ЛА) и левого желудочка с аортой (ЛЖ – Ао)) и гемодинамических параметров (среднее ДЛА, давление в правом предсердии, сердечный индекс). К 12-й неделе лечения в общей группе были выявлены достоверное уменьшение количества пациентов с высоким риском с 79 до 29%, увеличение количества пациентов промежуточного риска с 17 до 67%. Низкий риск зафиксирован в 4% случаев. К 24-й неделе количество пациентов низкого, промежуточного и высокого риска составило 4, 55 и 41% соответственно.
Таким образом, терапия риоцигуатом в течение 24 недель у пациентов с идиопатической ЛАГ и неоперабельной ХТЭЛГ позволяет достоверно улучшить ФК, структурно-функциональное состояние сердца, параметры гемодинамики, качество жизни, уровни биомаркеров, уменьшить риск летальности как у больных, ранее не получавших специфической терапии, так и у тех, кто не достиг целей лечения на фоне предшествующей терапии силденафилом50.
В другом исследовании оценивали результаты длительной терапии риоцигуатом у 28 пациентов с идиопатической ЛАГ и II–III ФК по классификации ВОЗ51. Из них 12 пациентов ранее получали силденафил не менее трех месяцев и не достигли целей терапии, 16 пациентов ранее не получали ЛАГ-специфических препаратов. Во всех случаях назначали риоцигуат (первичное назначение или переключение с силденафила). Через 24 месяца на фоне терапии риоцигуатом динамика показателя дистанции в тесте шестиминутной ходьбы составила +104,2 м по сравнению с исходным уровнем. В девяти случаях потребовалась эскалация терапии за счет присоединения к риоцигуату илопроста или бозентана (13-й месяц наблюдения). Через 24 месяца терапии риоцигуатом выживаемость достигла 100%.
Т.В. Мартынюк отметила, что сегодня в клинической практике реализуется стратегия переключения не только при ЛАГ, но и при неоперабельной ХТЭЛГ. При этом большая доля пациентов достигает максимальной дозы риоцигуата 7,5 мг – 94% больных ЛАГ, 95% − ХТЭЛГ (неопубликованные данные). Результаты отечественных наблюдений соотносятся с данными международных исследований стратегии переключения с иФДЭ-5 на риоцигуат у больных ЛАГ и ХТЭЛГ. В частности, в рамках программы CAPTURE был проведен ретроспективный анализ историй болезни пациентов, перенесших замену ранее назначенных ЛАГ-специфических препаратов (в большинстве случаев иФДЭ-5) на риоцигуат52. Самой распространенной причиной переключения была недостаточная эффективность терапии. При ХТЭЛГ после замены ранее назначенного ЛАГ-специфического препарата риоцигуат в монорежиме получали 71% пациентов. У больных ЛАГ чаще использовалась двойная комбинированная терапия (68% случаев; монотерапия – 15% случаев, тройная комбинированная терапия – 18% случаев).
Недавно были представлены результаты крупного многоцентрового рандомизированного контролируемого исследования REPLACE, в котором изучали эффективность замены терапии иФДЭ-5 на риоцигуат у пациентов с ЛАГ промежуточного риска (дистанция в тесте шестиминутной ходьбы – 165–440 м, III ФК по классификации ВОЗ, прием иФДЭ-5 в стабильных дозах как в монорежиме, так и в комбинации с АРЭ)53. Первичная конечная точка (клиническое улучшение через 24 недели терапии в отсутствие клинического ухудшения) была выбрана согласно рекомендациям 6-го Всемирного симпозиума по легочной гипертензии (Ницца, 2018 г.). Клиническое улучшение определялось как достижение как минимум двух из трех следующих критериев:
- увеличение дистанции в тесте шестиминутной ходьбы ≥ 10%/≥ 30 м;
- ФК (по классификации ВОЗ) I/II;
- снижение уровня NТ-proBNP ≥ 30% по сравнению с исходным.
Вторичными конечными точками считалось изменение через 24 недели по сравнению с исходным уровнем дистанции в тесте шестиминутной ходьбы, NT-proBNP, ФК по классификации ВОЗ, времени до первого события клинического ухудшения.
Пациенты были рандомизированы в группы риоцигуата и дальнейшей терапии иФДЭ-5. Клиническое улучшение в отсутствие клинического ухудшения (первичная конечная точка) отмечалось у 41% пациентов в группе риоцигуата и 20% – в группе иФДЭ-5 (отношение шансов 2,78; 95%-ный доверительный интервал (ДИ) 1,53–5,06; p = 0,0007). Наблюдались значимые улучшения ФК (ВОЗ) на фоне терапии риоцигуатом по сравнению с иФДЭ-5 (средняя разница -0,26; 95% ДИ -0,42–-0,11; p = 0,0007). Более выраженные улучшения (через 24 недели по сравнению с исходным) были выявлены в группе риоцигуата в отношении дистанции в тесте шестиминутной ходьбы (средняя разница (95% ДИ): 23 м (5–40 м); p = 0,0542) и NT-proBNP (средняя разница (95% ДИ): -170 пг/мл (-426–87); p = 0,1067) по сравнению с группой иФДЭ-5. Время до наступления первого оцениваемого события клинического ухудшения было значительно дольше в группе риоцигуата, чем в группе иФДЭ-5 (p = 0,007).
Таким образом, результаты исследования REPLACE подтвердили, что переключение больных ЛАГ с иФДЭ-5 на риоцигуат увеличивает вероятность клинического улучшения и способствует снижению темпов развития клинического ухудшения.
Подводя итог, Т.В. Мартынюк подчеркнула, что сегодня евразийские рекомендации четко прописывают возможности стратегии переключения5. При неэффективности терапии иФДЭ-5 у пациентов с ЛАГ при сохранении промежуточного риска, в том числе ФК III по классификации ВОЗ, рекомендуется замена препарата на риоцигуат.
Триумвират терапии хронической тромбоэмболической легочной гипертензии
По мнению ведущего научного сотрудника отдела гипертонии, доцента кафедры кардиологии с курсом интервенционных методов диагностики и лечения, сотрудника 2-го отделения рентгеноэндоваскулярных методов диагностики и лечения Института клинической кардиологии им. А.Л. Мясникова ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, д.м.н., профессора Николая Михайловича ДАНИЛОВА, словом «триумвират» можно охарактеризовать три современных подхода к лечению ХТЭЛГ, направленных на достижение максимального эффекта терапии, увеличение качества и продолжительности жизни пациентов.
Основные принципы ведения больных ХТЭЛГ – комплексная диагностика, пожизненная терапия антикоагулянтами и правильно подобранное лечение4, 5. Подходы к лечению ХТЭЛГ включают три направления: легочную тромбэндартерэктомию (ТЭЭ), транслюминальную баллонную ангиопластику легочных артерий (ТЛБА) и таргетную терапию. Вопрос о наиболее предпочтительном методе лечения пациентов с ХТЭЛГ в каждом конкретном случае решает мультидисциплинарная комиссия, которую возглавляет сердечно-сосудистый хирург. Его слово решающее.
ТЭЭ – метод выбора при ХТЭЛГ4, 5. В центрах с передовым опытом, в том числе в ФГБУ «НМИЦ кардиологии» Минздрава России, данный подход демонстрирует высокую эффективность. Кроме того, этот метод ассоциируется с низким уровнем летальности. Как отметил докладчик, по мере становления метода и накопления опыта хирургами ФГБУ «НМИЦ кардиологии» снижалось количество осложнений при проведении ТЭЭ (неопубликованные данные). В последние годы не зафиксировано ни одного летального исхода после операции.
Операция ТЭЭ предполагает удаление интимы, содержащей тромботический материал из легочных артерий54. Целью операции является полное одномоментное устранение всех стенотических изменений и максимальное снижение давления в обеих легочных артериях. Однако оперативное вмешательство показано не всем больным ХТЭЛГ. По данным международного регистра, в который вошли 679 пациентов с ХТЭЛГ, 37% пациентов по тем или иным причинам считаются неоперабельными55.
Основная причина противопоказаний к операции – высокий уровень ЛСС, величина которого пропорциональна риску осложнений в раннем послеоперационном периоде56. Значение ЛСС > 1600 дин/с/см-5 сопровождается крайне высоким риском летальности и является абсолютным противопоказанием к хирургическому вмешательству.
Важным компонентом при оценке операбельности больных ХТЭЛГ считается уровень поражения легочных артерий57. Так, хирургическая коррекция возможна при поражении проксимальных ветвей легочных артерий. Однако если поражены сегментарные и субсегментарные ветви легочных артерий, вмешательство исключено. Следует отметить, что в экспертных центрах ТЭЭ проводят при поражении ветвей артерий до 2 мм. При поражении 2–5 мм в качестве альтернативы рассматривают выполнение ТЛБА ветвей легочных артерий. ЛАГ-специфическая терапия показана пациентам с дистальным поражением легочных артерий4, 5.
Первые сообщения об ангиопластике легочных артерий относятся к 1988 г.58, 59, однако первая серия случаев, в которую были включены 18 больных с ХТЭЛГ, перенесших баллонную ангиопластику, была опубликована только 13 лет спустя60. На тот момент проведение ТЛБА было сопряжено с множеством жизнеугрожающих осложнений. В настоящее время методы ангиопластики подверглись значительной модификации и продемонстрировали высокую эффективность и безопасность при неоперабельной ХТЭЛГ при условии правильного отбора больных с дистальным типом поражения легочного сосудистого русла61.
Впервые в России ТЛБА у больного с неоперабельной формой ХТЭЛГ была выполнена в ФГБУ «НМИЦ кардиологии» Минздрава России в 2014 г. По данным Н.М. Данилова, с 2014 по 2021 г. на базе ФГБУ «НМИЦ кардиологии» проведено 420 ТЛБА у 120 пациентов (неопубликованные данные). Летальных случаев в раннем послеоперационном периоде не зарегистрировано. Жизнеугрожающие осложнения, такие как перфорация (2,6%) и реперфузионный отек легких (2,4%), встречались редко. Шестилетняя выживаемость пациентов составила 93%.
Еще в 2018 г. ТЛБА в алгоритме лечения у неоперабельных больных ХТЭЛГ рассматривалась как дополнительный метод терапии62. Ситуация менялась по мере совершенствования доказательной базы метода. Так, согласно последним рекомендациям Евразийской ассоциации кардиологов, ТЛБА легочных артерий рекомендована пациентам с ХТЭЛГ в случае, когда оперативное лечение невозможно, или при резидуальной ЛГ после ТЭЭ4. В таких случаях пациентам с ХТЭЛГ может помочь только ЛАГ-специфическая терапия. Стимулятор растворимой гуанилатциклазы риоцигуат, обладающий максимальной доказательной базой и успешно применяемый в повседневной практике, рекомендован и является препаратом выбора для симптомных пациентов с персистирующей/рецидивирующей ХТЭЛГ после хирургического лечения или неоперабельной ХТЭЛГ52, 63–65.
У пациентов с ХТЭЛГ представляет интерес так называемый мультимодальный подход, предполагающий сочетание нескольких методов лечения (ТЭЭ, ТЛБА, таргетная терапия). В немецком проспективном наблюдательном когортном исследовании изучали возможности последовательного лечения пациентов с неоперабельной ХТЭЛГ риоцигуатом и ТЛБА66. Больные с неоперабельной ХТЭЛГ принимали риоцигуат в максимальной дозе за три месяца до ТЛБА. После оценки эффективности терапии пациентам проводили ангиопластику. Через шесть месяцев после окончательного вмешательства оценивали общий терапевтический эффект. Основными показателями исхода были параметры легочной гемодинамики и ФК по классификации ВОЗ. Результаты исследования показали преимущества последовательного подхода. На фоне терапии риоцигуатом наблюдалось статистически значимое снижение ФК по классификации ВОЗ, среднего ДЛА и ЛСС. Выраженность представленных изменений значительно увеличивалась после ТЛБА.
Докладчик на примере клинических случаев рассмотрел варианты комбинированного подхода к лечению пациентов с неоперабельной ХТЭЛГ.
Клинический случай 1. Пациентка 60 лет с неоперабельной ХТЭЛГ (высокое ЛСС и дистальный тип поражения легочных артерий) и субтотальным стенозом ствола левой коронарной артерии, который был компрессирован расширенным стволом легочной артерии. Лечение начато с ТЛБА (четыре сессии в течение трех месяцев). После вмешательства наблюдалось выраженное улучшение легочного кровотока, преимущественно в нижних долевых участках обоих легких, которое сопровождалось снижением уровней ЛСС (приблизительно в два раза) и ДЛА. На фоне уменьшения размеров легочной артерии отмечалось полное исчезновение признаков поражения ствола коронарной артерии.
После ТЛБА появилась возможность выполнения ТЭЭ (трансформация неоперабельной ХТЭЛГ в операбельную форму), которая была проведена в плановом порядке. Кроме того, был назначен риоцигуат. При контрольном обследовании все гемодинамические параметры соответствовали целевым значениям.
Клинический случай 2. Пациентка 43 лет с диагнозом ХТЭЛГ госпитализирована в тяжелом состоянии – с одышкой и признаками правожелудочковой сердечной недостаточности (отеки, гидроторакс, признаки венозного застоя в печени). Уровень артериального давления составил 85–90/60 мм рт. ст., показатели дистанции в тесте шестиминутной ходьбы – 350 м, ЛСС – 1600 дин/с/см5. Поскольку высокие показатели ЛСС являются противопоказанием к ТЭЭ, хирургическое лечение пришлось отложить. Назначение риоцигуата не представлялось возможным в связи с артериальной гипотонией.
Таким образом, единственным возможным методом лечения в данном случае была ТЛБА. После успешно проведенного вмешательства отмечалось снижение ДЛА и ЛСС. В связи с увеличением артериального давления до 100/65 мм рт. ст. был назначен риоцигуат с титрованием дозы. На фоне приема препарата нежелательных явлений не зарегистрировано, переносимость терапии была удовлетворительной. В дальнейшем выполнена ТЭЭ легочных артерий с положительным результатом.
Таким образом, для оптимизации помощи больным ХТЭЛГ целесообразно использовать гибридный подход с включением хирургических методов, ТЛБА и ЛАГ-специфических препаратов с доказанной эффективностью.
Заключение
Адемпас (риоцигуат) – препарат для лечения отдельных форм ЛАГ и ХТЭЛГ с уникальным двойным механизмом действия, который принципиально отличается от такового у других ЛАГ-специфических препаратов. Речь идет, во-первых, о стимуляции растворимой гуанилатциклазы и, во-вторых, об увеличении чувствительности растворимой гуанилатциклазы к эндогенному оксиду азота67. Риоцигуат обладает вазорелаксирующим, антипролиферативным и противовоспалительным эффектами.
Согласно результатам исследований, на фоне терапии риоцигуатом у пациентов с ЛАГ и ХТЭЛГ улучшаются функциональный статус, гемодинамические параметры, отмечается регресс явлений ремоделирования правых отделов сердца34, 52, 63–65, 68. У пациентов с ЛАГ риоцигуат снижает вероятность клинического ухудшения34.
В соответствии с евразийскими рекомендациями4, 5, риоцигуат может использоваться у пациентов с ЛАГ (стартовая монотерапия, оптимизация терапии в рамках стратегии переключения, в составе комбинированной терапии с АРЭ и/или ингаляционным илопростом), а также у пациентов с неоперабельной и резидуальной ХТЭЛГ69.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.