Идиопатическая нормотензивная гидроцефалия: современные подходы к диагностике и возможности медикаментозного лечения
- Аннотация
- Статья
- Ссылки
- English


Введение
К наиболее распространенным нейродегенеративным заболеваниям в пожилом и старческом возрасте, основным симптомом которых являются интеллектуально-мнестические расстройства, относят болезнь Альцгеймера (БА), смешанную и сосудистую деменцию, а также идиопатическую нормотензивную гидроцефалию (иНТГ). иНТГ, или синдром Хакима – Адамса, была впервые описана шведским нейрохирургом С. Хакимом в 1957 г., а термин «нормотензивная гидроцефалия» ввел в англоязычную литературу американский нейрохирург Р. Адамс в 1965 г. [1–3]. Распространенность иНТГ в популяции достигает 6% среди всех лиц с когнитивными расстройствами [1, 2]. Чаще иНТГ регистрируется у людей старше 60 лет: 0,2% случаев в возрасте 70–79 лет, 5,9% – в возрасте 80 лет и старше [3–5].
Полная триада Хакима – Адамса (когнитивные расстройства, нарушение походки и мочеиспускания) встречается редко. В основном имеют место два признака заболевания. Безусловно, патогномоничным симптомом заболевания считается изменение походки, которое может быть доминирующим либо единственным признаком иНТГ [4]. Возможно, нарушение походки связано с тем, что волокна кортико-спинального тракта, направленные к нижним конечностям, располагаются более медиально, то есть паравентрикулярно, в то время как пути, идущие к верхним конечностям, – более латерально. Изменение походки у пациентов с иНТГ также может быть обусловлено разобщением связей базальных ядер с лобными отделами и вторичной дисфункцией лобной коры. Пациенты ходят с широко расставленными ногами, уменьшаются высота и длина шага, снижаются ритм и скорость движения, появляются «заносы», инертность при поворотах. Такую походку можно охарактеризовать как магнитную, шаркающую или «с приклеивающимися ногами».
При иНТГ редко наблюдается ахейрокинезия, но мышечный тонус в ногах, как правило, повышен по пластическому типу, отмечается паратоническая ригидность [5–8]. В более тяжелых случаях в нижних конечностях возникают признаки центрального пареза: спастичность, гиперрефлексия, патологические стопные рефлексы [1, 2].
Когнитивные нарушения, развивающиеся у пациентов с иНТГ в начале заболевания достаточно быстро (в течение 3–12 месяцев) [1, 2], носят преимущественно дизрегуляторный характер и сопровождаются снижением скорости мыслительных процессов, апатией, снижением критики, ригидностью мышления и вторичными нарушениями памяти. На ранних стадиях заболевания гнозис и другие высшие корковые функции, как правило, не нарушены [2–6]. Если на фоне предполагаемой иНТГ выявлен тяжелый когнитивный дефицит, в большинстве случаев подразумевается наличие сопутствующей болезни Альцгеймера или других нейродегенеративных заболеваний. Частота подобной коморбидности может достигать 75% [7–17].
Еще одним компонентом триады Хакима – Адамса является нарушение функции тазовых органов. Уже в начале заболевания удается выявить учащенное мочеиспускание и никтурию. Впоследствии присоединяются императивные позывы и недержание мочи. Больные перестают чувствовать позывы и индифферентно относятся к факту непроизвольного мочеиспускания, что связано с подкорково-лобным разобщением [1, 2].
Нарушение венозного оттока может служить одним из ключевых факторов развития нарушений ликвородинамики и иНТГ. Повышение давления в корковых венах снижает так называемую податливость (эластичность) головного мозга [8–18]. Увеличение давления в верхнем сагиттальном синусе на 3–4 мм вод. ст. приводит к выравниванию градиента давления между верхним сагиттальным синусом и субарахноидальным пространством, резорбция цереброспинальной жидкости (ЦСЖ) пахионовыми грануляциями значительно снижается. Исследования показывают, что у взрослых увеличение давления в системе поверхностных вен не соответствует таковому в системе глубоких вен. Соответственно создаются предпосылки к трансэпендимальному току ликвора и его дренированию в систему глубоких вен. При этом давление ликвора не увеличивается, поскольку движущей силой является градиент давления между полостью боковых желудочков и системой глубоких вен головного мозга. Одновременно увеличение давления в корковых венах снижает пульсацию стенок артерий в субарахноидальном пространстве, что способствует передаче пульсовых волн сосудам микроциркуляторного русла без затухания, вызывая гиперпульсацию в паренхиме, в результате чего происходит прямое повреждение глиальной ткани в перивентрикулярной области, снижение эластического сопротивления и расширение желудочков [9–18].
Исходя из современных представлений, для установления диагноза иНТГ необходимо наличие полной или неполной триады Хакима – Адамса, характерных нейровизуализационных признаков и положительного tap-теста (тест Фишера). При его сомнительных результатах выполняют наружный люмбальный дренаж (external lumbar drainage, ELD) [2–6].
При наличии характерных клинических проявлений постановка диагноза иНТГ не вызывает трудностей. Сложности возникают, если в клинической картине превалируют интеллектуально-мнестические нарушения. Кроме того, в ряде случаев после выполнения диагностического tap-теста или даже оперативного лечения пациентов с иНТГ ожидаемого положительного эффекта не наблюдается. Сказанное предопределило необходимость изучения сопутствующей актуальной нейродегенеративной патологии и ее влияния на течение заболевания у данной группы пациентов [10–14].
Материал и методы
С целью изучения когнитивных функций и особенностей их профиля, нарушений функции ходьбы и специфических нейровизуализационных изменений при иНТГ, а также проведения дифференциальной диагностики с БА нами были обследованы 28 пациентов с диагнозом иНТГ (средний возраст – 68 ± 3,6 года), 22 больных БА (71 ± 5,6 года) и 15 пациентов с клиническими симптомами иНТГ и БА (81 ± 3,7 года).
Для определения состояния когнитивных функций применяли краткую шкалу оценки психического статуса (Mini-Mental State Examination, MMSE), тест «Батарея лобной дисфункции» (Frontal Assessment Battery, FAB), тест рисования часов (ТРЧ), «вербальные ассоциации» (литеральные (ЛИТ), категориальные (КАТ)), тест «5 слов», тест слежения (Trail Making Test, ТМТ-A, TMT-B), тест свободного и ассоциированного селективного распознавания (Free and Cued Selective Reminding Test, FCSRT) [1–3, 11, 12].
Для изучения специфических нейровизуализационных изменений пациентам выполнялась магнитно-резонансная томография (МРТ) по показаниям. Результаты МРТ анализировали с помощью:
- шкалы идиопатической нормотензивной гидроцефалии (iNPHRadScale), отражающей дилатацию ликворосодержащих пространств;
- MTA-шкалы, оценивающей состояние медиальной височной доли, а именно ширину хороидальной щели и височного рога бокового желудочка и высоту гиппокампа;
- шкалы атрофии теменной доли (шкала Koedаm), которая служит дополнением к МТА-шкале при анализе результатов МРТ у пациентов с БА и оценивает атрофию теменных долей;
- GCA-шкалы глобальной (диффузной) кортикальной атрофии (шкала Pasquier) – качественная система оценки разработана для определения церебральной атрофии. Данная шкала оценивает атрофию в 13 областях мозга, отдельно в каждом полушарии. Анализируются расширение борозд в лобной, теменно-затылочной и височной областях с двух сторон, дилатация боковых желудочков (отдельно каждый рог с двух сторон) и ширина третьего желудочка [1, 2].
При оценке МРТ особое внимание обращали на следующие показатели: индекс Эванса, угол мозолистого тела, расширение сильвиевых щелей, наличие перивентрикулярной гиперинтенсивности, расширение рогов боковых желудочков, атрофия медиобазальных отделов височной доли, теменной, лобной и затылочной долей с каждой стороны.
Наиболее чувствительным симптомом при иНТГ является нарушение ходьбы высшего уровня, которое встречается в 90% случаев заболевания. В основе патологии ходьбы высшего уровня лежат нарушения высшего контроля сенсомоторных функций, которые обеспечивают адекватную реакцию на внешние обстоятельства и реализацию намерений пациента. Для пациентов с иНТГ характерны замедление скорости ходьбы, обусловленное уменьшением длины шагов и трудностью при выполнении поворотов.
Для оценки ходьбы применяли тест «10 метров» и тест TUG (Timed Up and Go Test, тест «встань и иди», или тест со стулом). При выполнении первого теста пациент проходил от исходной точки десять метров, разворачивался, возвращался, вновь разворачивался и останавливался. Оценивали время прохождения всей дистанции и по отдельным отрезкам. При выполнении TUG учитывалось время, затраченноне на прохождение теста, и оценивалось наличие склонности к падениям. Пациент по команде поднимался со стула, проходил три метра, обходил препятствие, возвращался и снова садился на стул.
Результаты
При анализе характера и выраженности интеллектуально-мнестического дефицита установлено, что для больных иНТГ в основном характерны дизрегуляторные нарушения в отсутствие значимых изменений в мнестической сфере. Средний балл по шкале MMSE у пациентов этой группы составил 26,3 ± 0,5, по шкале FAB – 15,6 ± 0,65 и ТРЧ – 7,8 ± 0,4, что свидетельствовало о наличии лобной регуляторной дисфункции. Отмечалось также существенное увеличение времени, затраченного на выполнение теста слежения: TMT-A – 115,4 ± 36,3 с, TMT-В – 190,7 ± 40,5 с, что указывало на снижение скорости мыслительных процессов. Нарушение памяти, определяемое с помощью FCSRT, носило вторичный характер, а категориальная подсказка помогала пациентам при воспроизведении слов (свободное воспроизведение – 16,25 ± 0,75 слова, суммарное – 36,8 ± 3,5 слова). Как и ожидалось, у пациентов с БА преобладали мнестические расстройства преимущественно гиппокампального типа, что подтверждалось результатами FCSRT: свободное воспроизведение – 6,6 ± 0,5 слова, суммарное – 15,4 ± 1,1 слова.
Пациенты с синдромом БА-иНТГ помимо дизрегуляторных нарушений характеризовались наличием мнестического дефицита. Отмечались умеренно выраженная лобная дисфункция (FAB – 15,5 ± 0,5 балла) и специфичное нарушение выполнения ТРЧ (6,5 ± 0,5 балла) по смешанному типу: чаще пациенты не могли вначале расставить цифры на циферблате, затем стрелками указывали совершенно неправильное время. Но доминировали при синдроме БА-иНТГ именно мнестические нарушения (FCSRT: свободное воспроизведение – 11,6 ± 4,3 слова, суммарное – 27,8 ± 5,2 слова; тест «5 слов»: первый – 2 + 2 ± 0,15, второй – 4 + 0 ± 0,15).
В таблице 1 приведены результаты оценки когнитивных функций.
Наряду с нейропсихологическим тестированием необходима качественная интерпретация нейровизуализационной картины для установления диагноза иНТГ и проведения дифференциальной диагностики с нейродегенеративными заболеваниями. В этой связи анализ МРТ, выполненной каждому больному, проводили с применением унифицированной шкалы iNPHRadScale, МТА-шкалы, Koedam, GCA-шкалы [14–20].
Нейровизуализационные характеристики обследованных представлены в табл. 2 и 3.
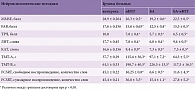
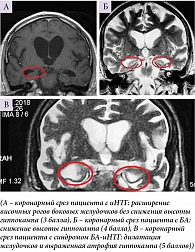
Нейровизуализационное исследование пациентов с иНТГ подтвердило расширение ликворосодержащих пространств, а именно высокий индекс Эванса (> 0,34), расширение сильвиевых щелей (с частотой 76%), острый угол мозолистого тела (69,0 ± 7,3°), наличие перивентрикулярной гиперинтенсивности в лобных, затылочных и смежных зонах (75%), сужение конвекситальных парафальцинарных борозд (48%), расширение рогов боковых желудочков до 6,5 ± 0,8 мм в 60% случаев в отсутствие выраженной атрофии головного мозга (рис. 1).
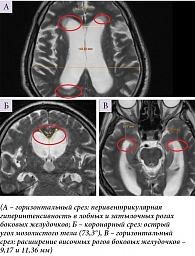
По шкале iNPHRadScale пациенты с БА набрали наименьшее количество баллов. Атрофические изменения выявлены в проекции медиобазальных отделов височных и теменных долей на фоне заместительной гидроцефалии (90%) (рис. 2).
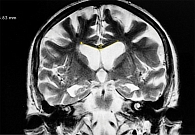
В группе пациентов с синдромом БА-иНТГ отмечалось сочетание нейровизуализационных признаков, характерных для обоих заболеваний: индекс Эванса > 0,3, перивентрикулярная гиперинтенсивность – 67%, расширение рогов боковых желудочков – до 6,4 ± 0,4 мм и сильвиевых щелей, тупой угол мозолистого тела – 122,9 ± 11,2°, церебральная атрофия – 42%, особенно в медиобазальных отделах височных и теменных долей – 95% (рис. 3).
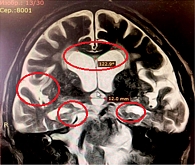
У пациентов с БА и БА-иНТГ наблюдалась наибольшая атрофия медиобазальных отделов височных (суммарный балл по шкале МТА составил 4,091 ± 0,19 и 5,0 ± 0 соответственно) и теменных долей (Koedam: 2,27 ± 0,14 и 2,0 ± 0,29) по сравнению с пациентами с иНТГ (МТА: 2,69 ± 0,19, Koedam: 0,41 ± 0,11) (рис. 4).
По шкале GCA у пациентов с иНТГ дилатация ликворосодержащих пространств (суммарный балл – 12,64 ± 0,8) преобладала над атрофией головного мозга (суммарный балл – 5,81 ± 0,81). Общий балл по шкале GCA – 18,41 ± 1,16.
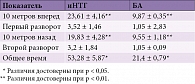
При оценке функции ходьбы установлено, что наибольшие сложности у пациентов с иНТГ вызывало прохождение первых десяти метров вперед. Пациентам контрольной группы на выполнение аналогичного задания потребовалось в 2,4 раза меньше времени (р < 0,01). Общее время, затраченное на выполнение задания, у пациентов с иНТГ было в два раза больше, чем у пациентов контрольной группы (р < 0,05).
Результаты теста «10 метров» представлены в табл. 4.
В методике теста со стулом (TUG-test) время, затраченное пациентами с иНТГ на выполнение всего задания, составило 30,2 ± 2,54 с. В контрольной группе этот показатель был значительно ниже и колебался в пределах 15,2 ± 0,89 с (p < 0,01).
Как видно из таблицы, практически по всем составляющим предложенной методики пациенты с иНТГ затрачивали значительно больше времени.
Согласно результатам исследования, при иНТГ нарушение когнитивных функций не считается ведущим симптомом, но имеет специфические особенности, выявление которых помогает в постановке правильного диагноза. Когнитивные нарушения носят дизрегуляторный характер, что проявляется брадифренией, аспонтанностью, апатией вследствие подкорково-коркового разобщения.
В настоящее время в отношении патофизиологической связи БА и иНТГ единого мнения не существует. На наш взгляд, наиболее убедительно объясняет подобную связь гипотеза о роли глимфатической системы. По оценке ряда авторов, увеличение отложения амилоида (А) бета42 при БА в мозговых оболочках приводит к большему сопротивлению оттока ЦСЖ [15].
Глимфатическая система – это ликворный путь элиминации продуктов обмена из головного мозга, функционирующий исключительно прижизненно, преимущественно во время сна. Нарушение работы глимфатической системы – одна из возможных причин развития иНТГ. Согласно этой теории, клиренс продуктов обмена в ткани головного мозга осуществляется ЦСЖ, движущейся по периваскулярным пространствам. Движение ликвора однонаправленное – от периартериальных пространств к перивенозным. Нарушение адекватного клиренса приводит к накоплению продуктов обмена. При этом снижается эластичность головного мозга. Однако ведущей теорией патогенеза иНТГ, с нашей точки зрения, является теория нарушения венозного оттока [7–17].
Определение сочетания этих двух состояний – задача сложная. Ошибочный диагноз иНТГ или БА предопределяет неудовлетворительный исход лечения. Выполнение ряда исследований, в частности нейровизуализационных (МРТ, компьютерная томография), развернутого нейропсихологического тестирования, а также применение инвазивных методов диагностики способны улучшить точность постановки диагноза.
Снижение уровня Aбета42 в ЦСЖ в некоторых исследованиях с участием пациентов с иНТГ и БА может подтверждать общность патогенеза двух заболеваний [9–18]. Для объяснения снижения уровня Aбета42 у пациентов с иНТГ были предложены различные гипотезы. Одна из них заключается в том, что поступление Aбета42 в ЦСЖ нарушается вследствие уменьшения центростремительного потока внеклеточной жидкости в головном мозге, вызванного ретроградным потоком ЦСЖ при иНТГ [1–3, 16–18]. На недостаточный эффект оперативного лечения влияет множество факторов, но наибольшее воздействие оказывает сопутствующая БА [6–20].
Анализ данных литературы показал, что оценка уровня белков – маркеров амилоидоза и нейродегенерации в ЦСЖ позволяет прогнозировать исход оперативного лечения.
Лечение при иНТГ преимущественно хирургическое – выполняются вмешательства в объеме ликворошунтирующей операции [7–15].
Применение ингибиторов карбоангидразы (ацетазоламид) обычно дает лишь временный и весьма незначительный эффект. В то же время улучшение венозного кровотока способно оказывать влияние на ликвородинамические нарушения. В исследованиях, проведенных на экспериментальных моделях болезни Альцгеймера, показано, что биоактивные флавоноиды, такие как диосмин, способствуют значительному снижению уровня бета-амилоида в паренхиме мозга. Диосметин, один из основных биоактивных метаболитов диосмина, увеличивает ингибирующее фосфорилирование GSK-3β, при этом избирательно снижает активность гамма-секретазы, генерацию бета-амилоида, гиперфосфорилирование тау-белка и провоспалительную активацию микроглии. Следовательно, и диосмин, и диосметин могут рассматриваться как потенциальные средства воздействия на нейродегенеративный процесс [21].
Обсуждение
Одна из основных составляющих патогенеза идиопатической нормотензивной гидроцефалии – нарушение венозного оттока. В частности, за счет повышения пульсового давления в системе сосудов микроциркуляторного русла паренхимы мозга формируется гиперпульсация, которая приводит к прямому повреждению глиальной ткани в перивентрикулярной области, снижению эластического сопротивления и расширению желудочков.
Согласно результатам проведенных исследований, при иНТГ нарушение когнитивных функций не является ведущим симптомом, но имеет специфические особенности, выявление которых помогает в постановке правильного диагноза. Установлено, что при иНТГ когнитивные нарушения носят дизрегуляторный характер, что проявляется брадифренией, аспонтанностью, апатией вследствие подкорково-коркового разобщения. Амнестический синдром неспецифичен и носит вторичный характер (при БА нарушение памяти – патогномоничный симптом) (p < 0,05). Дизрегуляторный и амнестический тип когнитивных расстройств у пациентов с синдромом БА-иНТГ указывает на связь с нейродегенеративным процессом (p < 0,05). При этом в клинической картине заболевания преобладают нарушения памяти.
При анализе результатов МРТ у пациентов с синдромом Хакима – Адамса отмечается расширение желудочковой системы без значительной атрофии паренхимы головного мозга. В отличие от пациентов с иНТГ у коморбидных больных имеет место сочетание расширения ликворосодержащих полостей (58%) и нейродегенеративных признаков (42%) (р < 0,01), особенно атрофия медиобазальных отделов височных и теменных долей, что свидетельствует о наличии активного нейродегенеративного процесса.
В 90% случаев заболевания иНТГ выявляется нарушение ходьбы. В отличие от пациентов с БА у пациентов с иНТГ замедляется скорость ходьбы, что обусловлено уменьшением длины шага и трудностью при выполнении поворотов (р < 0,01).
Выводы
Безусловно, в схеме лечения иНТГ первостепенное значение имеет оперативное вмешательство с наложением вентрикулоперитонеальногo, вентрикулоатриальногo или люмбоперитонеальногo шунта.
V.Yu. Lobzin, PhD, Prof., M.R.O. Alizade, S.V. Lobzin, PhD, Prof., A.V. Lapina, K.A. Kolmakova, PhD, G.V. Gavrilov, PhD, A.Yu. Yemelin, PhD, Prof., L.A. Alekseyeva, PhD, N.Ye. Monakhova, A.A. Albitskaya
Military Medical Academy named after S.M. Kirov
North-Western State Medical University named after I.I. Mechnikov
Children's Scientific and Clinical Center for Infectious Diseases, Saint-Petersburg
Contact person: Vladimir Yu. Lobzin, vladimirlobzin@mail.ru
The idiopathic normal pressure hydrocephalus (Hakim – Adams syndrome) is characterized by the expansion of cerebrospinal cavities, which is clinically manifested by triad of symptoms: cognitive impairment, impaired gait and urination. In this research the severity and modality of cognitive impairment and neuroimaging changes was evaluated for idiopathic normal pressure hydrocephalus. It has been established that for patients with idiopathic normal pressure hydrocephalus the most specific was dysregulatory type of disorders of cognitive functioning. The value of evaluating the results of magnetic resonance imaging using special techniques that evaluate both the expansion of the ventricular system and atrophy of the brain parenchyma. That is why it is necessary to use complex visually analog neuroimaging scales for differential diagnosis and establishing diagnosis. Also, in the course of this work, an algorithm is proposed for mandatory clinical-neuropsychological and laboratory-instrumental examination of patients with cognitive impairment in idiopathic normal pressure hydrocephalus.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.