Малотоксичные микросферы для направленной доставки доксорубицина
- Аннотация
- Статья
- Ссылки
- English


Введение
В эпоху развития персонализированной медицины необходимо создавать индивидуальные фармацевтические препараты, учитывающие метаболические особенности конкретного пациента. Для создания лекарственных форм нового поколения важно изучать возможности депонирования лекарственного вещества (ЛВ) в организме и особенности его пролонгированного высвобождения. Сказанное в большей степени касается лекарственных средств химиотерапевтической направленности.
Доксорубицин – противоопухолевый препарат широкого спектра действия. К наиболее опасным побочным эффектам этого препарата, ограничивающим его дозу, относятся кардиотоксичность и миелосупрессия.
Разработанная нами новая технология контролируемого высвобождения препарата может стать основой для создания малотравматичных интраартериальных методик лечения рака печени. Микросферы, содержащие доксорубицин, предполагается вводить в питающую опухоль артерию, где микросферы будут обеспечивать эмболизацию и контролируемую доставку препарата. При этом диаметр вводимых микросфер должен соответствовать диаметру сосуда.
Преимущество микросферной химиоэмболизации перед масляной заключается в том, что микросферы способны удерживать химиопрепарат в опухоли более продолжительный период времени, что повышает эффективность лечения. При этом токсическое воздействие цитостатика на организм уменьшается. Кроме того, появляется возможность изменять концентрацию химиопрепарата в зависимости от вида опухоли.
Таким образом, использование предложенной нами технологии доставки доксорубицина, исключающей его системное воздействие на организм, позволит улучшить качество жизни пациентов.
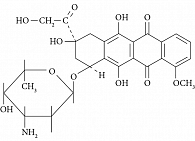
Доксорубицин – антибиотик антрациклинового ряда, выделенный из культуры Streptomyces peuceticus var. caesius. Молекулярная масса 579,99 Да. Красный кристаллический порошок или пористая масса. Умеренно растворим в воде, нерастворим в спирте. Нестабилен в растворах с рН менее 3 и более 7. На рис. 1 приведена структурная формула доксорубицина. Брутто-формула C27H29NO11.
Цель
Целью данной работы было получение, а также изучение микросфер на основе ПОБ для направленной доставки доксорубицина. Перед нами стояли задачи получить биополимерные микросферы на основе поли-3-оксибутирата, содержащие доксорубицин, изучить морфологию микросфер с помощью электронной сканирующей и световой микроскопии, а также кинетику высвобождения доксорубицина из микросфер.
Материал и методы
Для получения микросфер из ПОБ с инкапсулированным ЛВ применяли метод одноэтапного эмульгирования [1]. Доксорубицин и ПОБ (молекулярная масса от 220 до 280 кДа) в соотношении 1:4 растворяли в хлороформе (4 мл) и постепенно добавляли к 250 мл 1,2%-ного водного раствора поливинилового спирта (ПВС). Полученный раствор в течение двух часов перемешивали с помощью механической верхнеприводной мешалки RZR 2021 (Heidolph, Германия) при скорости 600–2000 об/мин. После полного испарения органического растворителя более однородные по размеру фракции микросфер фильтровали через текстильные фильтры. Затем микросферы отделяли от ПВС центрифугированием в течение шести минут при скорости 4400 об/мин на центрифуге 5702 R (Eppendorf, Германия). Далее трижды промывали водой для полного удаления эмульгатора и ЛВ на поверхности сфер. После этого микросферы сушили в термостате при температуре 37 °С и полученный порошок растирали в ступке. Процент ЛВ в микросферах определяли спектрофотометрически (по максимумам поглощения – 253 и 290 нм) для доксорубицина при сравнении с контрольным раствором ПОБ и ЛВ в хлороформе. Средний диаметр и стандартное отклонение полученных партий микросфер определяли по микрофотографиям.
Контролируемое высвобождение доксорубицина из микросфер проводили при температуре 37 °С в термостате TC-1/20 (Россия) в 4 мл 0,025 М калий-фосфатного буфера (pH = 7,4) с небольшим добавлением эмульгатора (0,05% Triton X-100 по объему) при перемешивании в пробирках на шейкере со скоростью 300 об/мин. При исследовании кинетики высвобождения доксорубицина через заданные интервалы времени (через один-два часа в течение первых суток, потом через одни-двое суток) микросферы отделяли от буфера центрифугированием на центрифуге 5702 R (Eppendorf, Германия) при скорости 14 000 об/мин и добавляли 4 мл свежего буфера. Содержание ЛВ в опытном растворе определяли спектрофотометрически (контроль 0,025 М калий-фосфатный буфер, рН = 7,2). Остаточное содержание доксорубицина в микросферах оценивали, растворяя их в заданном количестве растворителя, с последующим определением концентрации доксорубицина в растворе спектрофотометрически (253 и 290 нм) и сравнением с контрольными растворами известной концентрации доксорубицина.
Результаты и обсуждение
Были получены микросферы с массовой долей доксорубицина в полимере 9,7 ± 3,1%. Средний диаметр составил 40,6 ± 10,0 мкм. На рисунке 2 отображены микросферы, полученные с помощью световой микроскопии.
Для выявления более полной картины строения микросфер с включением доксорубицина был сделан ряд микрофотографий с помощью сканирующей электронной микроскопии (рис. 3). Как видно, морфология микросфер различна. Одни микросферы имеют мелкоячеистую структуру, другие – более крупную структуру. Иногда при формировании микросфер мелкая микросфера поглощается более крупной. В результате получаются двойные микросферы. Нередко микросферы образуют скопления: на крупных микросферах образуются мелкие, причем более мелкие вписываются в ячейки более крупной.
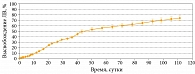
При изучении высвобождения доксорубицина из микросфер применяли метод контроль-релиза. Профиль высвобождения доксорубицина из микросфер представлен на рис. 4. Высвобождение носило долговременный пролонгированный характер. Это свойство кинетики доксорубицина может быть использовано при разработке малотоксичной длительной химиотерапии. Отсутствие берст-эффекта позволяет избежать влияния первоначального выброса и кардинально снизить токсическое действие на организм. Кроме того, химиотоксичность значительно снижается из-за отсутствия системного воздействия доксорубицина на организм. Это позволит значительно улучшить состояние больного во время лечения и повысить качество его жизни.
Таким образом, полученные результаты служат основанием для разработки малотоксичных химиотерапевтических форм доксорубицина длительного действия.
Согласно данным литературы, в настоящее время активно разрабатываются малотоксичные формы доксорубицина. Уже разработаны термолипосомы с включением доксорубицина [2]. Однако они подвержены очень быстрому разрушению и требуют специальных условий хранения и транспортировки. Микросферы с включением доксорубицина на основе ПОБ лишены этих недостатков.
Как известно, высвобождение ЛВ из биоразлагаемых микросфер предполагает три стадии: первая – взрывной эффект – высвобождение с высокой скоростью, вторая – относительно медленное равномерное высвобождение, третья – быстрое высвобождение, приводящее к полному выходу ЛВ из полимерных микросфер [3].
Известны два основных механизма высвобождения ЛВ из биополимерных систем: диффузия и деградация. Диффузия осуществляется через поры полимера, а также между цепями полимера. Первая стадия высвобождения (взрывной эффект) реализуется за счет диффузионного механизма [3], вторая – за счет двух механизмов, находящихся в равновесии: диффузии и деградации полимера, при которой уменьшается его молекулярная масса и, как следствие, повышается мобильность диффундирующего через полимер ЛВ. Деградация большинства биоразлагаемых полимеров осуществляется за счет гидролиза в объеме полимера и неспецифической ферментативной биодеструкции. На поздних этапах высвобождения деградация играет решающую роль, поскольку высвобождение ЛВ с относительно равномерной скоростью из биополимерной системы происходит благодаря деградации. Третья стадия высвобождения связана с быстрой деградацией полимера, утратившего механическую стабильность, и выходом оставшегося ЛВ [4–6]. Между тем, изучая кинетику высвобождения доксорубицина, мы обнаружили, что первой стадии высвобождения (взрывного эффекта) нет. То есть диффузионный процесс выражен очень слабо. Почему? Возможно, из-за высокой молекулярной массы ЛВ (молекулярная масса доксорубицина 579,99 Да). Практически полное отсутствие берст-эффекта может быть обусловлено также структурной формулой доксорубицина, а именно наличием большой неполярной четырехцикличной группировки. Вероятно, эта группировка за счет сильного гидрофобного взаимодействия с цепями полиоксибутирата тормозит процесс диффузии. Кроме того, гидроксильные группы в составе доксорубицина взаимодействуют с карбонильными и гидроксильными группами полиоксибутирата, образуя сильные водородные связи, что еще больше замедляет процесс диффузии. Высвобождение доксорубицина происходит линейно.
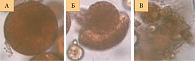
Морфологию деструкции микросфер изучали в процессе длительного высвобождения доксорубицина (120 суток). На рисунке 5 показаны три степени биодеградации микросфер.
На первой стадии наблюдается только начало деструкции. Поверхность сферы постепенно разрыхляется, и от нее отделяются полимерные нити. На второй стадии микросфера распадается на сегменты и полимерная масса выходит в окружающую среду. Третья стадия характеризуется полным распадом структуры полимерной матрицы.
Заключение
Получены малотоксичные микросферы на основе биосовместимого и биоразлагаемого полимера поли-3-оксибутирата с включением доксорубицина. Изучены морфология строения микросфер и кинетика пролонгированного высвобождения доксорубицина. За счет сильных гидрофобных связей между полимерной матрицей и молекулами доксорубицина высвобождение происходит в основном по деструкционному механизму, в то время как диффузионный механизм выражен очень слабо. Берст-эффект (взрывной эффект первоначального выброса) [3] практически не наблюдается. На основе анализа кинетики высвобождения доксорубицина in vitro выявлены принципиальные преимущества полученных пролонгированных лекарственных форм доксорубицина от традиционных лекарственных форм. В отличие от традиционных форм высвобождение доксорубицина из полимерной матрицы не вызывает резкого выброса ЛВ.
Таким образом, кинетический профиль высвобождения ЛВ из микросфер в наших экспериментах позволяет говорить о создании новых малотоксичных микросфер для направленной доставки доксорубицина. В то же время по сравнению с другими биосовместимыми полимерами, такими как полилактиды и полигликолиды, ПОБ характеризуется более высокой гидролитической устойчивостью. Не случайно завершающий этап разрушения биополимерной структуры отсутствует, резкого выброса ЛВ из микросфер не наблюдается [7].
Использование ПОБ позволяет создавать новые малотоксичные микросферы для направленной доставки доксорубицина. По сравнению с традиционной химиотерапией разработанные нами микросферные системы направленной доставки доксорубицина на основе ПОБ помогут снизить местную токсичность и избежать системной токсичности.
Ye.V. Filatova, A.P. Bonartsev, G.A. Bonartseva
Federal State Institution ῾Federal Research Centre ῾Fundamentals of Biotechnology’ of the Russian Academy of Sciences’
Lomonosov Moscow State University
Contact person: Yelena Viktorovna Filatova, 7887elena@mail.ru
Microspheres based on poly-3-oxybutyrate (POB) for a targeted delivery of the Doxorubicin drug were obtained. The kinetics of the Doxorubicin drug release from the microspheres were studied. Data on the kinetics of the Doxorubicin release suggests that the drug release mainly by the degradation mechanism. The diffusion mechanism is very weakly expressed due to the strong hydrophobic interactions between the polymer matrix and the Doxorubicin molecules. The burst effect, that is the explosive effect of the initial release, was practically not observed. The sustained release of the Doxorubicin drug can be used for a prolonged chemotherapy. The action of sustained release of the Doxorubicin from the polymer matrix was observed during 120 days. A new generation
of high-quality microspheres have a basis for the targeted delivery of the Doxorubicin drug which is used in the therapy of many oncological diseases. The low-toxic biocompatible POB-based microspheres with inclusion of the Doxorubicin will reduce the cytostatic dosage as well as increase the drug action efficiency.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.