Микросферы на основе полиоксибутирата как перспективные системы для адресной доставки дексаметазона
- Аннотация
- Статья
- Ссылки
- English


Введение
В настоящее время крайне актуальна разработка пролонгированных лекарственных средств на основе биосовместимых полимеров. Одним из них является полимер природного происхождения поли-3-оксибутират (ПОБ). В Институте биохимии им. А.Н. Баха Российской академии наук разработан способ его получения микробиологическим путем. Благодаря уникальным свойствам ПОБ может использоваться для инкапсулирования лекарственных веществ. Биоразлагаемый и биологически совместимый с организмом ПОБ обладает рядом физико-химических свойств, необходимых для создания полимерной матрицы при включении в нее микро- и макромолекул.
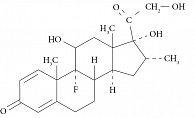
Дексаметазон – фторированный гомолог гидрокортизона, гормона, вырабатываемого корой надпочечников. Характеризуется иммунодепрессивными свойствами, используется как в гормональной, так и в химиотерапии. Представляет собой белый или почти белый кристаллический порошок без запаха. Растворим в воде (25 °C) – 10 мг/100 мл, ацетоне, этаноле, хлороформе. Молекулярная масса 392,47. Брутто-формула C22H29FO5. Структурная формула дексаметазона приведена на рис. 1.
Дексаметазон взаимодействует с глюкокортикоидными рецепторами, регулирует обмен натрия, калия, водный баланс и гомеостаз глюкозы. Стимулирует выработку ферментных белков в печени, действует на синтез медиаторов воспаления и аллергии, угнетает их образование. Дексаметазон тормозит высвобождение интерлейкинов 1 и 2, а также интерферона гамма из лимфоцитов и макрофагов, что обусловливает противовоспалительное, противоаллергическое, противошоковое и иммунодепрессивное действие. Дексаметазон применяется при системных заболеваниях соединительных тканей, острых и хронических воспалительных заболеваниях, а также онкологических заболеваниях, таких как лимфома, лейкемия, лимфолейкоз.
Дексаметазон также подавляет высвобождение гипофизом аденокортикотропного гормона, угнетает секрецию тиреотропного и фолликостимулирующего гормонов. Снижает количество лимфоцитов и эозинофилов, увеличивает количество эритроцитов. В клетке взаимодействует со специфическими цитоплазматическими рецепторами и образует комплекс, проникающий в ядро и стимулирующий синтез матричной рибонуклеиновой кислоты, которая индуцирует образование белка липокартина. Липокартин угнетает фосфолипазу А2, подавляет высвобождение арахидоновой кислоты и синтез лейкотриенов, сопровождающих воспалительный и аллергический процессы.
Выраженность и частота развития побочных эффектов зависят от дозы и длительности применения. Обычно имеют место повышение артериального давления, снижение толерантности к глюкозе, манифестация сахарного диабета («стероидный» сахарный диабет), ожирение гипофизарного типа, задержка полового развития у детей, «стероидная» язва желудка, тошнота, рвота, панкреатит, перфорация желудочно-кишечного тракта, аритмия, брадикардия, тромбоз. У пациентов с инфарктом миокарда могут отмечаться распространение очага некроза, замедление формирования рубцовой ткани. Со стороны нервной системы – дезориентация, эйфория, маниакально-депрессивный психоз, депрессия, паранойя, бессонница, судороги. Наблюдаются повышение внутриглазного давления с возможным повреждением зрительного нерва, склонность к развитию вторичных инфекций глаз. Со стороны обмена веществ – повышенное выведение Са2+, гипокальциемия, гипокалиемия, задержка жидкости и Nа+, миалгия, слабость и утомляемость, атрофия мышечной массы, замедленное заживление ран, атрофия кожи, «стероидные» угри, пиодермии. Возможны развитие и обострение инфекций. При ежедневном применении после пяти месяцев лечения развивается атрофия коры надпочечников. При внезапной отмене возникает синдром отмены глюкокортикостероидов – снижение аппетита, тошнота, заторможенность, генерализованные мышечно-скелетные боли, астения. Фармацевтически могут образовываться нерастворимые соединения с другими лекарственными средствами.
Новые технологии современной медицины, в частности создание пролонгированных форм дексаметазона, призваны снижать системные побочные явления. В настоящее время дексаметазон считается широко применяемым лекарственным средством как в гормональной терапии системных заболеваний, так и в химиотерапии онкологических заболеваний. В связи с этим приоритетным направлением является создание полимерных микросфер на основе лекарственного вещества (ЛВ) дексаметазона.
В качестве матрицы для создания микросфер перспективным представляется биоразлагаемый полимер ПОБ. Полимерная матрица микросфер включает ЛВ, которые медленно высвобождаются в течение длительного периода. ЛВ заключается в матрицу полимера, которая позволяет проникать препарату через поры, сформированные во время уплотнения сферы. Полимерный матрикс обеспечивает защиту ЛВ и позволяет молекулам ЛВ в сохранности достигать локального участка воздействия. Неоспоримым преимуществом является то, что многократная доза химиотерапевтического ЛВ может быть введена с помощью одной-единственной инъекции.
Микросферы с дексаметазоном могут вводиться перорально и инъекционно. Дозой высвобождения дексаметазона можно управлять за счет варьирования молекулярным составом полимера и его молекулярной массой. Так, регулирование числа гидрофильных и гидрофобных областей в молекулярной цепи полимера за счет введения сополимеров позволяет управлять высвобождением дексаметазона. Однако из-за большого количества гидрофильных областей не исключен начальный взрывной эффект с высвобождением существенной части химиотерапевтического лекарства. В этом случае процесс длительного высвобождения препарата невозможен. Следствием взрывного эффекта может стать увеличение токсичности препарата [1].
Размер микросфер также относится к детерминирующему фактору высвобождаемой дозы препарата. Из крупных сфер инкапсулированное ЛВ высвобождается медленнее, чем из более мелких микросфер. Доза высвобождения ЛВ уменьшается с увеличением диаметра сферы. Изменяя размер микросфер, можно достигать желаемой дозы высвобождения. Кроме того, высвобождением ЛВ можно управлять, смешивая микросферы разного размера [2].
Другим параметром, влияющим на скорость высвобождения, является молекулярная масса полимера. Низкомолекулярные полимеры образуют пористые микросферы, что обеспечивает быстрое высвобождение препарата. Микросферы из высокомолекулярного полимера более плотные. Как следствие – более медленное высвобождение. Желательную терапевтическую дозу высвобождения можно моделировать, комбинируя эти две фракции.
Таким образом, можно создавать системы контролируемого высвобождения на основе микросфер, которые способны уменьшать колебания концентрации ЛВ в крови по сравнению с традиционным препаратом. Микрокапсулированная форма дозирования химиопрепарата требует меньшей кратности введения, обеспечивает устойчивый профиль высвобождения и приводит к снижению уровня токсичности и негативных воздействий.
Химиотерапевтические лекарственные системы с контролируемым высвобождением должны отвечать определенным требованиям, а именно быть биосовместимыми и биобезопасными для организма. Время деградации полимерных микросфер колеблется от нескольких дней до нескольких месяцев и определяется кристалличностью, молекулярной массой и гидрофобностью полимера. Изменяя эти физические свойства, можно влиять на степень доступа воды к эфирным группам, а значит, управлять скоростью деградации.
Лекарственные системы с контролируемым высвобождением характеризуются определенным видом математической зависимости количества высвободившегося ЛВ от параметров, влияющих на процесс высвобождения ЛВ. Кинетика высвобождения инкапсулированного химиотерапевтического ЛВ включает три стадии: первая – взрывной эффект (берст-эффект) – высвобождение с высокой скоростью, вторая – относительно медленное равномерное высвобождение, третья – полное высвобождение ЛВ.
Существует два основных механизма, посредством которых ЛВ высвобождается из биополимерных систем, – диффузия и деградация. Диффузия осуществляется через поры полимера, а также между цепями полимера. Первая стадия высвобождения (взрывной эффект) реализуется за счет диффузионного механизма [3], вторая – за счет двух механизмов, находящихся в равновесии: диффузии и деградации полимера, при которой уменьшается его молекулярная масса и, как следствие, повышается мобильность диффундирующего через полимер ЛВ. Деградация большинства биоразлагаемых полимеров осуществляется за счет гидролиза в объеме полимера и за счет неспецифической ферментативной биодеструкции. На поздних этапах высвобождения деградация играет решающую роль, поскольку ЛВ с относительно равномерной скоростью высвобождается из биополимерной системы благодаря деструкции полимера. Третья стадия высвобождения происходит за счет быстрой деградации полимера, утратившего механическую стабильность, и выхода оставшегося ЛВ [4–6].
Цель
Целью данной работы была оценка свойств пролонгированных лекарственных форм дексаметазона, что предполагало создание биополимерных микросфер на основе ПОБ, содержащих ЛВ дексаметазон, изучение их структуры с помощью световой и электронной микроскопии, а также исследование кинетики высвобождения ЛВ из полученных микросфер.
Материал и методы
В качестве систем адресной доставки нами были синтезированы микросферы на основе ПОБ с включением дексаметазона в полимерную матрицу. ПОБ обладает уникальными свойствами, позволяющими использовать его для инкапсулирования ЛВ, поскольку сам по себе абсолютно нетоксичен для организма, биосовместим и биоразлагаем. Перед другими полимерами имеет ряд преимуществ. Речь идет о более низкой скорости биодеструкции по сравнению с полилактидами и полигликолидами, продолжительной функции депонирования, отсутствии резкого увеличения концентрации 3-оксимасляной кислоты в окружающих тканях при биодеструкции [7, 8]. Отметим, что при деградации полилактидов и полигликолидов происходит массовое высвобождение гликолевой и молочной кислот, что вызывает снижение уровня рН и закисление окружающих тканей [9, 10].
Для получения микросфер из ПОБ с инкапсулированным ЛВ применяли метод одноэтапного эмульгирования [11]. Этим методом были получены микросферы с включением дексаметазона. Для этого дексаметазон и ПОБ (молекулярная масса от 220 до 280 кДа) в соотношении 1:4 растворяли в хлороформе (4 мл) и постепенно добавляли к 250 мл 1,2%-ного водного раствора поливинилового спирта (ПВС). Перемешивание производили в течение двух часов при помощи механической верхнеприводной мешалки RZR 2021 (Heidolph, Германия) при скорости 600–2000 об/мин. После полного испарения органического растворителя наиболее однородные по размеру фракции микросфер получали фильтрованием через текстильные фильтры. Далее микросферы отделяли от ПВС центрифугированием (шесть минут при скорости 4400 об/мин) на центрифуге 5702 R (Eppendorf, Германия), затем три раза промывали водой для полного удаления эмульгатора и ЛВ на поверхности сфер. После этого микросферы сушили в термостате при температуре 37 °С и растирали полученный порошок в ступке. Процент включения ЛВ в микросферах определяли спектрофотометрически (по максимуму поглощения: 242 нм для дексаметазона при сравнении с контрольным раствором ПОБ и ЛВ в хлороформе). Средний диаметр и стандартное отклонение полученных партий микросфер оценивали по микрофотографиям.
В целях исследования высвобождения дексаметазона из микросфер был применен метод его высвобождения in vitro в течение 28 дней. Контролируемое высвобождение дексаметазона из микросфер проводили при температуре 37 °С в термостате TC-1/20 (Россия) в 4 мл 0,025 М калий-фосфатного буфера (pH = 7,4) с небольшим добавлением эмульгатора (0,05% Triton X-100 по объему) при перемешивании в пробирках на шейкере со скоростью 300 об/мин. При исследовании кинетики высвобождения дексаметазона через заданные интервалы времени (через один-два часа в течение первых суток, потом через одни-двое суток) микросферы отделяли от буфера центрифугированием при скорости 14 000 об/мин на центрифуге 5702 R и добавляли 4 мл свежего буфера. Содержание ЛВ в опытном растворе определяли спектрофотометрически (контроль 0,025 М калий-фосфатный буфер, рН = 7,2). Остаточное содержание дексаметазона в микросферах оценивали, растворяя их в хлороформе, с последующим определением концентрации в растворе спектрофотометрически, сравнивая с контрольными растворами известной концентрации.
Результаты и обсуждение
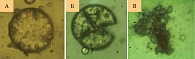
Были получены микросферы с массовой долей дексаметазона в полимере 9,8 ± 3,0% и средним диаметром 39,6 ± 9,3 мкм. Фотография этих микросфер сделана с помощью светового микроскопа (рис. 2).
Для более детального изучения свойств микрочастиц и структуры их поверхности использовалась электронная сканирующая микроскопия. На микрофотографиях, сделанных с помощью сканирующей электронной микроскопии, видна более полная структура микросфер с включением дексаметазона. При большем увеличении можно увидеть шероховатую поверхность сфер с отчетливо различимыми тяжами полимера (рис. 3).
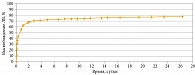
На рис. 4 представлен кинетический профиль высвобождения дексаметазона в 0,025 М фосфатном буфере (рН = 7,4) при температуре 37 °С. Как видим, за первые двое суток высвобождается 70% включенного дексаметазона. Это так называемый берст-эффект. В течение последующих 28 дней высвобождение становится равномерным и постоянным. Таким образом, первая фаза выброса дексаметазона из полимерной матрицы характеризуется взрывным эффектом, который скорее всего объясняется слабым гидрофобным взаимодействием между полимером и дексаметазоном. Высвобождение происходит по диффузионному механизму, что согласуется с данными литературы. В частности, показано, что полимерные системы с включением различных биологически активных веществ характеризуются диффузионным механизмом высвобождения, при котором ЛВ перемещается за счет диффузии к краю полимерного изделия и затем поступает во внешнюю среду [12]. Следующий этап высвобождения характеризуется степенной функцией. На поздних этапах высвобождение становится постоянным и характеризуется линейной функцией.
Если на первой стадии высвобождения дексаметазона из микросфер преобладают диффузионные процессы между водным буфером и ЛВ, то на более поздних этапах диффузия уступает место гидролитической деградации полимерной основы, что и объясняет линейность скорости высвобождения дексаметазона.
Скорость деградации полимерной матрицы описана в работах A.L. Iordanskii и соавт. [13] и R.T. Liggins и соавт. [14]. Установлено, что процесс диффузии и разрыхления структуры ПОБ связан с наличием концевых групп у ПОБ. Концевые группы ПОБ, являясь функциональными группами, мешают образованию совершенной структуры биополимера. В то же время они взаимодействуют с мобильными молекулами ЛВ и замедляют их диффузию.
На основании анализа кинетики высвобождения дексаметазона можно предположить, что на профиль высвобождения ЛВ влияют водородные связи функциональных групп ЛВ с карбонильной и гидроксильными группами ПОБ. Не исключено, что скорость высвобождения напрямую зависит от силы связывания этих групп.
Вероятно, функциональные группы дексаметазона характеризуются небольшой силой связывания с карбонильными и гидроксильными группами ПОБ. Концевые группы ПОБ непрочно удерживают молекулы ЛВ, что приводит к выраженной диффузии ЛВ из полимерной матрицы. Однако на последних этапах высвобождения, когда основное количество ЛВ уже вышло из матрицы, скорость высвобождения становится постоянной, и на нее в основном влияет процесс деструкции полимерной матрицы.
Для изучения биодеструкции полученных микросфер мы проводили инкубацию в фосфатном буфере в течение 90 дней. На первой стадии деградации микросферы разрыхляются и начинают разрушаться. Деградация отчетливо проявляется на 30-е сутки инкубации в фосфатном буфере – вторая стадия деградации. На 90-е сутки инкубации микросферы утрачивают привычную форму и представляют собой аморфную полимерную массу – третья стадия деградации (рис. 5).
Итак, гидролитическая деструкция микросфер с дексаметазоном включает следующие стадии: разрыхление полимерной матрицы микросферы, разделение ее на сегменты, деструкция полимера до мономерных звеньев. В конце концов сферы превращаются в аморфную массу полимера, впоследствии он полностью растворяется. Весь процесс занимает около трех месяцев.
Сравнивая полученные результаты с данными литературы о деградации микросфер на основе полилактидов и полигликолидов, можно отметить, что гидролитическая деструкция микросфер из ПОБ происходит медленнее. Это способствует более длительному пролонгированному высвобождению дексаметазона [6].
Анализ кинетики высвобождения ЛВ in vitro выявил принципиальные различия между полученными пролонгированными лекарственными формами дексаметазона на основе ПОБ и лекарственными формами на основе полилактидов и полигликолидов. В отличие от полилактидов и полигликолидов высвобождение ЛВ из ПОБ полимерной матрицы не вызывает резкого выброса ЛВ на третьем этапе. Так, в экспериментах по высвобождению 5-нитрофурфурилиденсемикарбазона из ПОБ-полимерной матрицы кинетический профиль высвобождения на начальной диффузионной стадии плавно переходил в линейную стадию и не включал третий этап – разрушение сетки полимера [15]. Таким образом, кинетические профили высвобождения ЛВ из ПОБ в наших экспериментах, а также в экспериментах R.Y. Kosenko и соавт. [15] качественно схожи. Поскольку гидролитическая устойчивость ПОБ превышает таковую полилактидов и полигликолидов, завершающий этап разрушения матрицы полимера отсутствует, равно как и резкий выброс ЛВ из микросфер. Все это позволяет рассматривать ПОБ как перспективный полимер для создания пролонгированных форм дексаметазона.
Заключение
Получены микросферы на основе биосовместимого и биоразлагаемого полимера ПОБ с включением дексаметазона. Изучена кинетика пролонгированного высвобождения дексаметазона из микросфер. Полученные данные свидетельствуют о том, что пролонгированное высвобождение обусловлено диффузией ЛВ из полимерной матрицы на начальном этапе и гидролитической деструкцией полимера на более поздних этапах.
По сравнению с традиционной терапией разрабатываемые нами микросферные системы адресной доставки дексаметазона на основе ПОБ позволят избежать системной токсичности и снизить местную токсичность.
Благодаря появлению новых малотоксичных лекарственных форм на основе биоразлагаемого ПОБ с контролируемым высвобождением дексаметазона дорогостоящие импортные лекарственные формы можно будет заменить экономически выгодными отечественными. Резервуарные свойства матричных систем позволят удерживать концентрацию дексаметазона, необходимую для осуществления адресной доставки и локального терапевтического действия в течение длительного периода в отсутствие побочных реакций. Использование биосовместимого и биоразлагаемого полимера ПОБ для создания пролонгированных форм дексаметазона значительно снизит не только количество дорогостоящего ЛВ, вводимого в организм, но и стоимость лечебного процесса.
Ye.V. Filatova, A.P. Bonartsev, G.A. Bonartseva
Federal State Institution ῾Federal Research Centre ῾Fundamentals of Biotechnology’ of the Russian Academy of Sciences’
Lomonosov Moscow State University
Contact person: Yelena Viktorovna Filatova, 7887elena@mail.ru
Microspheres based on poly-3-oxybutyrate (POB) with an inclusion of the Dexamethasone drug into a polymer matrix were obtained. The morphology, kinetics of the drug release from the microspheres were studied. Data on the kinetics of drug release suggests that a sustained release occurs by a drug diffusion from the polymer matrix at the initial stage and at the expense of hydrolytic degradation of the polymer at a later stage. The POB-based microspheres have a prolonged time action of the Dexamethasone drug release from the polymer matrix which was observed during 28 days. The studied system has a basis for the creation of new dosage forms with prolonged action of the Dexamethasone for many diseases therapy which is required the drug targeted delivery. The low-toxic POB-based microspheres with controlled Dexamethasone release can increase the drug action efficiency and reduce the drug dosage.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.