Менеджмент крови пациента при критическом кровотечении
- Аннотация
- Статья
- Ссылки

Введение
Отцы-основатели трансфузиологии полагали, что переливание крови эффективно во многих клинических ситуациях. Однако эта уверенность в спасительной роли переливания крови никогда не была подтверждена в проспективных контролируемых клинических исследованиях [1, 2].
Переливание крови влечет такие серьезные последствия, как:
- специфические риски (таблица) [3];
- увеличение расходов клиники [4];
- сложности управления запасами крови [5].
Особенно значимость и проблемы трансфузионной терапии проявляются у пациентов с критическим кровотечением. Идеология лечения таких пациентов эволюционирует от трансфузиологического обеспечения к гарантии качества трансфузионной терапии, а от нее – к менеджменту крови пациента (МКП) [6].
Озабоченность недостаточной эффективностью, безопасностью и высокой затратностью трансфузионной терапии стимулирует поиск клинических решений, альтернативных гемотрансфузиям и обеспечивающих сбережение крови пациента и сокращение расхода донорской крови
[7, 8].
Основные понятия
Критическое кровотечение – кровотечение, требующее массивной трансфузии, а также кровотечение небольшого объема в критическую зону или орган: внутричерепное, интраспинальное, интраокулярное.
Менеджмент крови пациента (англ. patient blood management) – основанный на доказательствах междисциплинарный подход к оптимизации лечения пациентов, которым может понадобиться переливание крови. МКП охватывает все аспекты обследования и лечения пациента, связанные с процессом принятия решения о гемотрансфузии, включая применение надлежащих показаний, а также минимизацию кровопотери в том числе медикаментозными методами. МКП может снизить потребность в переливании компонентов аллогенной крови и уменьшить расходы на здравоохранение, обеспечивая при этом доступность компонентов крови для пациентов, которым они необходимы [9, 10].
Во многом МКП соответствует идеологии кровесбережения [7], но несколько выходит за рамки трансфузиологии и нацелен на улучшение клинического исхода за счет отказа от ненужных гемотрансфузий.
МКП основывается на трех «столпах»:
- оптимизация объема крови и массы эритроцитов;
- минимизация кровопотери (в том числе медикаментозно);
- оптимизация переносимости анемии пациентом [11].
Эти три принципа применимы к любому гематологическому нарушению. МКП оптимизирует использование донорской крови и сокращает риск, ассоциированный с трансфузией.
Цели и методы менеджмента крови пациента вариабельны и зависят от клинической ситуации (острая массивная кровопотеря, реанимация, акушерство, педиатрия и т.д.).
Рассмотрим ключевые составляющие МКП при критическом кровотечении.
Протокол массивной трансфузии
В организации, лицензированной на оказание медицинской помощи по трансфузиологии, важно наличие трансфузиологического комитета [12], в задачи которого входит оказание помощи при критическом кровотечении. Для этого разрабатывается протокол массивной трансфузии (ПМТ), включающий дозу, время назначения и отношение переливаемых компонентов крови.
У пациентов с критическим кровотечением, требующим массивной трансфузии, использование ПМТ для своевременного и надлежащего применения эритроцитов и других компонентов крови может снизить риск летальности и острого респираторного дистресс-синдрома [11, 13].
Диагностика критического кровотечения
К основным составляющим менеджмента критического кровотечения относят раннюю оценку кровопотери, быстрый контроль источника кровотечения и быстрое восстановление объема циркулирующей крови.
Выделим элементы начальной оценки пациента с кровотечением:
- анамнез;
- систолическое артериальное давление;
- частота сердечных сокращений;
- пульсовое давление;
- периферическая перфузия;
- состояние сознания;
- частота дыхания;
- диурез;
- гемоглобин и гематокрит;
- состояние коагуляции;
- кислотно-основное состояние;
- температура.
Весьма часто недооцененной остается гипокальциемия, имеющая у пациентов с критическом кровотечением линейную зависимость с летальностью: отношение шансов 1,25 на снижение концентрации кальция 0,1 ммоль/л. В прогнозировании внутригоспитальной летальности гипокальциемия важнее гипофибриногенемии, ацидоза и тромбоцитопении. Существует связь между развитием тяжелой гипокальциемии (< 0,8 ммоль/л) и количеством доз перелитой плазмы и ацидозом [14].
Низкая концентрация кальция в плазме прямо коррелирует с большим объемом гематомы при остром внутричерепном кровотечении [15].
Добавление кальция к рациону беременных с высокой степенью доказательности снижает риск материнской летальности вследствие кровотечения при родах [16].
Мобилизация кальция играет важную роль в активации тромбоцитов [17].
Лечение критического кровотечения
Агрессивное восстановление объема циркулирующей крови чревато такими неблагоприятными последствиями, как отек, компартмент-синдром и острое повреждение легких. Гемодилюция усугубляет анемию, тромбоцитопению и коагулопатию. Кроме того, возможный разрыв сгустка увеличивает кровотечение.
Более эффективным считают сочетание допустимой гипотензии и минимального восстановления объема циркулирующей крови при поддержании систолического давления на уровне 80–100 мм рт. ст. Эта тактика предпочтительнее агрессивного восстановления объема циркулирующей крови до контроля активного кровотечения, но противопоказана при возможном повреждении головного мозга. На данный момент неизвестен безопасный нижний порог систолического кровяного давления и максимальная продолжительность безопасной гипотензии. В связи с этим применять данную тактику у пожилых пациентов следует с особой осторожностью [11].
Важнейший элемент лечения острого кровотечения – остановка кровотечения и хирургическое пособие на всех этапах медицинской эвакуации [18].
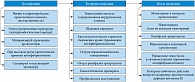
Максимальная летальность при травме отмечается у пациентов с гипотермией, ацидозом и коагулопатией – так называемой триадой смерти. Для улучшения выживаемости лечебные мероприятия должны быть направлены на профилактику и коррекцию этих осложнений. В обобщенном виде тактика минимизации кровопотери представлена на рисунке.
В настоящее время большинство руководств и рекомендаций по ведению пациентов с политравмой, осложненной массивной кровопотерей, предлагают раннее назначение транексамовой кислоты. Так, в 2011 г. Кокрановское сообщество опубликовало систематический обзор, посвященный четырем исследованиям антифибринолитических средств при травме, сопровождающейся острой кровопотерей. Полученные данные свидетельствуют, что назначение транексамовой кислоты снижает риск летального исхода на 10% (отношение рисков (ОР) 0,9; 95%-ный доверительный интервал (ДИ) 0,85–0,97; р = 0,0035). А в исследовании CRUSH-2 транексамовая кислота уменьшила риск смерти от продолжающегося кровотечения на 15% (ОР 0,85; 95% ДИ 0,76–0,96; р = 0,0077). Важно, что летальность при использовании транексамовой кислоты снижается только при раннем начале лечения (до 3 часов после травмы) [19, 20].
Дозирование транексамовой кислоты при травме осуществляется следующим образом: сначала вводится 10–15 мг/кг внутривенно, затем внутривенно капельно 1–5 мг/кг/час до прекращения кровотечения или хирургического гемостаза.
Включение транексамовой кислоты в комплектацию укладок и наборов для оказания скорой медицинской помощи (приказ МЗ РФ 549н от 07 августа 2013 г.) позволяет производить инфузию Транексама на догоспитальном этапе пациентам с политравмой и кровотечением.
В отечественных исследованиях также показано, что своевременное введение транексамовой кислоты позволяет снизить потребность в трансфузии донорских элементов крови и уменьшить риск посттрансфузионных осложнений [19].
Еще один немаловажный факт – у пациентов с критическим кровотечением, требующим массивной трансфузии, не получено достаточно доказательств для определения специфических соотношений переливания эритроцитов и других компонентов крови. Есть публикации, в которых показана эффективность соотношения перелитых доз «эритроциты : плазма» меньше 2 : 1. При углубленном анализе установлено, что во многом эти данные обусловлены «сдвигом выживаемости» – пациенты, умирающие вскоре после травмы, получают меньше плазмы, чем выжившие, поскольку срок от принятия решения до введения плазмы составляет 90 минут и более.
В отдельном травматологическом центре треть пациентов с критическим кровотечением успевали получить 10 и более доз эритроцитов до момента доставки размороженной плазмы [21].
Для сокращения периода подготовки плазмы к трансфузии в ряде стран внедрили хранение размороженной плазмы. Так, в США с 2008 по 2011 г. переливание плазмы сократилось на 13,4% – до 3 882 000 доз, а доля переливания размороженной плазмы, хранящейся при температуре +4 °С в течение 1–5 дней, достигла 30,4% (1 181 000 доз) от всех переливаний плазмы [22].
При немедленной доставке компонентов крови на начальном этапе коррекции критического кровотечения соотношение «эритроциты : плазма : тромбоциты», предположительно, может составлять 1 : 1 : 1, однако в настоящее время такое специфическое отношение нельзя рекомендовать из-за отсутствия доказательной базы [23].
У пациентов с критическим кровотечением, требующим массивной трансфузии, концентрацию гемоглобина следует оценивать в контексте гемодинамического статуса, перфузии органов и тканевой оксигенации.
Сбор и реинфузия собственной крови пациента с использованием современных аппаратов отмывания клеток эффективны и позволяют сберечь донорские эритроциты [24]. Наибольший опыт реинфузии при травме мирного времени накоплен в НИИ скорой помощи имени Н.В. Склифосовского [25].
Альтернативные способы повышения концентрации гемоглобина (железо, стимуляторы эритропоэза) при критическом кровотечении неэффективны. Применение кровезаменителей с газотранспортной функцией ожидает системных исследований [26].
В периоперационный период важна быстрая диагностика нарушений гемостаза (при помощи портативных устройств) в сочетании с алгоритмами лекарственной и трансфузионной
терапии.
Среди факторов гемостаза при кровопотере первой достигает критического уровня концентрация фибриногена [27].
Препараты фибриногена в России пока не зарегистрированы, поэтому для коррекции гипофибриногенемии при кровотечении нужно использовать криопреципитат. В 2011 г. в США было заготовлено 5 926 000 доз плазмы для трансфузий и приготовлено 1 690 000 доз криопреципитата, что на 15,6% больше, чем в 2008 г. (p < 0,05). Было выдано 172 000 пулированных (по 5 доз) криопреципитатов и 830 000 единичных доз [22]. Для сравнения: в России в 2011 г. приготовлено 29 273 дозы криопреципитата [28].
Важным средством коррекции гиповолемии являются плазмозамещающие растворы. На фоне роста интереса к сбалансированным (разность сильных ионов 24 мЭкв/л) кристаллоидным растворам [29] «драматические» события происходят с коллоидами [30]. Так, 14.06.2013 Комитет по оценке рисков, связанных с безопасностью лекарственных средств, Европейского агентства лекарственных средств (European Medicines Agency’s Pharmacovigilance Risk Assessment Committee – PRAC EMA) пришел к заключению, что в сравнении с кристаллоидами применение растворов гидроксиэтилкрахмала сопряжено с более высоким риском развития повреждения почек, требующего диализа, а также с риском увеличения летальности. В связи с этим PRAC EMA принял решение рекомендовать Координационной группе по взаимному признанию и децентрализованным процедурам (Group for Mutual Recognition and Decentralised Procedures – CMDh) приостановить на территории Европейского Союза обращение данных лекарственных средств [31].
За последние 50 лет завершено 80 рандомизированных клинических исследований по вопросу применения замороженной плазмы для остановки или профилактики кровотечения, однако убедительных данных, свидетельствующих о безопасности и эффективности трансфузий плазмы, не получено [32]. До сих пор имеется небольшое число доказательств существенной пользы инфузий плазмы, а метаанализ кардиологических исследований не выявил значимого отличия между экспериментальной и контрольной группами при кровопотере. Принимая во внимание хорошо известную аксиому: «самая безопасная трансфузия – та, которая не выполнена, если нет четких показаний», остается надеяться на организацию новых высококачественных исследований по применению плазмы, результаты которых позволят определить эффективность трансфузий и маркеры для ее оценки [10]. На практике концентраты факторов свертывания являются средством «последней надежды», которые следует предусмотреть пациентам с массивным кровотечением [33].
Лекарственные средства имеют приоритет над компонентами крови при остановке кровотечения [34].
Известно, что при массивной кровопотере может развиться патологическое состояние гиперфибринолиза. Травмы и травматичные хирургические вмешательства сопровождаются избыточным поступлением в кровоток активаторов плазминогена из тканей и эндотелия поврежденных сосудов, что у ряда больных истощает систему естественных ингибиторов плазмина. Гормоны стресса (адреналин и норадреналин) активируют фактор Хагемана и запускают хагеман-зависимый механизм фибринолиза. Именно поэтому в современной плановой и экстренной хирургии диагностику, профилактику и лечение гиперфибринолиза относят к важнейшим задачам интенсивной терапии кровопотери.
Ингибитор фибринолиза Транексам, конкурентно блокируя активный центр плазминогена, связывает плазмин и удлиняет тромбиновое время. Транексам обратимо блокирует эффект плазминогена и адгезию лейкоцитов и тромбоцитов на поверхность тромба, тормозит образование кининов и других пептидов, участвующих в воспалительных и аллергических реакциях. В настоящее время Транексам убедительно зарекомендовал себя как эффективное средство коррекции нарушений коагуляции на ранних сроках лечения травм, осложненных массивной кровопотерей.
Внедрение ПМТ в клинике
Трансфузиологический комитет должен адаптировать шаблон ПМТ с учетом следующих факторов:
- структура и персонал организации;
- доступ к компонентам крови и их логистика [5, 35, 36];
- коммуникация клиницистов, лаборатории и вспомогательного персонала;
- важность раннего привлечения трансфузиолога [37];
- особенности контингента пациентов.
Следует разработать должностные инструкции участников ПМТ, проводить соответствующие тренинги.
Важно учесть нормы законодательства, регулирующие правила активации и остановки ПМТ, минимизации отхода компонентов крови.
При активации ПМТ следует принять во внимание следующие факторы:
- причина и скорость кровотечения;
- механизм повреждения;
- состояние пациента;
- вероятная потребность в трансфузионной поддержке.
Правила активации и остановки ПМТ должны быть известны всем вовлеченным в процесс сотрудникам. Необходимо регулярно проводить проверку применения ПМТ [38].
Заключение
Переливание донорской крови несет специфические риски и увеличивает расходы клиники. В мире все активнее внедряют правила назначения компонентов крови, разработанные в соответствии с требованиями медицины, основанной на доказательствах. С 2013 г. необходимость наличия правил клинического использования донорской крови и ее компонентов предусмотрена и российским законом [39].
Исследования последних лет в основном показывают эквивалентность или преимущество ограничительной стратегии назначения гемотрансфузий над либеральной, расширенной практикой переливания крови.
В лечении пациентов с критическим кровотечением и массивной кровопотерей возрастает роль альтернатив трансфузиям аллогенной крови.
Широкое внедрение медикаментозных методов кровосбережения позволяет предупредить необоснованное введение донорских компонентов крови и увеличивает выживаемость больных с тяжелой сочетанной травмой, осложненной массивной кровопотерей.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.