Международные рекомендации по диагностике и лечению наследственных и приобретенных ангиоотеков
- Аннотация
- Статья
- Ссылки
- English






Введение
Наследственный ангиоотек (НАО) – редкая аутосомно-доминантная болезнь, вызываемая мутациями гена ингибитора C1 (C1-INH), приводящими к снижению уровня плазменного С1-ингибитора или нарушению функции белка. Впервые НАО описал У. Ослер (W. Osler) в 1888 г., а в 1963 г. В. Дональдсон (V.H. Donaldson) и Р. Эванс (R.R. Evans) охарактеризовали причину этого заболевания как биохимический дефект – дефицит ингибитора С1-эстеразы. По данным зарубежных публикаций, НАО встречается повсеместно с частотой примерно 1:50 000 – 1:100 000. В связи с низкой выявляемостью НАО и отсутствием достаточной информированности врачей других специальностей об этом заболевании достоверные данные о распространенности НАО среди населения России отсутствуют. Несмотря на редкую встречаемость, НАО представляет серьезную проблему практической медицины, что обусловлено тяжестью обострений, а в некоторых случаях высокой вероятностью летального исхода болезни.
Американская академия аллергологии, астмы и иммунологии (American Academy of Allergology, Asthma and Immunology – AAAAI), Американский колледж аллергологии, астмы и иммунологии (American College of Allergy, Asthma and Immunology – ACAAI), Европейская академия аллергологии и клинической иммунологии (European Academy of Allergology, Asthma and Clinical Immunology – EAACI), а также Всемирная организация аллергии (World Allergy Organisation – WAO) создали международные рекомендации по диагностике и лечению пациентов, страдающих наследственными и приобретенными ангиоотеками [1]. В этом согласительном международном документе нашли отражение последние достижения в области патогенеза изолированных ангиоотеков. Руководство содержит определение и классификацию ангиоотека, описывает особенности патогенеза, подходы к терапии и ведению пациентов. Рассмотрим основные положения этого международного консенсуса (2012). Надеемся, это поможет специалистам выстроить алгоритм обследования и эффективного лечения данного заболевания.
Механизмы развития брадикининовых ангиоотеков
Ангиоотек – это сосудистая реакция глубоких слоев кожи и слизистых оболочек, сопровождающаяся местным расширением и повышением проницаемости кровеносных сосудов, в результате чего возникает отек ткани [2]. Отек является асимметричным, при надавливании на нем не остается следов; отек исчезает бесследно. Ангиоотек вызывается временным повышением проницаемости кровеносных сосудов, опосредованным выбросом одного или нескольких медиаторов. Специфические клеточные механизмы, которые повышают проницаемость эндотелия при ангиоотеке, до конца не изучены. Однако основными медиаторами, вызывающими большинство случаев ангиоотеков, являются гистамин и брадикинин.
За возникновение ангиоотеков у пациентов с НАО ответственен брадикинин [3]. Именно поэтому, говоря о наследственных и приобретенных ангиоотеках, мы будем исходить из того, что на сегодняшний день эта группа изолированных ангиоотеков классифицируется как брадикининовые ангиоотеки. Брадикинин – это нанопептид, вырабатываемый при активации контактной системы, потенциально способный повышать сосудистую проницаемость путем связывания со своим рецептором (B2-рецептор к брадикинину) на эндотелиальных клетках сосудов. В зависимости от фармакологических свойств выделяют 2 подтипа рецепторов к брадикинину: BKR1 и BKR2. Брадикинин расщепляется из высокомолекулярного кининогена калликреином плазмы, который физиологически продуцируется из зимогена посредством активации фактора XII свертываемости крови (ФXII) при активации контактной системы. Механизм, который приводит к активации контактной системы in vivo, на сегодняшний день не изучен. В свою очередь, С1-ингибитор на нескольких этапах участвует в контроле активации контактной системы, являясь важным ингибитором ФXII и калликреина плазмы. При пониженном уровне или нарушении функции С1-ингибитора может возникнуть выброс брадикинина и образование ангиоотека [4, 5]. После воздействия инициирующего фактора недостаточность C1-ингибитора ведет к неадекватной выработке брадикинина – повышается сосудистая проницаемость, вызывая расширение сосудов и сокращение висцеральной гладкой мускулатуры, и последующий выход жидкости в ткани вызывает незудящий отек.
Таким образом, в плазме пациентов с брадикининовыми ангиоотеками наблюдается высокий уровень брадикинина ввиду недостаточности С1-ингибитора.
Классификация брадикининовых ангиоотеков
Опосредованный брадикинином ангиоотек может быть либо наследственным, либо приобретенным.
На сегодняшний день выделяют две формы НАО [4–8]: 1) НАО вследствие недостаточности С1-ингибитора и 2) НАО с нормальными или почти нормальными антигенными и функциональными уровнями С1-ингибитора.
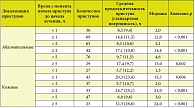
НАО вследствие недостаточности С1-ингибитора представлен двумя типами ангиоотеков и разделен на основании антигенного уровня С1-ингибитора: НАО 1-го типа (НАО-1) характеризуется низкими антигенными и функциональными уровнями С1-ингибитора, в то время как НАО 2-го типа (НАО-2) возникает вследствие дисфункции С1-ингибитора и характеризуется нормальным (или) повышенным антигенным, но пониженным функциональным уровнем С1-ингибитора (табл. 1).
В свою очередь существует два подтипа НАО с нормальным уровнем С1-ингибитора: НАО, возникающий по причине мутации фактора XII свертываемости крови, и НАО, возникающий по неизвестной причине. Первый подтип ранее называли эстрогензависимым вариантом ангиоотека, в настоящее время выделяют группу пациентов с рецидивирующими ангиоотеками и семейным анамнезом заболевания, у которых была выявлена мутация в гене, локализованном в V хромосоме и кодирующем XII фактор свертываемости крови. Наличие указанного генетического дефекта влечет за собой изменение его функциональной активности и, как следствие, нарушение кининового профиля, что приводит к повышению продукции брадикинина.
Помимо генетически детерминированной встречается приобретенная недостаточность ингибитора C1 (ПНИС), что выражается приобретенными ангиоотеками. Приобретенный ангиоотек отличается отсутствием у больных отягощенного наследственного анамнеза и поздним началом заболевания (в возрасте 40 лет и старше). Распространенные и редкие причины ПНИС могут быть связаны с патологией желудочно-кишечного тракта, гепатобилиарной системы и поджелудочной железы, системы органов дыхания, сердечно-сосудистой системы, нервной системы, опорно-двигательного аппарата, мочевыделительной системы, половых органов, эндокринного и метаболического генеза, возникать при гематологических заболеваниях и иммунодефицитных состояниях, а также при распространенных инфекционных и паразитарных заболеваниях. Так, описаны случаи приобретенных ангиоотеков на фоне ВИЧ-инфекции, множественной миеломы, различных лимфопролиферативных заболеваний, коллагенозов, хронических гепатитов В и С. Нередко ПНИС манифестируют за несколько лет до развития основного заболевания (табл. 2). Иногда такой ангиоотек является первым клиническим проявлением лейкоза [9].
Выделяют два типа приобретенных ангиоотеков. ПНИС 1-го типа связан с повышением катаболизма ингибитора С1-эстеразы при лимфопролиферативных заболеваниях. При ПНИС 2-го типа происходит продукция IgG- и IgM-аутоантител к ингибитору С1-эстеразы, что приводит к его инактивации.
Развитие ПНИС связано с образованием иммунных комплексов при лимфопролиферации, которые в избыточном количестве активируют систему комплемента, приводя к выработке большого количества анафилотоксинов. При ПНИС на фоне лимфопролиферативных заболеваний образуется большое количество антиидиотипических антител, формируются иммунные комплексы и происходит повышенное потребление С1q. В отличие от НАО, где синтез С1-ингибитора имеет дефект, ПНИС характеризуется наличием большого числа аутоантител, действующих на молекулы C1q и, следовательно, на С1-ингибитор. Повышенный катаболизм С1q превосходит регуляторные возможности С1-ингибитора, создается относительный дефицит последнего, что приводит к развитию брадикининовых отеков [9].
Ангиоотек также может вызываться ингибитором ангиотензин-1-превращающего фермента (ИАПФ), который препятствует разрушению брадикинина [5].
Особенности клинических проявлений брадикининовых ангиоотеков
Обычно НАО дебютирует в первые два десятилетия жизни, чаще в пубертатный период. Частота приступов – в значительной степени варьирующийся показатель. Чаще всего симптомы заболевания начинают беспокоить пациента в детстве [10–12] и более активно проявляться приблизительно в период полового созревания [10]. Потенциальным триггером обострения является механическая травма, интенсивность которой может быть разной – от легкого сдавления одеждой или легкого ушиба до перелома кости, хирургическое вмешательство, малоинвазивные диагностические процедуры, экстракция зуба, лекарственные препараты (ИАПФ, пероральные контрацептивы, содержащие эстроген, препараты заместительной гормональной терапии), инфекции, стресс, алкоголь. Для изолированных брадикининовых ангиоотеков характерна постепенная динамика симптомов: отеки достаточно медленно нарастают в течение 12–36 часов и разрешаются в течение 2–5 дней, а абдоминальные симптомы исчезают в течение 12–24 часов.
НАО-1/2
Клинические проявления НАО характеризуются рецидивирующими отеками различной локализации: кожи лица (губы, периорбитальная область), шеи, туловища, конечностей, слизистых оболочек верхних отделов дыхательных путей, желудочно-кишечного (приступообразная боль в животе) и урогенитального трактов. Приступы могут длиться от 72 до 96 часов и часто проходят в тяжелой форме, тем самым снижая дееспособность, качество жизни пациентов, и могут быть сопряжены со значительными осложнениями и риском смерти [13, 14].
Рецидивирующие периферические и абдоминальные отеки составляют 50% случаев всех приступов. Более чем у 50% пациентов в течение жизни происходит хотя бы один приступ верхних дыхательных путей с риском асфиксии. Многие атаки начинаются с продрома или ауры – обычно дрожь, покалывание, слабость, разбитость, мраморность кожи. Зуд и крапивница для НАО не характерны, однако примерно треть всех случаев ангиоотеков сопровождается гигантской кольцевидной эритемой (erythema annulare), обильными бледными высыпаниями мультиформного характера, не сопровождающимися зудом, жжением и местной гиперемией. Продромальный период предшествует приступу за несколько часов или за день (продолжительность действия предшествующих симптомов – до 1 дня) у 50% пациентов с НАО [12, 13].
НАО с нормальным уровнем C1-ингибитора
Клинические проявления НАО с нормальным уровнем С1-ингибитора напоминают проявления НАО-1/2, однако имеют следующие отличия: меньше приступов, интервалы между приступами длиннее, больше доля приступов периферических и фасциальных отеков, абдоминальные приступы происходят гораздо реже, отсутствие предшествующей приступу кольцевидной эритемы, выше возраст начала проявления приступов [15–17] (табл. 3). Отличительной особенностью болезни является зависимость симптомов от высокого уровня эстрогенов, соответственно, характерны обострения болезни во время беременности, применения пероральных контрацептивов или заместительной терапии эстрогенами при лечении климактерического синдрома. Болезнь чаще протекает тяжелее у женщин, чем у мужчин. В рамках наследственности предполагается аутосомно-доминантный тип наследования; однако пенетрантность при этом ниже, чем при НАО-1/2.
ПНИС
Симптомы ПНИС развиваются после 4-го десятилетия жизни и нередко на несколько лет опережают другие симптомы субклинически протекающего лимфопролиферативного заболевания. В остальном клиника абсолютно идентична наследственным ангиоотекам.
Ангиоотеки, вызываемые ИАПФ
Ангиоотеки, возникающие при приеме ИАПФ, имеют четкую локализацию – формируются фасциальные отеки, отеки гортани [18]. Реже встречаются абдоминальные ангиоотеки. Риск возникновения ангиоотека при приеме ИАПФ выше среди курильщиков, афроамериканцев и женщин; у пациентов с сахарным диабетом риск возникновения ангиоотека, вызванного приемом ИАПФ, ниже [18–21]. Ангиоотек чаще всего проявляется в первый месяц лечения ИАПФ; однако более чем у 25% пациентов первый приступ ангиоотека происходит через шесть месяцев от начала лечения ИАПФ или позже; у некоторых пациентов первый приступ произошел после нескольких лет приема ИАПФ. Приблизительно у 50% пациентов наблюдается рецидив ангиоотека, продолжительность которого исчисляется в месяцах после отказа от ИАПФ [22].
Диагностика брадикининовых ангиоотеков
НАО вследствие недостаточности C1-ингибитора
Для НАО 1-го типа характерен низкий уровень С1-ингибитора, тогда как при НАО 2-го типа уровень С1-ингибитора может сохраняться в норме или даже превышать нормальные значения при низких показателях функциональной активности С1-ингибитора. При снижении С8-, С9-компонентов комплемента возможно более тяжелое течение заболевания. У детей исследования уровня С4-компонента комплемента и уровня и функциональной активности С1-ингибитора рекомендуется проводить в возрасте старше 1 года. Определение уровня С4 является основным, оправданным по затратам скрининговым тестом при наследственных отеках, однако в редких случаях С4 может быть нормальным между атаками. При нормальном уровне С4-фракции вероятность отсутствия НАО у пациента составляет 96% и, как правило, нет необходимости в дальнейших диагностических процедурах. Нормальный уровень C4 при приступах ангиоотека является сильным аргументом в пользу другого диагноза.
Применяются следующие лабораторные критерии диагноза НАО:
- уровни антигена С1-ингибитора, составляющие < 50% от нормы (при двух отдельных определениях) у пациента в возрасте более 1 года вне приступа;
- уровни функциональной активности С1-ингибитора < 50% от нормы (при двух отдельных определениях) у пациента в возрасте более 1 года вне приступа;
- мутация гена С1-ингибитора, приводящая к нарушению синтеза и/или функции соответствующего белка.
Следует подчеркнуть важность обследования близких родственников больного, так как лица с неустановленным диагнозом НАО в 35% случаев подвержены риску смерти.
НАО с нормальными или почти нормальными антигенными и функциональными уровнями C1-ингибитора
Рекомендовано проведение генетического исследования пациентов для выявления мутации в гене, локализованном в V хромосоме и кодирующем XII фактор свертываемости крови. При обнаружении мутации диагноз НАО с нормальным уровнем С1-ингибитора может быть подтвержден. Однако отсутствие мутации ФXII-гена не исключает данный диагноз [13, 23, 24].
ПНИС
При подозрении на ПНИС следует в каждом случае провести поиск возможного лимфопролиферативного заболевания, системной красной волчанки, гепатита или других заболеваний. Важным отличием ПНИС является низкий уровень С1q-компонента комплемента, поэтому определение С1q имеет существенное значение для дифференциальной диагностики приобретенных и наследственных брадикининовых ангиоотеков. Кроме того, у пациентов с ПНИС целесообразно исследование уровня антитела к С1-ингибитору для исключения аутоиммунного механизма ПНИС (табл. 4).
Лечение брадикининовых изолированных ангиоотеков
Лечение НАО можно разделить на лечение приступов (лечение по необходимости) и профилактическое лечение (краткосрочное и долгосрочное). У всех пациентов с недостаточностью С1-ингибитора должен быть составлен индивидуальный план по методам купирования ангиоотеков и долгосрочной профилактике приступов.
Первичная профилактика приступов
Первичная профилактика приступов предполагает:
- выявление триггерных факторов приступов:
- инфекции (например, Helicobacter pylori);
- эстрогены (контрацептивы и заместительная гормональная терапия);
- лекарственные препараты (ИАПФ / блокаторы рецепторов AT-1);
- физический и эмоциональный стресс (жара/холод, чрезмерная физическая нагрузка);
- решение о начале лечения должно приниматься в результате сотрудничества пациента и врача.
Длительная профилактика приступов
Стандартные при ангиоотеке средства лечения, такие как эпинефрин, глюкокортикостероиды или антигистаминные средства, абсолютно не эффективны и не рекомендуются для лечения пациентов с брадикининовыми ангиоотеками.
Показаниями для назначения долгосрочной профилактической терапии являются:
- более 1 тяжелого приступа НАО в месяц или
- более 1 абдоминального приступа в год или
- отеки в области лица и шеи или
- частые периферические отеки или
- отеки в области гениталий.
В качестве длительной базисной терапии НАО используют препараты из группы аттенуированных андрогенов, ингибиторов фибринолиза [25–27] (табл. 5).
При назначении препаратов нужно помнить, что и эффективность воздействия, и побочные эффекты 17-альфа алкилированного андрогенного стероида дозозависимы [25, 29, 30]. Таким образом, у всех пациентов назначенные дозы базисного препарата должны медленно стремиться к наиболее низким, но способным контролировать заболевание. Основным ориентиром при подборе дозы является клиника заболевания – отсутствие рецидивов. Лабораторные тесты неинформативны и не являются ориентиром для дозирования.
Краткосрочная профилактика приступов
Оперативные вмешательства, малоинвазивные диагностические процедуры, стоматологические манипуляции могут послужить причиной приступа ангиоотеков. Вследствие этого больные с НАО нуждаются в специальной подготовке перед оперативными вмешательствами (экстракции зубов, эндоскопические исследования, полостные операции и др.).
С целью профилактики рекомендуется назначать даназол из расчета 10 мг/кг/сут (максимальная суточная доза – 600 мг) за 5 дней до и 2 дня после вмешательства или блокаторы фибринолиза за 48 ч до и 48 ч после вмешательства (аминокапроновая кислота 8–12 г/сут в 3–4 приема перорально или транексамовая кислота 1–3 г/сут в 2–3 приема) [31, 32]. При срочных операциях за 1 час до операции или непосредственно перед оперативным вмешательством назначаются инфузии 300–400 мл свежезамороженной плазмы. Краткосрочную профилактику можно проводить посредством введения 1000–2000 U концентрата С1-ингибитора или, при отсутствии такового, посредством инъекции 2 U (10 мл/кг для детей) обработанной методом «растворитель/детергент» плазмы или свежезамороженной плазмы за несколько (до 6) часов до начала запланированной процедуры [31, 33, 34]. Ввиду отсутствия исследований по оценке сравнительной эффективности этих препаратов при краткосрочной профилактике, рекомендации основаны на экспертном мнении и небольших неконтролируемых наблюдательных исследованиях [32, 35]. Для проведения процедур неотложной помощи и для беременных пациенток предпочтительно введение концентрата С1-ингибитора [36]. Доза препарата при краткосрочном лечении по необходимости (С1-ингибитор, экаллантид или икатибант) должна быть доступна в готовом виде, в частности при проведении стоматологических процедур или операций, в рамках которых требуется интубация.
Лечение острого приступа НАО
В настоящее время для лечения НАО рекомендованы и применяются на практике в различных странах препараты, представленные в таблице 6. Эти препараты эффективны и безопасны как для лечения острых атак, так и для краткосрочной профилактики приступов ангиоотеков [9]. Эффективность препаратов максимальна, если их вводить в начале приступа.
В Российской Федерации чаще всего при лечении приступа НАО применяют свежезамороженную плазму, которая содержит С1-ингибитор из расчета 10–15 мл/кг/сут. В сравнении с андрогенами лечение свежезамороженной плазмой более дорогостоящее и менее безопасное, так как связано с риском инфицирования (гепатит В и С, ВИЧ-инфекции), но в целом считается более эффективным в предотвращении или минимизации атак [37]. Международные рекомендации указывают, что «свежезамороженная плазма должна использоваться для лечения приступов НАО, когда другое проверенное эффективное лечение недоступно. Свежезамороженная плазма в целом эффективна при лечении острых приступов ангиоотека; однако иногда эффективность не проявляется или может произойти резкое ухудшение в отношении симптомов» [38]. Также в соответствии с рекомендациями при остром приступе НАО необходимо увеличить дозу базисной терапии даназолом.
Лечение особых групп: дети, женщины, беременные
Изменение уровня эстрогена в связи с половым созреванием, менопаузой или заместительной гормональной терапией, пероральным принятием противозачаточных средств или беременностью может вызвать или привести к развитию тенденции к более частым и/или тяжело протекающим приступам у некоторых женщин с недостаточностью C1-ингибитора [35]. В отношении беременных пациенток с более серьезными приступами НАО проведение долгосрочной профилактики считается целесообразным вмешательством, поскольку возможность благотворного действия удовлетворяет критериям «риск/польза», определяемым для данного лечения [39]. Долгосрочная профилактика при беременности подбирается индивидуально, в тесном взаимодействии с пациенткой. Лечение андрогенными стероидами противопоказано в период беременности [28], предпочтение отдается концентрату C1-ингибитора, применение которого также рекомендовано женщинам, которые планируют беременность [40]. Приступы ангиоотека при родах и родоразрешении возникают относительно редко. На данный момент клинические исследования эффективности и безопасности новых препаратов у детей не проводились. Однако согласно клиническому опыту по применению C1-ингибитор-заместительной терапии у детей использование данных препаратов предпочтительно с точки зрения «риск/польза» [41].
Идентификация брадикинина как ключевого медиатора симптомов НАО привела к клинической разработке икатибанта, антагониста рецептора брадикинина B2, в качестве способа лечения НАО 1-го и 2-го типов. Икатибант получил лицензию в 38 странах мира в качестве препарата, вводимого подкожно специалистами здравоохранения или самостоятельно, для лечения приступов НАО 1-го и 2-го типов у взрослых пациентов. Специфический антагонист рецепторов (В2) брадикинина (икатибант) зарегистрирован и в России под торговым наименованием Фиразир для лечения острых приступов НАО. Фиразир – синтетический декапептид с аналогичной брадикинину структурой и одинаковой аффинностью к В2-рецепторам, специфичен к В2-рецепторам и обладает достаточным биологическим периодом полувыведения. Вводится подкожно в острую фазу отека по 3 мл (шприц в комплекте с иглой инъекционной) [9].
Противопоказаниями для применения препарата являются:
- повышенная чувствительность к компонентам препарата (активному веществу и вспомогательным веществам);
- одновременный прием ИАПФ;
- детский возраст до 18 лет (эффективность и безопасность применения не установлены).
Фиразир рекомендуется применять с осторожностью при сопутствующей ишемической болезни сердца (ИБС), поскольку, учитывая свойства антагониста рецепторов брадикинина 2-го типа, нельзя исключить возможность ухудшения функции миокарда и снижения коронарного кровообращения. Икатибант также может снижать положительный нейропротективный эффект брадикинина поздней фазы, хотя отмечен факт положительного влияния блокады рецепторов B2 в острый период нарушения мозгового кровообращения. Следовательно, назначать икатибант пациентам в первые недели инсульта можно только при развитии жизнеугрожающих отеков, под строгим наблюдением врача.
Препарат рекомендован для самостоятельного введения пациентами.
Большой интерес представляет один из последних обзоров по результатам использования икатибанта. Проведено международное проспективное наблюдательное исследование, в котором проанализированы данные пациентов, получавших икатибант при приступах НАО в период июль 2009 г. – февраль 2012 г. [42]. В анализ включено 426 приступов различной локализации у 136 пациентов с НАО 1-го и 2-го типов. Самостоятельное введение икатибанта приводило к раннему облегчению симптомов и к сокращению продолжительности приступов в сравнении с лечением специалистами здравоохранения. На долю приступов, которые лечили в срок 1 час с момента начала приступа, приходилось в два раза больше пациентов, самостоятельно вводивших икатибант, чем пациентов, которым икатибант вводили специалисты здравоохранения (44% приступов против 22% приступов соответственно; p = 0,001). Икатибант вводился в течение первых 2 часов с момента начала отека более чем в 60% случаев пациентами в группе самостоятельного введения препарата против 44% случаев приступов у пациентов, помощь которым оказывали специалисты здравоохранения (p = 0,016). Продолжительность приступов, которые лечили самостоятельно, была короче, чем таковая приступов, которые лечили специалисты здравоохранения (p < 0,05). Так, доля приступов длительностью до 4 часов составила 25,8% против 39%, от 4 до 10 часов – 25,8% против 13,7% и более 10 часов – 48,5% против 47,3% у пациентов, которым инъекции икатибанта делали специалисты здравоохранения, и у пациентов, вводивших икатибант самостоятельно, соответственно.
Результаты этого исследования показали, что раннее применение икатибанта у пациентов с приступами НАО 1-го и 2-го типов (в частности, в течение 1 часа с момента начала приступа) приводит к уменьшению продолжительности приступа ангиоотеков вне зависимости от его локализации (абдоминальный или кожный) или степени его тяжести. Приступы, которые находятся на ранней стадии развития, лучше поддаются лечению, чем приступы, которые продолжаются длительное время (табл. 7).
В ходе исследования не было отмечено статистически значимых отличий во времени разрешения приступа при введении икатибанта самостоятельно или специалистом здравоохранения. При этом режим самостоятельного введения икатибанта предпочтителен, так как по причине более раннего введения препарата сокращалась продолжительность приступа. Введение пациентом Фиразира самостоятельно упрощает лечение, сокращает продолжительность приступов, уменьшает потребность обращения за помощью к специалистам здравоохранения пациентов, у которых возникают приступы отека гортани. Все вышеперечисленные характеристики могут оказать положительное влияние на контроль НАО.
Несмотря на то что неясно, почему раннее лечение икатибантом является более эффективным, чем введение препарата по прошествии нескольких часов (особенно в связи с тем, что приступы ангиоотеков могут развиваться в течение первых 12–24 часов), тем не менее результаты этого исследования имеют большое значение и свидетельствуют в пользу применения икатибанта в режиме раннего самостоятельного введения. Пациентам, у которых возникают приступы отека гортани, рекомендовано обратиться за медицинской помощью после введения препарата.
Вместо заключения
Непредсказуемый характер и тяжесть протекания НАО сопряжены с физическим, эмоциональным и экономическим бременем для пациентов и их семей.
Авторы международного консенсуса по лечению наследственного и приобретенного ангиоотека рекомендуют включать в национальные программы развития здравоохранения следующие пункты:
- образовательные программы по НАО для населения и специалистов в области здравоохранения;
- улучшение доступности лабораторных анализов;
- основание справочных центров по НАО в каждом регионе;
- создание групп поддержки для пациентов и с целью помощи специалистам в области здравоохранения.
International guidelines for the diagnosis and management of hereditary and acquired angioedema
O.S. Drobik
State Budgetary Educational Institution for Continuing Professional Education 'Russian Medical Academy for Postgraduate Education', Clinical Allergology Department
Contact person: Olga Sergeyevna Drobik, olga-drobik@mail.ru
The author presents current concept of pathogenesis of bradykinin-mediated isolated angioedema. Diagnosis, therapy and management of hereditary and acquired angioedema are discussed according to the recent international guidelines.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.